电解液组成对医用钛合金微弧氧化生物陶瓷层的影响
2014-03-09马维红吴连波李兴照
马维红,吴连波*,李兴照
(长春工业大学材料科学与工程学院,吉林 长春 130012)
钛及钛合金作为重要的生物医用材料,广泛应用于人工骨、人工关节、口腔植入物、整形外科等医学领域[1]。由于钛合金本身属于生物惰性材料,作为外科植入物植入人体后,仍存在着结合强度低、生物相容性差、愈合时间长等问题[2]。目前常通过在钛合金表面涂覆羟基磷灰石(HA)来改善其生物相容性,但涂层与基体结合强度低,易开裂,大大影响了使用效果[3-4]。
目前,研究者们[5-7]在含钙和磷组分的电解液中对钛合金表面进行微弧氧化,在其表面原位生长出富含钙、磷元素的生物改性多孔二氧化钛陶瓷层,膜层具有高抗磨损、抗腐蚀和生物相容性,大大提高了医用钛合金的生物活性和临床使用性能。
HA中钙、磷元素含量的比值为1.67,要想得到更具生物相容性的陶瓷膜,需使膜层中钙、磷元素含量与HA一致[8],这就要求严格控制电解液组分。本文主要研究了钙盐含量和添加剂EDTA-2Na含量对微弧氧化陶瓷膜表面形貌、孔隙率以及膜层中钙、磷原子比和相组成的影响。
1 实验
1.1 材料预处理
基体为 30 mm × 20 mm × 1 mm 的 Ti–6Al–4V 钛合金,依次采用400#、600#、1000#金相砂纸对钛合金表面进行打磨,丙酮、去离子水超声清洗后,烘干备用。
1.2 微弧氧化
采用哈工大中俄科学技术合作有限公司研制的MHD-30型双极性脉冲微弧氧化设备,以基体为阳极,不锈钢槽体为阴极。电解液组成和工艺参数为:K2HPO4·3H2O 6.8 g/L,Ca(CH3COO)28.8~26.5 g/L,EDTA-2Na(乙二胺四乙酸二钠)10~30 g/L,温度25~30 °C,电流密度12 A/dm2(正负电流比 2∶1),脉冲频率650 Hz,正、负占空比均为20%,氧化时间10 min。
1.3 性能检测
用日本电子公司 JSM-5500LV型扫描电镜(SEM)观察陶瓷层的微观结构;用美国Media Cybernetics公司推出的Image-pro plus 6.0软件分析陶瓷层表面孔隙率及孔径;用日本电子公司 JSM-5500LV型扫描电镜附带的能谱仪(EDS)分析陶瓷层表面元素组成;用日本理学公司D/max-RB型X射线晶体衍射仪(XRD)分析陶瓷层的相组成。
2 结果与讨论
2.1 乙酸钙质量浓度对微弧氧化陶瓷层的影响
2.1.1 微弧氧化陶瓷膜表面形貌
图 1为钙盐质量浓度不同时氧化陶瓷膜的表面形貌,可以看出膜层表面粗糙不平,存在微米级和亚微米级的火山口状小颗粒。在临床上,粗糙的表面有利于促进骨细胞粘附、增殖、分化,并且孔洞的存在可使骨细胞易沿着孔隙生长,提高骨组织与植入钛合金之间的结合强度。

图1 乙酸钙质量浓度不同时陶瓷膜的SEM照片Figure 1 SEM images of ceramic coatings obtained at different mass concentrations of calcium acetate
采用Image-pro plus 6.0软件测得钙盐含量为8.8、17.6和26.5 g/L时,陶瓷膜层的孔隙率分别为8.25%、8.43%和8.67%。这说明钙盐质量浓度对孔隙率的影响不大,随钙盐质量浓度增大,孔隙率只是略微提高。
2.1.2 微弧氧化陶瓷膜的钙、磷元素含量
图2为微弧氧化陶瓷层中Ca、P原子分数和Ca、P原子比随钙盐质量浓度变化的曲线。
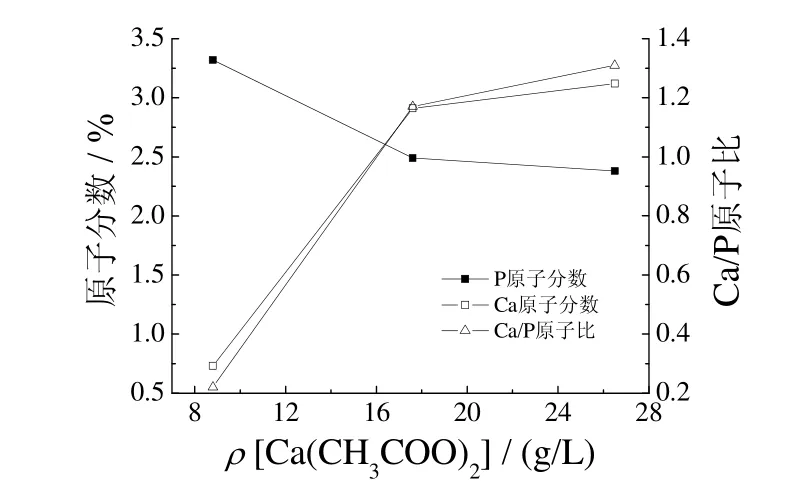
图2 乙酸钙质量浓度对陶瓷膜组成的影响Figure 2 Effect of mass concentration of calcium acetate on composition of ceramic coating
从图 2可以看出,随钙盐质量浓度增大,膜层中Ca元素的原子分数增大,开始时增大得较明显,之后趋于平缓,而膜层中P元素的原子分数略有减小,Ca、P原子比增大。钙盐含量为 26.5 g/L时,膜层Ca、P原子比为1.31,这与HA中的Ca、P原子比还差很多。
2.1.3 微弧氧化陶瓷膜的相组成
图3为乙酸钙浓度不同时微弧氧化陶瓷膜的XRD谱。从图 3可以看出,膜层主要由锐钛矿型和金红石型TiO2组成,存在少量非晶相,并且能谱分析得出膜层中含有Ca、P元素,这说明Ca、P元素以非晶相形式存在于膜层中。随钙盐质量浓度增大,膜层中锐钛矿型TiO2含量减小,金红石型TiO2含量增大,这是由于电解液中钙盐的增多会使不溶性物质增多,微弧氧化产生的热量更不易扩散,因此温度升高。当温度升至650 °C时,亚稳态的锐钛矿型TiO2会转变为高温稳定的金红石型TiO2。
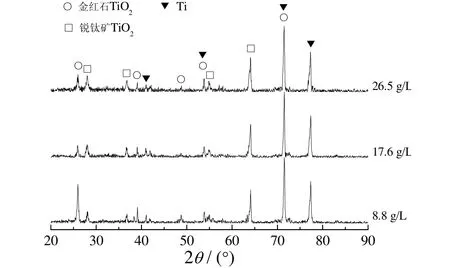
图3 乙酸钙质量浓度不同时陶瓷膜的XRD谱Figure 3 XRD patterns for ceramic coatings obtained at different mass concentrations of calcium acetate
2.2 EDTA-2Na质量浓度对微弧氧化陶瓷层的影响
2.2.1 微弧氧化陶瓷膜表面形貌
固定Ca(CH3COO)2的质量浓度为26.5 g/L,在不同EDTA-2Na质量浓度下制备微弧氧化膜层,图4为对应氧化陶瓷膜的 SEM 照片。从图 4可知,加入EDTA-2Na后,微孔的孔径明显增大,大的孔径更有利于骨细胞向孔内部生长,使其结合强度提高。随EDTA-2Na质量浓度增大,火山口状的凸起变得不太明显,膜层表面变得较为平坦。EDTA-2Na质量浓度为30 g/L时,膜表面有微裂纹存在,这是由于电解液中EDTA-2Na含量增大时,单位面积的电流增大,起弧电压降低,反应加快,相同氧化时间内产生的 TiO2熔融物增多,膜层增厚,而TiO2与钛合金基体的热膨胀率不同,二者同时膨胀时膜层表面产生微裂纹,膜层越厚,这种现象越明显。

图4 EDTA-2Na质量浓度不同时陶瓷膜的SEM照片Figure 4 SEM images of ceramic coatings obtained at different mass concentrations of EDTA-2Na
采用Image-pro plus 6.0软件测得EDTA-2Na质量浓度为0、10、20和30 g/L时,陶瓷层表面孔隙率分别为8.67%、10.57%、11.10%和9.72%。可知电解液中加入EDTA-2Na后,膜层的孔隙率明显增大,孔隙率越大,膜层比表面积越大,植入人体后与骨组织键合得就越好。当EDTA-2Na质量浓度为20 g/L时,孔隙率最大。
2.2.2 微弧氧化陶瓷膜的钙、磷元素含量
图5为微弧氧化陶瓷层中Ca、P元素含量和Ca、P原子比随 EDTA-2Na质量浓度的变化曲线。从图 5可以看出,随EDTA-2Na质量浓度增大,膜层中Ca、P的原子质量分数均增大,且Ca元素的增大程度大于P元素,故膜层中Ca、P原子比也增大。当EDTA-2Na质量浓度为20 g/L时,Ca、P原子比为1.65,十分接近HA的Ca、P原子比,故此浓度EDTA-2Na最佳。
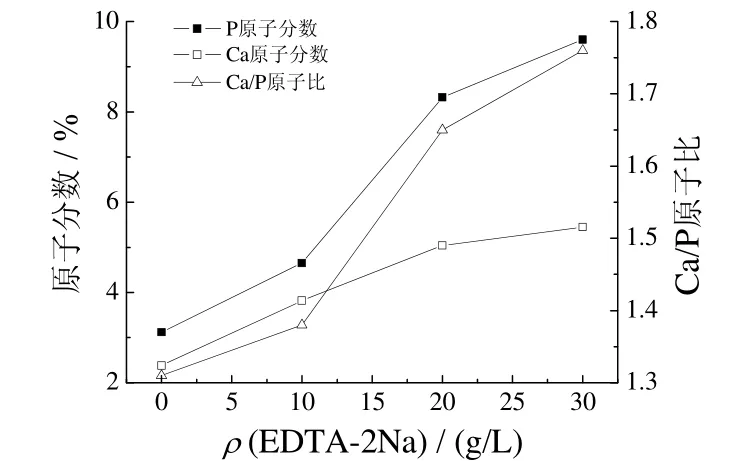
图5 EDTA-2Na质量浓度对陶瓷膜组成的影响Figure 5 Effect of mass concentration of EDTA-2Na on composition of ceramic coatings
EDTA-2Na易在水中发生电离生成 2Na+和 H2Y2−{Y = [(CH2COO)2NCH2CH2N(CH2COO)2]4−},电解液中加入 EDTA-2Na后,H2Y2−与 Ca2+作用生成 CaY2−。一方面改变了 Ca2+在电场作用下的运动方式,使其结合成带负电的离子,依靠电泳方式通过放电通道到达钛合金表面,这比扩散方式容易得多;另一方面,CaY2−是具有空间五元环结构的配合物,可以吸附更多的钙和磷酸根离子并相互吸附形成稳定的三维空间结构[9],因此EDTA-2Na的加入使膜层中 Ca原子分数明显增大,P含量也增大。
2.2.3 微弧氧化陶瓷膜的相组成
图6为电解液中EDTA-2Na质量浓度不同时微弧氧化陶瓷膜的XRD谱。从图6可知,膜层主要由锐钛矿型和金红石型TiO2组成,加入EDTA-2Na后膜层中金红石型 TiO2的相对含量明显增大。这是因为加入EDTA-2Na 后,H2Y2−与 Ca2+作用生成 CaY2−,不再生成CaHPO4悬浮小颗粒,使电解液电导率增大,反应剧烈,产生的热量多,促进了锐钛矿型TiO2向金红石型TiO2转化,并且随EDTA-2Na质量浓度增大,金红石型TiO2略有增多;另外,在2θ为20°~40°之间有明显的非晶相存在,结合能谱分析可知为含Ca、P元素的非晶相。
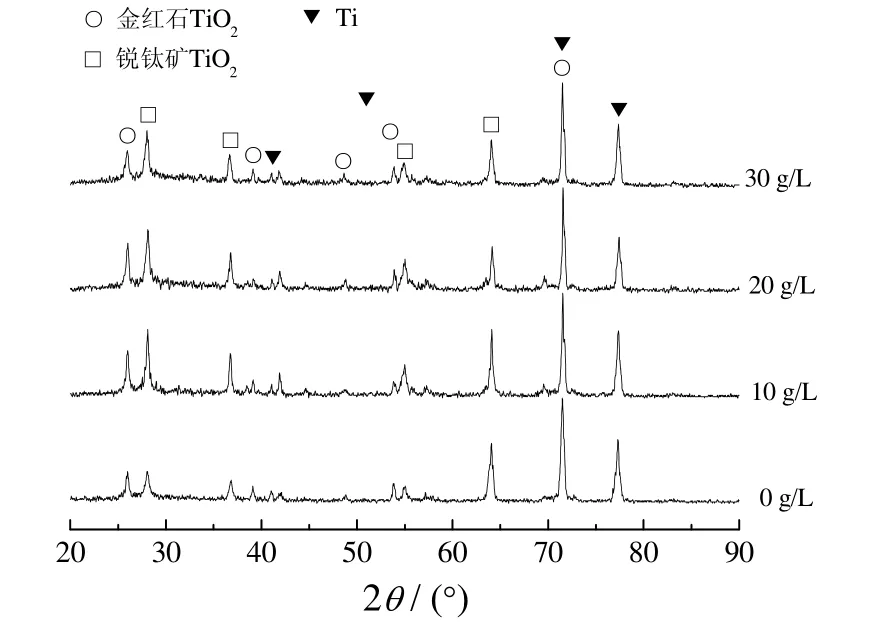
图6 EDTA-2Na质量浓度不同时陶瓷膜的XRD谱Figure 6 XRD patterns for ceramic coatings obtained at different mass concentrations of EDTA-2Na
3 结论
(1) 随着钙盐质量浓度增大,膜层表面孔隙率基本不变,膜层中Ca元素含量增大,P元素含量减小,钙磷原子比增大;随着EDTA-2Na质量浓度增大,膜层表面孔隙率先增大后减小,膜层中Ca元素含量明显增大,P元素含量略有增大,钙磷原子比明显增大。
(2) 膜层主要由锐钛矿型和金红石型TiO2组成,随钙盐和EDTA-2Na质量浓度增大,锐钛矿型TiO2的相对含量减少。另外,膜层中存在由钙磷化合物组成的非晶相。
(3) 电解液的最佳组成为:K2HPO4·3H2O 6.8 g/L,Ca(CH3COO)226.5 g/L,EDTA-2Na 20 g/L。此时膜层表面粗糙,孔径较大且分布均匀,孔隙率高达11.10%,Ca、P原子比为1.65,十分接近HA的Ca、P原子比。
[1]LI L H, KONG Y M, KIM H W, et a1.Improved biological performance of Ti implants due to surface modification by micro-arc oxidation [J].Biomaterials, 2004, 25 (14): 2867-2875.
[2]屠振密, 李宁, 朱永明.钛及钛合金表面处理技术和应用[M].北京:国防工业出版社, 2010: 133-166.
[3]黄岳山, 赵修华, 吴源青.微弧氧化改性二氧化钛生物活性膜的研究进展[J].医疗卫生装备, 2004, 25 (4): 22-23.
[4]CHENG S, WEI D Q, ZHOU Y.Structure of microarc oxidized coatings containing Si, Ca and Na on titanium and deposition of cefazolin sodium/chitosan composite film [J].Surface and Coatings Technology,2011, 205 (13/14): 3798-3804.
[5]NIINOMI M.Recent research and development in titanium alloys for biomedical applications and healthcare goods [J].Science and Technology of Advanced Materials, 2003, 4 (5): 445-454.
[6]王凤彪, 狄士春.医用钛合金微弧氧化膜的制备及其生物相容性研究[J].电镀与涂饰, 2011, 30 (6): 25-28.
[7]杨瑞博.钛合金表面微弧氧化生物活性涂层研究[D].西安: 长安大学,2012: 25-43.
[8]赵晴, 马刚, 王帅星, 等.TC4钛合金微弧氧化因素对生物陶瓷膜中Ca,P相对含量的影响[J].材料保护, 2012, 45 (1): 42-44, 55.
[9]RHEE S H, TANAKA J.Effect of citric acid on the nucleation of hydroxyapatite in a simulated body fluid [J].Biomaterials, 1999, 20 (22):2155-2160.
