转基因食品分析检测技术研究进展
2014-03-08王晨光许文涛黄昆仑罗云波
王晨光,许文涛,2,黄昆仑,2,罗云波,2,*
(1.中国农业大学食品科学与营养工程学院,北京 100083;2.农业部转基因生物食用安全监督检验测试中心,北京 100083)
转基因食品分析检测技术研究进展
王晨光1,许文涛1,2,黄昆仑1,2,罗云波1,2,*
(1.中国农业大学食品科学与营养工程学院,北京 100083;2.农业部转基因生物食用安全监督检验测试中心,北京 100083)
目前世界各国都以不同方式要求企业对转基因食品进行标识,这就对转基因食品的检测技术提出了更高的要求。本文以转基因食品安全检测控制体系为线索先后介绍了世界各国的转基因标识制度及其必要性和国内外转基因分析检测技术的新进展,其中包括一些新颖的检测技术,如二代测序技术、等温扩增技术、组学分析技术等,最后预测了这些技术未来的发展前景。
转基因食品;分析检测技术;分子特征;等温扩增
1988年,Hinchee等[1]研发出全球首例转基因作物耐草甘膦品系转基因大豆。自此之后转基因作物得到了飞速发展,已经对传统的农业技术产生了很大的冲击。2013年,转基因作物在全球的总种植面积已经超过了1.75亿 hm2,比2012年增加了3%。这个数据相对于1996年转基因作物种植面积增加了94 倍[2]。转基因作物的迅猛发展使得转基因食品更多地流入了商品市场,这一方面极大地满足并丰富了人们的物质生活需求;另一方面,人们对转基因食品食用安全性的关注也越来越多,其中最核心的关注在于外源基因是否会对人体和环境产生影响。世界各国针对转基因食品出台了严格的管理制度以预防转基因生物可能存在的安全担忧,早在1992年,世界各国在联合国框架下就共同达成了关于转基因食品的规范制度——《卡塔赫纳生物安全议定书》[3]。食品转基因成分分析检测是转基因食品标识以及监管的首要工作,分析检测技术的发展直接影响转基因生物安全管理的成败。目前对于转基因作物及食品的研究,既有常规的定性检测技术和定量检测技术,也有近几年比较关注的安全分析技术。本文主要根据实际检测中不同需求产生的分析检测技术进行综述,以期为转基因食品分析检测工作提供清楚明了的框架。
1 转基因食品标识制度
目前世界上有50余个国家都对转基因食品实施标识管理制度。大体而言,转基因食品标识制度主要分为强制性标识和自愿型标识两大类。以中国、欧盟为代表的国家或组织制定了比较严格和预防性的法律制度,规定了需要标识的阈值;而以美国为代表的国家地区则给出了自愿标识的制度,只有当转基因食品与传统食品存在过敏原等明显差别时才需要进行标注[4-6]。
虽然各国的标识制度不同,但除了基于政治经济因素之外,各国更多的考虑是实际检测能力。政府机构在为转基因食品标记进口许可时会依据相应的标识制度,也就是说凡是批准进口的转基因食品必须进行标识才可进入流通环节。因此,转基因食品标识制度是转基因食品的重要标签。标识制度的建立由实际检测能力决定,定性定量分析检测技术所达到的检测限为标识制度提供科学依据;然而标识制度在实际检验检疫工作中是通过检测技术来实现的。因此,标识制度与分析检测技术的关系十分密切,二者相互影响相互作用。
2 转基因食品分析检测技术
转基因食品分析主要关注于转基因样品与非转基因样品之间的显著性差异分析,它强调的是两者成分和代谢物等方面体现的规律与特征。转基因食品检测主要是验证待检样品的转基因性质,它强调的是检验。对于分析技术而言,得到样品与标准参照物的差异是科研工作者的首要关注点,差异主要由样品的主要成分,主要标记信息等方面构成。这些信息是转基因食品检测技术的重要对象。换言之,转基因食品分析技术为检测技术提供了检测对象,而这些对象反过来也可以印证目前所开发技术的检测效果。2.1 组学分析技术
组学技术是对一类个体系统集合的分析技术,主要包括转录组学、蛋白组学、代谢组学等技术。蛋白组学是指研究一个细胞在特定时间和特定环境下所有蛋白质表达的技术。蛋白组学是对某一生物或细胞在特定生理病理状态下表达的所有蛋白质的特征、数量和功能进行系统性的研究,能在细胞整体水平上阐明生命现象的本质和活动规律[7]。转录组学研究的则是细胞在某一功能状态下表达的全部基因总和。转录组学研究能够获得外源基因表达的信息以及外源基因插入后受体基因组表达的情况,对评价转基因食品的非期望效应有重要意义[8]。代谢组学研究的对象是细胞在特定时间和条件下的所有小分子代谢物质。通过对这些物质的定性定量检测,代谢物质的内外因变化应答规律可以准确获得[9]。应用组学技术研究小分子物质可以了解食品在体内的消化途径以及外源基因表达产物引起何种变化。目前,组学技术已经在转基因食品分析中取得一定应用。Wang Yan等[10]利用双向电泳和电子喷雾飞行时间质谱技术分析含有Cry1ab/ac蛋白的转基因水稻的信息。Xu Wentao等[11]利用转基因玉米Bt11、Bt176的代谢产物(脂肪酸、甾醇、萜类化合物等)的抗氧化活力从而探究转基因食品带来的非期望效应。Gall等[12]利用核磁共振技术检测转基因番茄和非转基因参照的初级代谢产物发现了15 种代谢产物的含量与非转基因番茄的差异,分辨出两种番茄的代谢产物差异,从而分析转基因番茄的非期望效应。
组学分析的主要目的在于评价样品的非期望效应(unintended effects),从而能够正确地进行转基因食品危害识别(hazard identification)。组学分析可以避免常规评价方法(动物喂养实验)灵敏性差、耗时长及统计误差等问题[13]。组学技术作为一项新兴的技术,因其通量高、客观、无选择性的技术优点,已经被越来越多的科研工作者关注并使用,转基因食品更加客观全面的安全评价体系也会逐渐建立起来,而且它对消费者所关注的非期望效应评价具有显著优势。当然,组学技术分析对象没有形成全面的联系,容易造成错误分析结果或对评价系统造成影响,同时组学研究的数据量和成本也是不能忽视的因素。因此,合理使用组学分析技术才能为科研工作者带来理想结果。
2.2 光谱学分析技术
转基因光谱学技术主要为近红外光谱检测。近红外光谱穿透力强,所以不需要对转基因食品进行预处理或基因组提取[14];能够表征基因结构变化所带来的构型变化,进而可以通过C—O键,C—H键,C—N键等数据变化看出基因表达的差异[15]。近红外光谱分析技术利用光谱图和模拟软件对已知样品建库,样品信息库中包含了经过误差校正的大量不同来源的转基因与非转参照样品的数据,是生物信息学较为简单的模型。Xie Liyuan等[16]利用可见/近红外光谱技术,结合光谱预处理技术和化学计量学方法对68 个番茄叶样品(转基因38 个,非转基因30 个)进行分类。芮玉奎等[17-18]利用近红外光谱检测转基因玉米及其亲本的差异和转基因油菜的相关信息,并通过BP算法进行数据处理,从而建立了转基因玉米的快速标准分析模型。翟亚锋等[19]对9 个转基因小麦样品进行光谱学分析,通过主成分分析方法得到能反映小麦种子97.28%光谱信息的主成分,建立仿生模式识别(biomimetic pattern recognition,BPR)技术标准模型快速特异识别转基因小麦系统。虽然转基因光谱学检测的准确性还有待考证,但这不能抹灭其简单快速的优势在无损检测方向所做出的贡献。鉴于消费者对转基因食品的安全问题格外关注,光谱学和组学分析一样都关注于转基因食品的非期望效应,这也是分析检测技术在评价期望效应的基础上的一种补充。
2.3 DNA水平和蛋白水平检测策略
转基因食品分析技术提供了检测对象,检测技术即验证这些对象的转基因性质。对转基因食品的检测可以从DNA水平、RNA转录水平、表达蛋白水平、代谢物水平等几个方面考虑。目前国内外对转基因食品检测技术的研究主要集中在核酸和蛋白两个水平上,实践中以DNA为基础的检测技术因其较高的灵敏度和特异性得到了广泛应用。聚合酶链式反应(polymerase chain reaction,PCR)是目前应用最广泛的转基因分析检测技术。除此之外,酶联免疫吸附法(enzyme-linked immunosorbent assay,ELISA)也是常用的检测技术[20]。
DNA水平检测一般采用PCR技术,由于外源基因在导入受体时位置和插入片段大小难以确定,检测每个导入基因显然缺乏实际意义,因此检测要通过一定的筛选技术实现,筛选技术可分为筛选PCR(screening PCR)、基因特异性PCR(gene-specific PCR)、构建特异性PCR(construct-specific PCR)和转化事件特异性PCR(event-specific PCR),如图1所示。筛选PCR是一种以外源基因中的启动子或者终止子为目的检测片段的检测方法,是一种较为快速简便的方法;基因特异性PCR检测的目的片段是外源插入基因中的外源目的片段;构建特异性PCR检测的目的片段是外源基因中外源目的基因与启动子或者终止子的连接区域;而转化事件特异性PCR检测的目的片段是外源插入基因与植物基因组的结合位点,这种方法可以确定外源基因在生物体基因组中的插入位点,而且可以明确提供外源基因的确切拷贝数,因此这种方法是目前特异性最高的检测方法[21]。

图1 转基因作物PCR检测策略示意图及特异性比较Fig.1 Comparison of specificities of different PCR detection protocols for GMOs
PCR检测过程中还会用到内标基因(endogenous gene)和标准物质(certificated reference materials,CRMs)。内标基因是植物体内能够稳定表达的低拷贝的基因[22]。内标基因能够用来验证样品的物种属性,同时也能验证反应体系的可行性和特异性。目前常用的内标基因包括大豆的lectin基因[23],棉花的sad1基因[24],木瓜的papain基因[25]。CRMs是已知含量的转基因样品,用来对待检食品进行定量分析。目前标准物质大多采用欧盟参考物和测量研究所(Institute for Reference Materials and Measurements,IRMMs)审核批准的标准分子。CRMs是由未经过加工的原料制备而成的,由于基质效应以及加工过程对基因组的损伤,CRMs在实际应用过程中受了很大的制约。目前线性化质粒因其具有容易制备,准确稳定的特点,已有取代CRMs成为标准物质的趋势[26]。
蛋白水平检测主要包括ELISA法和Western blotting杂交法。ELISA法是外源蛋白与特异性的抗体进行结合,通过酶促反应产生有颜色的物质从而对外源蛋白浓度进行定量。Yarasi等[27]采用ELISA法能够准确检测出转基因水稻大蒜叶凝集素的含量。Western blotting法是一种蛋白质的转移电泳技术,这种技术具有从杂蛋白质中检测特异性蛋白质的功能,而且具有蛋白质反应均一性好,保存时间长等优点。Qiu Dewen等[28]利用Western blotting检测转基因水稻中稻瘟菌蛋白激发子,并且证明了该蛋白的表达增强了水稻的抗病性。
2.4 分子特征分析检测技术
分子特征是转基因作物及食品中外源基因插入受体基因的全部信息,主要包括外源基因的特异序列,插入位点,插入数量以及外源插入基因两侧的侧翼序列等[29]。这些信息为转基因作物及食品的分类及安全评价提供基础数据支持,可以说是整个分析检测技术的基础,不仅仅对后续现场快速检测和精准定量检测意义重大,而且也与组学分析技术关系密切,可以说分子特征既是转基因的检测对象,也是转基因的分析对象,对于科研工作者和政府相关部门的重要性自然不言而喻。对于这一类技术而言,研究者首要关注的是信息的准确性和全面性,高通量的生物检测方法就显得尤为重要。
2.4.1 第二代测序技术
第二代测序技术(next-generation sequencing,NGS),又叫高通量测序技术,它是基于边合成边测序的原理诞生的高通量测序技术[30]。第二代测序技术通过基因组破碎,盲端补平,接头连接,扩增测序等步骤获得片段两侧的序列信息,从而获得序列的重测序结果。第二代测序技术除了进行常规分子特征鉴定之外,还可以对多倍体基因组进行高通量分析,能够解决多倍体基因组序列信息不全及工作量大的难题,未来可用于多倍体基因组转基因插入位点的检测[31]。第二代测序技术的缺点在于数据量庞大,工作繁琐,这也是目前没有广泛应用的重要原因[30]。然而,正是这些数据才能获得目的基因的所有信息,为转基因食品的检测提供了潜在的可能性和新的发展方向。Wahler等[32]利用第二代测序技术分析了欧盟批准上市的转基因水稻的外源基因插入位点,并且通过重测序拼接的新基因组分析外源基因的全部信息。Yang Litao等[33]同样利用第二代测序技术,直接将小片段双端测序结果与含有通用元件等常规信息的基因文库比对,从而得到可疑的插入位点及插入序列,最后通过传统PCR验证,如图2所示。

图2 第二代测序检测技术示意图Fig.2 Next-generation sequencing technique
2.4.2 侧翼序列PCR检测技术
之前已经提到,转化事件特异性检测是特异性最高的检测技术,插入位点也是分子特征最为关注的信息。这种技术需要外源基因插入位点两侧的序列信息,即侧翼序列信息。传统PCR技术依然是分子特征检测的主流技术。目前,扩增侧翼序列PCR主要包括两大类,一类是依赖酶切位点的技术,包括反向PCR(inverse PCR,I-PCR)和连接接头PCR(ligated-adapter PCR,LAPCR);一类是不依赖酶切位点的技术,包括热不对称交错PCR(thermal asymmetric interlaced PCR,TAIL-PCR)和随机破碎片段PCR(randomly broken fragment PCR,RBF-PCR)。
反向PCR是将基因组酶切破碎,通过环化实现反向引物扩增,最后测序判断产物的序列信息的一项技术。反向PCR的优势在于操作简单,是快速获得侧翼序列的方法。Xu Wentao等[34]运用反向PCR技术获得转基因大豆DP-356043-5的侧翼序列,并经过传统PCR验证从而确定出一套成熟的检测方法。同样使用酶切破碎的还有连接接头PCR(图3a),与反向PCR不同的是,这种方法在破碎之后认为在两端加上接头,然后再用特异性引物和接头引物进行巢式PCR扩增[35]。Trinh等[36]开发出一种新型依赖接头PCR的侧翼序列获取技术——环状接头PCR(loop-linker PCR),通过这种方法从多种转基因玉米和大豆中分离出了最长达到1 800 bp的侧翼序列片段。对于这种技术而言,选取酶切位点是重要的考虑环节。
Xu Wentao等[37]最近开发出一种新型的不依赖酶切位点的技术,称为RBF-PCR。RBF-PCR的原理是利用超声破碎的方法获得基因小片段,两端平端化处理后在3’端添入碱基A,利用通用接头进行的染色体步移技术(图3b)。Xu Wentao等[37]已经成功获得转基因玉米LY038外源基因两侧的插入序列,这种方法不依赖于酶切位点的选择,适用于所有种类的转基因品系,具有很高的应用性。
侧翼序列检测包括对外源基因插入位点的综合分析,因此也需要分析每一段基因的相互位置。虽然近几年第二代测序技术因其庞大的数据分析量而被越来越多的用来获得侧翼序列,然而PCR技术的成本和简便性仍然不容忽视,可以说侧翼PCR检测技术依然是扩增侧翼序列主流且不可或缺的检测技术。
2.5 转基因快速检测技术
转基因食品分子特征信息的完备相当于建立一个庞大的筛选库,然而一些特殊场合(港口出入境检疫局、地方食药监局等)的工作者更为关注的是快速灵敏地检测未知样品,换句话说,没有受过专业培训的普通工作人员也要有能力使用某种技术检测转基因食品。这是转基因分析检测应用到实践的最直接体现。PCR需要变温步骤及费时费力的缺陷不适宜这一要求,所以开发新型的恒温状态下的扩增技术十分必要。与此同时,外源基因表达的蛋白质可以由操作简便、结果显示简单的试纸达到检测效果。
2.5.1 等温扩增检测技术
PCR反应需要经历高温变性,退火结合和延伸3 个温度梯度,热循环仪器必不可少,这就给一线检验工作者检测造成了很大不便。等温扩增技术作为解决这一问题最直接的方案,已经取得了很大的应用突破[38]。等温扩增(isothermal amplification)是扩增反应保持反应温度不变的广义PCR技术。等温扩增最大的特点在于不需要温度变化,简易加热装置即可满足要求。目前主要的等温扩增技术包括环介导等温扩增[39](loop mediated isothermal amplification,LAMP)、链置换扩增(strand displacement amplification,SDA)、切口酶扩增(nicking endonuclease mediated amplification,NEMA)、依赖核酸序列的扩增技术(nucleic acid sequence-based amplification,NASBA)、依赖解旋酶的等温扩增(helicase-dependent amplification,HDA)等。其中,LAMP技术在转基因检测中已经有很多应用,是一项已经成熟的技术手段,闫兴华等[40]用LAMP技术检测转基因玉米LY038,将cordapA基因作为目的基因设计引物,最终能达到在50 min内检测到0.01%的样品。
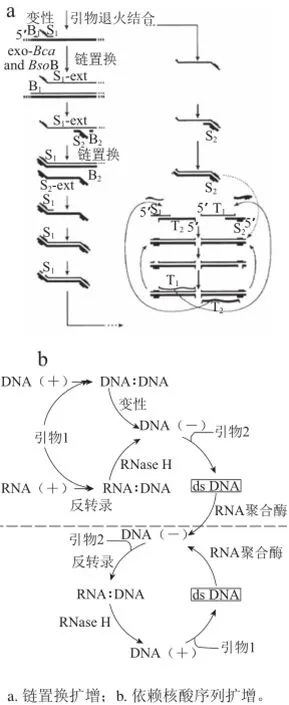
图4 等温扩增原理图Fig.4 Reaction scheme of isothermal amplification
链置换扩增(strand displacement amplification,SDA)是利用内切酶活性和DNA聚合酶实现的扩增反应,原理如图4a。SDA仅仅需要两对引物和两种特殊功能的酶,分别是限制性内切酶和具有链置换活性的DNA聚合酶[41]。引物与DNA单链结合后产生的内切酶识别位点经内切酶作用后依赖DNA聚合酶在切割处延伸3’端,并替代另一条DNA链;替代的链与引物杂交后又可作为另一个新的扩增反应的模板。目前,以SDA为代表的链置换扩增技术因其较好的特异性成为等温扩增的主要发展方向。链置换主要依赖特异的酶切位点和具有置换活性的DNA酶,在此基础上衍生了许多链置换扩增技术。其中,切口酶扩增技术(nicking endonuclease mediated amplification,NEMA)使用一种特殊的切口内切酶,这种酶特异性地识别酶切位点并只切割其中一条链,从而实现扩增的目的。NEMA能够避免SDA需要合成特殊硫代核苷酸的要求。王纪东等[42]利用NEMA技术检测蜡样芽孢杆菌的大片段DNA,最长可以获得450 bp的目的片段,这种技术可以应用于基因组庞大的转基因食品的检测。此外,引入RNA酶也可实现扩增目的。TARAKA公司提出了一种新型的基于链置换原理的扩增技术——嵌合引物介导核酸等温扩增技术(isothermal and chimeric primer-initiated amplification of nucleic acids,ICAN)[43]。它将上述的酶切位点设计为DNA-RNA嵌合引物,使用RNase H酶特异识别嵌合部位并切断RNA序列,从而实现链置换目的。这种引入嵌合部分的扩增技术特异性较之NEMA更好[44]。几种链置换技术依然处于基础研究阶段,然后他们的特异性逐渐增强,且后一种方法均为前一种方法缺陷的解决方案,完善实验方案能够扩大等温技术的应用范围。
依赖核酸序列的扩增技术(nucleic acid sequencebased amplification,NASBA)是一项等温的基于RNA的核酸扩增技术。如图4b所示,NASBA反应体系需要逆转录酶、T7RNA聚合酶、RNase H这3种酶。模板RNA经逆转录形成RNA-DNA杂交体,RNase H酶降解杂交体的RNA,单链DNA作为模板合成新的双链DNA,后者被T7RNA聚合酶转录出靶RNA,由此进入新一轮扩增循环,不断形成靶核酸分子[45]。NASBA技术中不使用容易受抑制的逆转录酶,因此可减少样品中抑制性物质的影响,扩增的高特异性能够有效降低核酸污染。对于转基因食品而言,由于加工过程中RNA有不同程度的破坏,直接以RNA为模板难度较大。但是,如果以DNA为模板并提前高温变性使DNA双链解旋,也可使用这种方法。另外,NASBA技术还可用于制毒因子的检测从而判断食物中毒的原因。Morisset等[46]利用NASBA技术在芯片上完成对转基因玉米MON863和MON810的多重定量检测,证明了该方法在转基因检测方面的可应用性。
2.5.2 试纸检测技术
试纸检测技术更为方便快捷,对于现场快检工作人员应用极广。显色试纸的原理如图5所示[47]。试纸条检测的是外源基因表达的蛋白,固定在试纸的能与外源蛋白特异结合的抗体偶联了发光基团,外源蛋白在毛细管作用下流动与特异性抗体结合后形成的复合物可与含有特殊识别位点的二抗再次结合,从而在T线(test line)上产生特异颜色,而未结合的抗体则与C线(control line)上的二抗结合显色。根据抗原抗体特异性结合达到检测目的。发光基团可以为荧光集团,普通显色剂,近年来应用适配体结合蛋白借助胶体金或纳米金粒子实现颜色变化也得到广泛应用[48-49]。孙艳秋等[49]利用胶体金标记的试纸成功检测黄瓜细菌性角斑病,在15 min内检测到26 个菌株的存在,且无交叉污染,从而拓展了试纸条在食源微生物等领域的检测应用。试纸条分析检测技术操作简便,分析时间短,结果表征简单,不需要专业的检测培训,是快速检测技术未来的发展方向。
除了常规外源蛋白检测技术,He Yuqing等[50]研制出一种用来检测控制表皮松懈R156H基因变异的核酸检测试纸,并成功在75 min内检测出最低1 fmol/L的变异基因分子。与检测外源蛋白不同,核酸试纸是直接在试纸条上检测DNA分子,原理如图6。样品在被检测前经过一定循环产生大量扩增产物,可以实现边扩增变检测,也就是说直接将试纸条插入反应溶液中即可看到T线和C线的显色效果。核酸试纸完成等温扩增和试纸检测的统一,不需要依赖荧光检测装置,而且也有效避免蛋白检测试纸带来的污染及假阴性问题。由于该技术目前尚处于实验研究阶段,目前在转基因食品检测中还没有出现这种技术,但可以预见未来依赖扩 增的试纸条是快速检测的发展趋势。
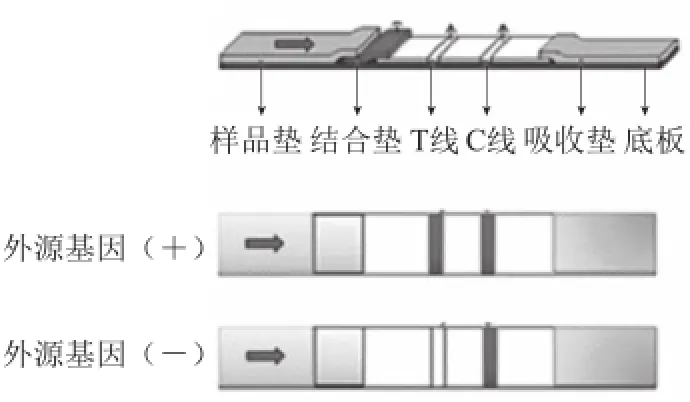
图5 试纸显色原理图Fig.5 Reaction scheme of lateral flow strip
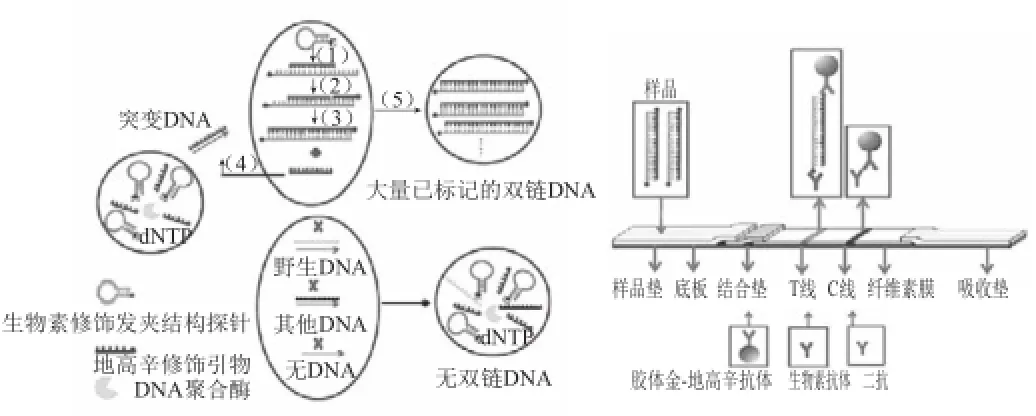
图6 链置换核酸检测试纸原理图[[5500]]Fig.6 Scheme of lateral flow strip based on isothermal strand displacement amplification[50]
2.6 转基因定量检测技术
分子特征是制定标识制度的基础,依据分子特征确定标识阈值则需要通过定量检测技术来实现。定量检测技术不仅在科研工作中用来确定外源基因拷贝数及样品转基因相对含量,在口岸田间也可确定送检样品的含量从而根据阈值给出处理意见。定量检测技术不仅是标识制度的践行者,而且是标识制度的强大科学支撑。因此,定量检测技术是贯穿整个转基因分析检测工作的重要技术手段。
2.6.1 传统定量检测技术
定量PCR重点追求的是准确性,需要确定最低检测限和定量检测限,检测的目的是样品中目的分子的拷贝数,根据同时检测出的转基因品系特异性基因和物种内参基因的拷贝数来确定转基因成分的含量。定量的方法主要是借助光学现象,即实时荧光PCR(real-time PCR,RT-PCR)。RT-PCR所使用的标记物主要分为3 种,即Taqman荧光探针,SYBR GreenⅠ和分子信标法。SYBR GreenⅠ染料成本最低,这种染料可以与双链的DNA分子产生特异性的结合,荧光信号随着PCR反应的进行逐渐增大。这种方法具有成本低、灵敏度相对较高的优点,但是相对于其他两种方法灵敏度较低。Taqman探针可以与目的片段特异性结合,探针5’端的荧光报告基团和3’端标记的荧光淬灭基团会被Taq扩增酶的外切活性切开从而产生荧光信号。Taqman荧光探针目前使用最为广泛,其特异性和高灵敏度都得到了充分验证,许多国家和行业标准中均使用Taqman探针法检测[51-52]。此外一些新的技术也层出不穷,比如单荧光自淬灭技术,利用核酸本身结构实现荧光淬灭,而与目的片段互补的探针则发出荧光信号。单荧光自淬灭技术因结构复杂性难以设计,但其特异性及强淬灭性在定量技术中有应用价值,而且能用来进行等温技术的定量检测[53]。虽然近年来不断有新技术涌出,RT-PCR依然是定量检测的主流方法。
2.6.2 数字PCR检测技术
数字PCR(digital PCR,dPCR)是继定性和实时荧光PCR之后的第三代PCR技术,是一种分子生物学与统计学结合的检测方法。dPCR通过将样品进行大倍稀释,使得反应孔中的模板分子不超过一个。在传统PCR条件下扩增后,产生荧光信号的反应孔即代表样品的具体含量[54]。如果样品浓度过高导致每孔中不止一个分子,根据泊松概率分布(Poisson distribution)也可计算出样品的浓度或者拷贝数[55]。这种不依赖扩增曲线和标准曲线的定量方法已经在拷贝数变化分析,基因分型,单细胞基因表达等领域取得一定突破[56-59]。对于转基因检测来说,获得样品中外源基因的拷贝数是定量检测的关键。Corbisier等[60]和Sanders等[61]都得到了数字PCR与实时荧光PCR一致且准确性灵敏度更高的结果,因为不需要标准物质,数字PCR能够真正实现样品的绝对定量。
目前数字PCR主要包括芯片数字PCR(chip digital PCR,cdPCR)和微滴数字PCR(droplet digital PCR,ddPCR)。cdPCR由美国Fluidigm公司开发,通过将样品分散到数万个微孔中实现扩增反应,如图7a所示。芯片法的最大优势在于通量极高,而且芯片结果可以直接通过探针反映的荧光信号计数,从而达到绝对定量的目的。Sanders在评价dPCR检测效果时就是采用芯片法。ddPCR目前主要由美国Bio-Rad公司开发,如图7b所示,其基本原理是将扩增体系分散为无数个小液滴,这些液滴被油状液体包裹形成小油滴,小油滴在传统PCR扩增程序下完成扩增并检测探针荧光信号。这种方法较之芯片法成本更低,而且液滴百万级数目足够保证实验的准确性,适合科研及检测工作者使用。Taly等[58]利用ddPCR技术检测直肠癌病人环状DNA的KRAS突变基因,最终实现了包括野生型的5重样品检测。Morisset等[62]利用ddPCR检测转基因玉米MON810含量,获得了和定量PCR一致的结果,该结果也间接证明了dPCR技术对于转基因定量检测的贡献。总体而言,dPCR技术目前更多地应用于医学诊断方面,已成为临床应用方面最具潜力的诊断技术之一。两种dPCR虽然都有各自缺陷,在转基因检测的研究方面还处于起始阶段,但dPCR不依赖标准物质定量的显著特点能从原理上为核酸定量提供保证。

图7 数字PCR反应原理Fig.7 Reaction shceme of digital PCR
2.6.3 新材料辅助的定量检测技术
近些年来,纳米技术已经越来越多的应用在目的产物的检测中[63],主要目的在于降低背景值和提高检测准确性。目前应用较多的新材料包括氧化石墨烯(graphene oxide,GO),纳米金粒子(gold nanoparticles,AuNPs)和量子点(quantum dots,QDs)。
GO是碳原子通过sp2化学键形成的单分子层的二维蜂窝状氧化结构。GO可以作为荧光淬灭的介质,达到淬灭染料及荧光基团的目的。GO同时具有优先结合单链DNA的能力,这就使得携带荧光基团的探针能够被GO吸收从而达到淬灭的目的[64]。Zhu Debin等[65]和Li Zhen等[66]根据GO的这一特点设计了相应检测系统,具有很高的应用价值。纳米金粒子(AuNPs)是金的微小颗粒,直径在1~100 nm之间,可以作为淬灭基团实现荧光共振转移现象(fluorescence resonance energy transfer,FRET)[67]。Prigodich等[68]将AuNPs与DNA探针进行结合,形成AuNPs-DNA复合物,如图8a。当目的片段与DNA探针互补时含有荧光基团的探针会被剥离下来,从而与AuNPs分离而发出荧光。与此功能类似的QDs则呈现出比AuNPs更好的光学性质。量子点具有吸收波长范围宽和发射波长范围窄的特点,这种独特的物理和化学性质使得量子点在生物领域有广泛应用[69-70]。与AuNPs相反的是,量子点在探针领域充当荧光基团的作用,荧光强度比目前发现的最强荧光基团还要强[71-72]。Freeman等[73]根据量子点的这一特性设计生物探针用来检测小分子DNA。目的片段存在的情况下可以与探针结合暴露酶切位点,经ExoⅢ内切酶切开后探针与量子点的距离变增大发出荧光(图8b)。

图8 新材料辅助定量PCR技术Fig.8 Quantative PCR technology based on new optical materials
目前,这些方法只限于检测小片段的DNA或RNA分子,对于深加工转基因食品中存在的小片段有很好的检测效果,对于普通转基因食品中的作物成分,还需要进行进一步研究以增大可检测的模板长度。虽然这些技术还处于研究阶段,没有广泛用于转基因食品检测,但是鉴于现有荧光试剂在特异性、准确性及高背景值等方面的问题,新材料辅助的定量方法有很大的应用前景。
3 结 语
转基因食品分析检测技术主要针对的是原料作物的转基因成分,监管者或消费者需要知道外源基因插入的全部信息和外源基因及其表达产物对人体健康和环境的影响,这就对转基因食品的分析检测技术提出了更高的要求[74]。从获得转基因检测的对象到转基因食品定性定量检测就完成了一整套转基因食品评价的科学依据,从这点来说分析和检测技术是相通的,而且两者相互渗透,它们都为标识制度服务并佐证标识制度。随着各种高新技术的发展,转基因分析检测也逐渐向高通量,高准确度和高灵敏性方向发展。可以预见,组学分析技术能够帮助评价转基因食品的非期望效应,拓展分析技术的研究手段;在普通PCR存在一定缺陷的情况下,数字PCR技术在转基因检测的应用会逐渐增多,尤其是在精准定量检测领域能够实现基因拷贝数的绝对定量。针对一线工作者的快速检测领域也会更多地引入等温扩增及试纸显色的机理。总之,转基因食品的分析检测技术是全方位的,一方面依据管理措施研究工作会应运而生一些新的技术手段,另一方面分析和检测技术会更加高效地满足监管部门和消费者的信息需求。
[1] HINCHEE A W, CONNOR-WARD D V, NEWELL C A, et al. Production of transgenic soybean plants using agrobacterium-mediated DNA transfer[J]. Nature Biotechnology, 1988, 6(8): 915-922.
[2] AMES C. Global status of commercialized biotech/GM Crops: 2013[M]. ISAAA Brief No. 46. Ithaca, NY: ISAAA.
[3] 乔雄兵, 连俊雅. 论转基因食品标识的国际法规制: 以《卡塔赫纳生物安全议定书》为视角[J]. 河北法学, 2014, 32(1): 134-143.
[4] DEVOS Y, AGUILERA J, DIVEKI Z, et al. EFSA’s scientific activities and achievements on the risk assessment of genetically modified organisms (GMOs) during its first decade of existence: looking back and ahead[J]. Transgenic Research, 2014, 23(1): 1-25.
[5] 金芜军, 贾士荣, 彭于发. 不同国家和地区转基因产品标识制度管理政策的比较[J]. 农业生物技术学报, 2004, 12(1): 1-7.
[6] 王荣谈, 姜羽, 韦娇君, 等. 转基因生物及其产品的标识与检测[J].植物生理学报, 2013, 49(7): 645-654.
[7] 李学鹏, 励建荣, 于平, 等. 蛋白组学及其在食品科学研究中的应用[J].中国粮油学报, 2010, 25(2): 141-149.
[8] BARROS E, LEZAR S, ANTTONEN M J, et al. Comparison of two GM maize varieties with a near-isogenic non-GM variety using transcriptomics, proteomics and metabolomics[J]. Plant Biotechnology Journal, 2010, 8(4): 436-451.
[9] 王斯婷, 李晓娜, 王皎, 等. 代谢组学及其分析技术[J]. 药物分析杂质, 2010, 30(9): 1792-1799.
[10] WANG Yan, XU Wentao, ZHAO Weiwei, et al. Comparative analysis of the proteomic and nutritional composition of transgenic rice seeds with Cry1ab/ac genes and their non-transgenic counterparts[J]. Journal of Cereal Science, 2012, 55(2): 226-233.
[11] XU Wentao, GUO Feng, ZHOU Xin, et al. Unintended effects were investigated in antioxidant activity between genetically modified organisms and their nontransgenic control[J]. African Journal of Biotechnology, 2011, 10(46): 9272-9279.
[12] GALL G L, COLQUHOUN L J, DAVIS A L, et al. Metabolite profiling of tomato (Lycopersicon esculentum) using1H NMR spectroscopy as a tool to detect potential unintended effects following a genetic modification[J]. Journal of Agricultural and Food Chemistry, 2003, 51(9): 2447-2456.
[13] HEINEMANM J A, KURENBACH B, QUIST D. Molecular profiling-a tool for addressing emerging gaps in the comparative risk assessment of GMOs[J]. Environment International, 2011, 37(7): 1285-1293.
[14] MICHELINI E, SIMONI P, CEVENINI L, et al. New trends in bioanalytical tools for the detection of genetically modified organisms: an update[J]. Analytical and Bioanalytical Chemistry, 2008, 392(3): 355-367.
[15] ALISHAHI A, FARAHMAND H, PRIETO N, et al. Identification of transgenic foods using NIR spectroscopy: a review[J]. Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy, 2010, 75(1): 1-7.
[16] XIE Lijuan, YING Yibin, YING Tiejin. Quantification of chlorophyll content and classification of nontransgenic and transgenic tomato leaves using visible/ near-infrared diffuse reflectance spectroscopy[J]. Journal of Agricultural and Food Chemistry, 2007, 55(12): 4645-4650.
[17] 芮玉奎, 黄昆仑, 王为民, 等. 近红外光谱技术在检测转基因油菜籽中芥酸和硫甙上的应用研究[J]. 光谱学与光谱分析, 2006, 26(12): 2190-2192.
[18] 芮玉奎, 罗云波, 黄昆仑, 等. 近红外光谱在转基因玉米检测识别中的应用[J]. 光谱学与光谱分析, 2005, 25(10): 1581-1583.
[19] 翟亚锋, 苏谦, 邬文锦, 等. 基于仿生模式识别和近红外光谱的转基因小麦快速鉴别方法[J]. 光谱学与光谱分析, 2010, 30(4): 924-928.
[20] 黄国平, 汪琳, 陈克平, 等. 转基因水稻外源蛋白检测技术研究进展[J].中国水稻科学, 2010, 24(4): 410-416.
[21] JENSEN A H, RONNING S B, LOVSETH A, et al. PCR technology for screening and quantification of genetically modified organisms(GMOs)[J]. Analytical and Bioanalytical Chemistry, 2003, 375(8): 985-993.
[22] 许文涛, 白卫滨, 罗云波, 等. 转基因产品检测技术研究进展[J]. 农业生物技术学报, 2008, 16(4): 714-722.
[23] MEYER R. Development and application of DNA analytical methods for the detection of GMOs in food[J]. Food Control, 1999, 10(6): 391-399.
[24] XU WenTao, HUANG KunLun, WANG Ying, et al. A cotton-specific gene, stearoyl-ACP desaturase, used as a reference for qualitative and real-time quantitative PCR detection of GMO[J]. Journal of Science of Food and Agriculture, 2006, 86(7): 1103-1109.
[25] XU Wentao, BAI Weibin, GUO Feng, et al. A papaya-specific gene, papain, used as an endogenous reference gene in qualitative and realtime quantitative PCR detection of transgenic papayas[J]. European Food Research and Technology, 2008, 228(2): 301-309.
[26] 朱鹏宇, 商颖, 许文涛, 等. 转基因作物检测和监测技术发展概况[J].农业生物技术学报, 2013, 21(12): 1488-1497.
[27] YARASI B, SADUMPATI V, IMMANNI C P, et al. Transgenic rice expressing Allium sativum leaf agglutinin (ASAL) exhibits high-level resistance against major sap-sucking pests[J]. BMC Plant Biology, 2008, 14(8): 102-115.
[28] QIU Dewen, MAO Jianjun, YANG Xiufen, et al. Expression of an elicitor-encoding gene from Magnaporthe grisea enhances resistance against blast disease in transgenic rice[J]. Plant Cell Reports, 2009, 28(6): 925-933.
[29] Codex Alimentarius. Guideline for the conduct of food safety assessment of foods derived from recombinant-DNA plants[J]. CAC/GL, 2003, 45: 1-18.
[30] SHENDURE J, JI H. Next-generation DNA sequencing[J]. Nature Biotechnology, 2008, 26(10): 1135-1145.
[31] BRENCHLEY R, SPANNAGL M, PFELFER M, et al. Analysis of the bread wheat genome using whole-genome shotgun sequencing[J]. Nature, 2012, 491: 705-710.
[32] WAHLER D, SCHAUSER L, BENDIEK J, et al. Next-generation sequencing as a tool for detailed molecular characterization of genomic insertions and flanking regions in genetically modified plants: a pilot study using a rice event unauthorized in the EU[J]. Food Analytical Methods, 2013, 6(6):1718-1727.
[33] YANG Litao, WANG Congmao, JENSEN A H, et al. Characterization of GM events by insert knowledge adapted re-sequencing approaches[J]. Scientific Reports, 2013, 3: 2839-2847.
[34] XU Wentao, ZHANG Nan, LUO Yunbo, et al. Establishment and evaluation of event-specific qualitative and quantitative PCR method for genetically modified soybean DP-356043-5[J]. European Food Research and Technology, 2011, 233(4): 685-695.
[35] TRINH Q L, XU Wentao, SHI Hui, et al. An A-T linker adapter polymerase chain reaction method for chromosome walking without restriction site cloning bias[J]. Analytical Biochemistry, 2012, 425(1): 62-67.
[36] TRINH Q L, SHI Hui, XU Wentao, et al. Loop-linker PCR: an advanced PCR technique for genome walking[J]. International Union of Biochemistry and Molecula Biology Life, 2012, 64(10): 841-845.
[37] XU Wentao, SHANG Ying, ZHU Pengyu, et al. Randomly broken fragment PCR with 5’ end-directed adaptor for genome walking[J]. Scientific Reports, 2013, 3: 3465-3471.
[38] 张建中, 官小燕, 张海波, 等. 可用于转基因产品检测中的核酸体外等温扩增技术分析[J]. 中国农业科技导报, 2010, 12(4): 29-33.
[39] NOTOMI T, OKAYAMA H, MASUBUCHI H, et al. Loop-mediated isothermal amplification of DNA[J]. Nucleic Acids Research, 2000, 28(12): e63-e63.
[40] 闫兴华, 许文涛, 商颖, 等. 环介导等温扩增技术(LAMP)快速检测转基因玉米LY038[J]. 农业生物技术学报, 2013, 21(5): 621-626.
[41] WALKER G T, LITTLE M C, NADEAU J G, et al. Isothermal in vitro amplification of DNA by a restriction enzyme/DNA polymerase system[J]. Proceedings of the National Academy of Sciences of the United States of America, 1992, 89(1): 392-396.
[42] 王纪东, 王小慧, 李媛, 等. 切克内切酶介导恒温扩增技术条件优化[J].军事医学, 2012, 36(1): 65-69.
[43] MUKAI H, UEMORI T, TAKEDA O, et al. Highly efficient isothermal DNA amplification system using three elements of 5’-DNA-RNA-3’chimeric primers, RNase H and strand-displacing DNA polymerase[J]. The Journal of Biochemistry, 2007, 142(2): 273-282.
[44] UEMORI T, MUKAI H, TAKEDA O, et al. Investigation of the molecular mechanism of ICAN, a novel gene amplification method[J]. The Journal of Biochemistry, 2007, 142(2): 283-292.
[45] KIEVITS T, GEMEN B V, STRIJP D V, et al. NASBATM: isothermal enzymatic in vitro nucleic acid amplification optimized for the diagnosis of HIV-1 infection[J]. Journal of Virological Methods, 1991, 35(3): 273-286.
[46] MORISSET D, DOBNIK D, HAMELS S, et al. NAIMA: target amplification strategy allowing quantitative on-chip detection of GMOs[J]. Nucleic Acids Research, 2008, 36(18): e118.
[47] XU Hui, MAO Xun, ZENG Qingxiang, et al. Aptamer-functionalized gold nanoparticles as probes in a dry-reagent strip biosensor for protein analysis[J]. Analytical Chemistry, 2009, 81(2): 669-675.
[48] PAROLO C, MERKOCI A. Paper-based nanobiosensors for diagnostics[J]. Chemical Society Reviews, 2013, 42(2): 450-457.
[49] 孙艳秋, 赵奎华, 曹远银, 等. 黄瓜细菌性角斑病免疫胶体金检测试纸条的研制[J]. 植物病理学报, 2011, 41(2): 131-138.
[50] HE Yuqing, ZENG Kang, ZHANG Sanquan, et al. Visual detection of gene mutations based on isothermal strand-displacement polymerase reaction and lateral flow strip[J]. Biosensors and Bioelectronics, 2010, 31(1): 310-315.
[51] HEID C A, STEVENS J, LIVAK K J, et al. Real time quantitative PCR[J]. Genome Research, 2009, 6: 986-994.
[52] BUSTIN S A, BENES V, GARSON J A, et al. The MIQE guidelines: minimum information for publication of quantitative real-time PCR experiments[J]. Clinical Chemistry, 2009, 55(4): 611-622.
[53] NAZARENKO I, LOWE B, DARFLER M, et al. Multiplex quantitative PCR using self-quenched primers labeled with a single fluorophore[J]. Nucleic Acids Research, 2002, 30(9): e37.
[54] VOGELSTEIN B, KINZLER K W. Digital PCR[J]. Proceedings of the National Academy of Sciences of the United States of America, 1999, 96(16): 9236-9241.
[55] DUBE S, QIN J, RAMAKRISHNAN R. Mathematical analysis of copy number variation in a DNA sample using digital PCR on a nanofluidic device[J]. PLoS One, 2008, 3(8): e2876.
[56] CHEN W W, BALAJ L, LIAU L M, et al. BEAMing and droplet digital PCR analysis of mutant IDH1 mRNA in glioma patient serum and cerebrospinal fluid extracellular vesicles[J]. Molecular Therapy, 2013, 2: e109.
[57] BURKE D G, DONG L H, BHAT S B, et al. Digital polymerase chain reaction measured pUC19 marker as calibrant for HPLC measurement of DNA quantity[J]. Analytical Chemistry, 2013, 85(3): 1657-1664.
[58] TALY V, PEKIN D, BENHAIM L, et al. Multiplex picodroplet digital PCR to detect KRAS mutations in circulating DNA from the plasma of colorectal cancer patients[J]. Clinical Chemistry, 2013, 59(12):172-1731.
[59] DIDELOT A, KOTSOPOULOS S K, LUPO A, et al. Multiplex picoliterdroplet digital PCR for quantitative assessment of DNA integrity in clinical samples[J]. Clinical Chemistry, 2013, 59(5): 815-823.
[60] CORBISIER P, BHAT S, PARTIS L, et al. Absolute quantification of genetically modified MON810 maize (Zea mays L.) by digital polymerase chain reaction[J]. Analytical and Bioanalytical Chemistry, 2010, 396(6): 2143-2150.
[61] SANDERS R, HUGGETT J F, BUSHELL C A, et al. Evaluation of digital PCR for absolute DNA quantification[J]. Analytical Chemistry, 2011, 83(17): 6474-6484.
[62] MORISSET D, STEBIH D, MILAVEC M, et al. Quantitative analysis of food and feed samples with droplet digital PCR[J]. PLoS One, 2013, 8(5): e62583.
[63] ZHANG Hongquan, LI Feng, DEVER B, et al. DNA-mediated homogeneous binding assays for nucleic acids and proteins[J]. Chemical Reviews, 2013, 113(4): 2812-2841.
[64] MORALES-NARVAEZ E, MERKOCI A. Graphene oxide as an optical biosensing platform[J]. Advanced Materials, 2012, 24(25): 3298-3308.
[65] ZHU D B, XING X B, MA W G, et al. Isothermal protein detection assay based on high efficient T7 RNA polymerase transcriptionmediated amplification system and graphene oxide fluorescence switch platform[J]. Sensors and Actuators B: Chemical, 2014, 193: 178-184.
[66] LI Zhen, ZHU Wenping, ZHANG Jinwen, et al. A label-free amplified fluorescence DNA detection based on isothermal circular stranddisplacement polymerization reaction and graphene oxide[J]. Analyst, 2013, 138: 3616-3620.
[67] XU Wei, XUE Xuejia, LI Tianhu, et al. Ultrasensitive and selective colorimetric DNA detection by nicking endonuclease assisted nanoparticle amplification[J]. Angewandte Chemie-International Edition, 2009, 48(37): 6849-6852.
[68] PRIGODICH A E, SEFEROS D S, MASSICH M D, et al. Nano-flares for mRNA Regulation and Detection[J]. ACS Nano, 2009, 3(8): 2147-2152.
[69] 李鸿梅, 房学迅, 陈娟娟, 等. 量子点荧光标记应用于生物学的研究进展[J]. 国外医学生物医学: 工程分册, 2004, 27(5): 281-285.
[70] 苗恒, 汤恩旗, 许世超, 等. 水溶性CdTe量子点的制备嗯哈表面修饰及表征[J]. 广东化工, 2010, 37(2): 23-25.
[71] WU Xingyong, LIU Hongjian, LIU Jianquan, et al. Immunofluorescent labeling of cancer marker Her2 and other cellular targets with semiconductor quantum dots[J]. Nature Biotechnology, 2003, 21(1): 41-46.
[72] PANCHUK-VOLOSHINA H, HAUGLAND R P, BISHOPSTEWART J, et al. Alexa dyes, a series of new fluorescent dyes that yield exceptionally bright, photostable conjugates[J]. Journal of Histochemistry & Cytochemistry, 1999, 47(9): 1179-1188.
[73] FREEMAN R, LIU X Q, WILLNER I. Amplified multiplexed analysis of DNA by the exonuclease Ⅲ-catalyzed regeneration of the target DNA in the presence of functionalized semiconductor quantum dots[J]. Nano Letters, 2011, 11(10): 4456-4461.
[74] JENSEN A H, BERTHEAU Y, LOOSE M D, et al. Detecting unauthorized genetically modified organisms (GMOs) and derived materials[J]. Biotechnology Advances, 2012, 30(6): 1318-1335.
Recent Progress in Techniques for the Detection and Analysis of Genetically Modified Foods
WANG Chen-guang1, XU Wen-tao1,2, HUANG Kun-lun1,2, LUO Yun-bo1,2,*
(1. College of Food Science and Nutritional Engineering, China Agricultural University, Beijing 100083, China; 2. The Supervision, Inspection and Testing Center of Genetically Modified Organisms Food Safety, Ministry of Agriculture, Beijing 100083, China)
Nowadays, many countries have formulated regulatory laws for urging enterprises to identify the specific content of genetically modified foods (GMFs) in various ways, proposing higher requirement for the detection techniques of GMFs. This review describes the GMF labeling systems of various countries all over the world as well as their significance and presents the latest progress in techniques for the analysis and detection of GMFs, including some emerging techniques such as next-generation sequencing, isothermal amplification and omics techniques. At last, the future prospects of these techniques are also discussed.
genetically modified foods; analysis and detection; molecular characterization; isothermal amplification
TS201.6
A
1002-6630(2014)21-0297-09
10.7506/spkx1002-6630-201421058
2014-03-25
转基因生物新品种培育科技重大专项(2014ZX08012-001)
王晨光(1991—),男,硕士,研究方向为转基因食品分子检测技术。E-mail:italy10.wang@gmail.com
*通信作者:罗云波(1960—),男,教授,博士,研究方向为食品安全与食品生物技术。E-mail:lyb@cau.edu.cn
