多穗柯三叶苷对脂多糖诱导小鼠炎症反应的保护作用
2014-03-08范小龙董华强张英慧
范小龙,董华强,张英慧,*,刘 欣,*
(1.华南农业大学食品学院,广东 广州 510642;2.佛山科学技术学院食品与园艺 学院,广东 佛山 528231)
多穗柯三叶苷对脂多糖诱导小鼠炎症反应的保护作用
范小龙1,董华强2,张英慧2,*,刘 欣1,*
(1.华南农业大学食品学院,广东 广州 510642;2.佛山科学技术学院食品与园艺 学院,广东 佛山 528231)
探讨多穗柯三叶苷对脂多糖(lipopolysaccharide,LPS)诱导的小鼠炎症反应的抗炎症作用。以3、30、300 mg/(kg·d)3 个剂量组的多穗柯三叶苷灌胃小鼠3 d后,腹腔注射0.1 mg/kg LPS,观察三叶苷预处理对LPS诱导的炎症因子表达的影响。酶联免疫反应测定小鼠血清中 炎症因子肿瘤坏死因子(tumor necrosis factor-α,TNF-α)和白细胞介素-6(interleukin-6,IL-6)的含量,实时定量聚合酶链式反应法检测肝组织中TNF-α和IL-6的mRNA水平,免疫组织化学染色检测小鼠肝组织中TNF-α和IL-6蛋白水平。结果表明,3 mg/(kg·d)三叶苷剂量组可显著抑制LPS诱导的小鼠血清中TNF-α和IL-6的分泌,降低肝组织中TNF-α和IL-6的表达水平。多穗柯三叶苷对小鼠的炎症反应具有一定的保护作用。
多穗柯;三叶苷;抗炎作用;脂多糖;炎症反应
脂多糖(lipopolysaccharide,LPS)是革兰氏阴性菌细胞壁的主要组成成分,同时也是这些细菌引发炎症反应的主要物质[1]。LPS通过其与哺乳动物细胞表面的Toll样受体(TLR)4/CD14复合体的结合[2],激活细胞信号 通路从而引发炎症因子的过量表达,包括肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)和白细胞介素-6(interleukin-6,IL-6)[3-5]。细胞炎症因子的过量分泌会引起全身炎症反应综合征、组织损伤、代谢综合征等疾病,甚至导致死亡。降低TNF-α、IL-6等因子的表达是预防机体炎症反应的重要措施。
多穗柯(Lithocarpus polystachyus Rehd)为壳斗科柯属植物,主要分布于我国长江以南各省区,其嫩叶中富含植物化学活性成分[6-8]。本课题组从多穗柯的嫩叶中分离出一种甜度较高的二氢查耳酮——三叶苷(根皮素-4’-β-D-葡萄糖苷,结构如图1所示),前期研究表明三叶苷对糖尿病关键酶(α-葡萄糖苷酶和α-淀粉酶)活性有明显的抑制作用[9]。相关研究证实三叶苷具有较强的抗氧化活性[10-11]。目前尚未见对其潜在抗炎症作用的研究。本实验 旨在研究多穗柯三叶苷对LPS诱导的小鼠炎症因子表达的影响。

图1 三叶苷的化学结构Fig.1 Chemical structure of trilobatin
1 材料与方法
1.1 动物、材料与试剂
SPF级BALB/c雌鼠,6~8 周龄,体质量18~22 g,许可证号:SCXK(粤)2008-0002,由广东省医学实验动物中心提供。
三叶苷(纯度>99%),分离纯化自多穗柯嫩叶[9]。
LPS(E.coli O26:B6) 美国Sigma公司;小鼠TNF-α酶联免疫吸附反应(enzyme-linked immunosorbent assay,ELISA)检测试剂盒、小鼠IL-6 ELISA检测试剂盒 上海依科赛生物制品有限公司;RNAiso Plus试剂 日本TaKaRa公司;M-MLV First Strand Kit 美国Invitrogen公司;SYBR®Green Realtime PCR Master Mix 日本Toyobo公司;荧光定量聚合酶链式反应(polymerase chain reaction,PCR)引物 上海英潍捷基公司;TNF-α抗体、IL-6抗体 美国Santa Cruz公司;免疫组化染色试剂盒 武汉博士德公司。
1.2 仪器与设备
核酸蛋白检测仪、高速冷冻离心机 德国Eppendorf公司;SpectraMax M2型多功能酶标仪 美国MDC公司;Stat-Fax 2600型自动洗板机 美国Awareness公司;梯度PCR仪 德国Biometra公司;7500型荧光定量PCR仪 美国Applied Biosyst ems公司;光学显微镜 日本奥林巴斯公司。
1.3 方法
1.3.1 动物模型的建立
采用小剂量LPS注射的方法建立炎症反应小鼠模型[12]。LPS模型对照组和三叶苷各剂量组小鼠腹腔注射(按体质量计,下同)0. 1 mg/kg LPS[13],空白对照组注射等体积的生理盐水。腹腔注射后0、2、4、8 h,摘除眼球采血,分离血清,测定血清中TNF-α和IL-6的含量。
1.3.2 实验动物分组与处理
60 只BALB/c雌鼠随 机分为5 组,每组12 只,分别为空白对照组,LPS模型对照组,三叶苷低、中、高剂量组分别以3、30、300 mg/(kg·d)的剂量灌胃小鼠,连续灌胃3 d;空白对照组及LPS模型对照组灌胃等体积溶媒(0.5%羧甲基纤维素钠)。于末次灌胃1 h后,三叶苷各剂量组和LPS模型对照组腹腔注射0.1 mg/kg LPS,空白对照组注射等体积的生理盐水。腹腔注射2 h后,摘除眼球采血,分离血清,-20 ℃保存待测。取血后立即开腹取肝组织:一部分肝组织立即用4%的多聚甲醛溶液固定,进行免疫组化分析;剩余肝组织-80 ℃保存待测mRNA的表达变化。
1.3.3 ELISA检测
收集各组小鼠血清,按ELISA试剂盒说明书操作,对血清中TNF-α和IL-6进行测定。在450 nm波长处测定OD值,根据标准曲线计算TNF-α和IL-6的分泌量。
1.3.4 荧光定量PCR检测
按RNAiso Plus试剂方法提取肝组织中的总RNA,用一定量DEPC水溶解RNA,经0.8%琼脂糖凝胶电泳检测RNA的完 整性,利用核酸蛋白检测仪测RNA溶液的浓度和纯度。TNF-α和IL-6及内参基因β-actin的mRNA扩增采用两步法进行:首先利用逆转录酶M-MLV和随机引物完成RNA的逆转录反应;合成的cDNA用无菌水稀释为4 ng/μL,按表1提供的引物序列进行荧光定量PCR反应。反应采取20 μL体系,即SYBR Green Mix 10 uL,上下游引物各0.5 μL(10 μmol/L),cDNA 2 μL,三蒸水7 μL。反应条件:50 ℃ 2 min,95 ℃ 1 min; 95 ℃ 15 s、60 ℃ 1 min,40 个循环;95 ℃ 15 s,60 ℃1 min;95 ℃ 15 s,60 ℃ 15 s。用2-ΔΔCt法分析TNF-α和IL-6 mRNA的相对含量。
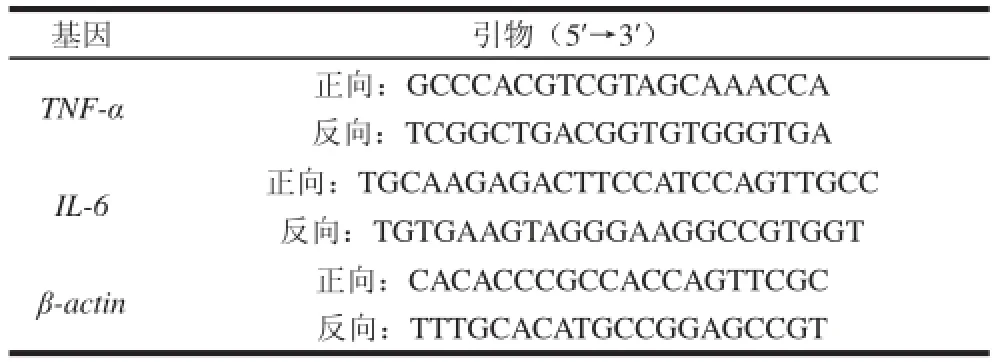
表1 荧光定量PCR引物TTaabbllee 11 PPrriimmeerrss uusseedd ffoorr rreeaall--ttiimmee qquuaannttiittaattiivvee PPCCRR
1.3.5 免疫组化检测
小鼠肝组织在多聚甲醛固定24 h,脱水后常规石蜡包埋切片,切片约4 μm厚,贴于预先涂有铬钒明胶的载玻片上。采用免疫组化染色SABC(strept avidin-biotincomplex)法检测在小鼠肝组织中TNF-α和IL-6的表达,苏木素细胞核复染,显微镜下取400×视野下观察标本,照相。TNF-α和IL-6阳性染色结果为胞内区域被部分或均匀地染上棕 红色。
1.4 统计学分析
2 结果与分析
2.1 LPS诱导小鼠炎症反应模型的建立

图2 LPS诱导小鼠炎症反应模型的建立Fig.2 Establishment of animal model of LPS-induced inflammatory response
本实验以0.1 mg/kg的剂量腹腔注射LPS建立小鼠炎症反应模型。如图2所示,空白对照组小鼠血清中TNF-α和IL-6的含量在0、2、4、8 h始终保持极低水平;与空白对照组相比,LPS模型对照组小鼠腹腔注射LPS 2 h后,血清中炎症因子TNF-α和IL-6的含量显著升高(P<0.05),分别达到(243.63±43.07)pg/mL和(1 435.71±232.17)pg/mL,随后其含量下降,到8 h时恢复到正常水平。
2.2 三叶苷降低LPS诱导的小鼠血清TNF-α和IL-6含量

表2 三叶苷对小鼠血清中TNNFF--α和IL-6分泌的影响Table2 Effect of trilobatin on the secretion of TNF-α and IL-6 in mouse serruumm
小鼠血清中的TNF-α和IL-6含量用ELISA法检测。由表2可知,与正常对照组相比,LPS模型对照组小鼠血清中TNF-α和IL-6含量显著升高(P<0.05)。与LPS模型对照组相比,三叶苷低剂量组可显著降低血清TNF-α和IL-6含量(P<0.05),其中TNF- α为LPS模型对照组的40.45%,IL-6为LPS模型对照组的48.34%;三叶苷中剂量组可降低血清TNF-α的含量,但其IL-6含量与LPS模型对照组无显著性差异;三叶苷高剂量组血清中TNF-α和IL-6含量均与LPS模型对照组无显著性差异。
2.3 三叶苷抑制LPS诱导的小鼠肝组织TNF-α和IL-6 mRNA表达

表3 三叶苷对小鼠肝组织中TNNFF--α和IL-6 mRNA表达的影响Table3 Effect of trilobatin on TNF-α and IL-6 mRNA expression in mouse livveerr
由表3可知,与空白对照组相比,LPS模型对照组小鼠肝组织中TNF-α和IL-6的mR NA表达量明显上调(P< 0.05)。与LPS模型对照组相比,三叶苷低、中剂量组均可降低TNF-α和IL-6 mRNA表达水平(P<0.05);三叶苷高剂量组中TNF-α和IL-6的mRNA表达量与LPS模型对照组比较无显著性差异。三叶苷低剂量组的干预效果优于三叶苷中剂量组,三叶苷低剂量组TNF-α mRNA相对表达量为LPS模型对照组的46.78%,IL-6 mRNA相对表达量为LPS模型对照组的52.68%。
2.4 免疫组化检测小鼠肝组织中TNF-α和IL-6的蛋白水平

图3 小鼠肝组织TNNFF--α和IL-6表达免疫组化结果(440000×)Fig.3 Immunohistochemical examination of TNF-α and IL-6 protein expression in liver (400×)
由图3可知,与空白对照组相比,LPS模型对照组小鼠TNF-α和IL-6在肝组织细胞质内大量表达,着色效果明显。三叶苷低、中剂量组与LPS模型对照组相比,细胞核外区域染色较浅,TNF-α和IL-6的表达降低,其中三叶苷低剂量组的抑制效果优于三叶苷中剂量组;三叶苷高剂量组与LPS模型对照组相比,TNF-α和IL-6的染色程度均无明显差别。
3 讨 论
三叶苷具有抗氧化、清除自由基的活性,是一种有一定应用潜力的抗糖尿病活性物质[14]。最新体外实验证明,根 皮素具有抗炎症作用,可以抑制巨噬细胞释放TNF-α、IL-6、NO、前列腺素E2等炎症因子及相关的细胞信号通路[15]。但三叶苷是否具有潜在抗炎症作用尚未阐明。
注射LPS到小鼠体内能够诱发机体炎症反应,伴随炎症因子TNF-α和IL-6的大量表达[16-18]。TNF-α主要由激活的巨噬细胞分泌,在系统性炎症反应早期大量释放,同时 还能够诱导其他炎症因子的分泌。IL-6是一种多功能的细胞炎症因子,是炎症介质网络的主要成分,在炎症的发生和发展过程中起重要作用。很多植物化学物的消炎作用与降低LPS诱导的TNF-α和IL-6表达水平有关[19-20]。
本实验利用低剂量LPS诱导小鼠炎症反应模型,观察多 穗柯三叶苷对LPS致小鼠炎症反应的抗炎作用。结果表明,3 mg/(kg·d)剂量三叶苷可显著抑制由LPS诱导的血清中TNF-α和IL-6含量的升高及其在肝组织中mRNA表达水平。同时,免疫组化结果可知三叶苷低剂量组的小鼠肝细胞中TNF-α和IL-6的蛋白水平明显降低。根据以上结果,推测三叶苷具有减轻LPS诱导的炎症反应的作用,三叶苷的保护作用可能是通过下调炎症因子TNF-α和IL-6的mRNA表 达水平,进而抑制其分泌来实现的。多穗柯三叶苷抑制炎症因子分泌的研究可为甜茶多穗柯的综合利用和功能性食品的研发提供一定理论依据。
[1] FENG Qin, REN Yong, WANG Yu, et al. Anti-inflammatory effect of SQC-beta-CD on lipopolysaccharide-induced acute lung injury[J]. Journal of Ethnopharmacology, 2008, 118(1): 51-58.
[2] LAFLAMME N, RIVEST S. Toll-like receptor 4: the missing link of the cerebral innate immune resp onse triggered by circulating gramnegative bacterial cell wall components[J]. The FASEB Journal, 2001, 15(1): 155-163.
[3] GUHA M, MACKMAN N. LPS induction of gene expression in human monocytes[J]. Cellular Signalling, 2001, 13(2): 85-94.
[4] YANG Yaozhi, TANG Youzhi, LIU Yahong. Wogonoside displays anti-inflammatory effects through modulating inflammatory mediator expression using RAW264.7 cells[J]. Journal of Ethnopharmacology, 2013, 148(1): 271-276.
[5] SOROMOU L W, CHU Xiao, JIANG Lanxiang, et al. in vitro and in vivo protection provided by pinocembrin against lipopolysaccharide-induced inflammatory responses[J]. International Immunopharmacology, 2012, 14(1): 66-74.
[6] 李胜华, 伍贤进, 杨青丹, 等. 多穗柯化学成分研究[J]. 中药材, 2010(4): 549-551.
[7] 肖坤福, 廖晓峰. 多穗柯黄酮类化合物的分离及鉴定[J]. 林产化学与工业, 2006, 26(3): 85-87.
[8] 李胜华, 伍贤进, 曾军英, 等. 多穗柯中黄酮类成分研究[J]. 中草药, 2010(12): 1967-1969.
[9] 张毅, 宁正祥, 董华强. 多穗柯三叶苷的抑制糖尿病关键酶活性和抗氧化性[J]. 食品科学, 2011, 32(5): 32-35.
[10] DUGE de B T, GUYOT S, PAULIN J P, et al. Dihydrochalcones: implication in resistance to oxidative stress and bioactivities against advanced glycation end-products and vasoconstriction[J]. Phytochemistry, 2010, 71(4): 443-452.
[11] YANG Weimin, LIU Jikai, QIN Xiangdong, et al. Antioxidant activities of three dihydrochalcone glucosides from leaves of Lithocarpus pachyphyllus[J]. Zeitschrift für Naturforschung. C-Journal of Biosciences, 2004, 59(7/8): 481-484.
[12] SOROMOU L W, JIANG L, WEI M, et al. Protection of mice against lipopolysaccharide-induced endotoxic shock by pinocembrin is correlated with regulation of cytokine secretion[J]. Journal of Immunotoxicology, 2014, 11(1): 56-61.
[13] COWDEN J M, YU Fuqu, CHALLAPALLI M, et al. Antagonism of the histamine H4 receptor reduces LPS-induced TNF production in vivo[J]. Inflammation Research, 2013, 62(6): 599-607.
[14] DONG Huaqiang, LI Mei, ZHU Feng, et al. Inhibitory potential of trilobatin from Lithocarpus polystachyus Rehd against α-glucosidase and α-amylase linked to type 2 diabetes[J]. Food Chemistry, 2012, 130(2): 261-266.
[15] CHANG Weitien, HUANG Wenchung, LIOU Chianjiun. Evaluation of the anti-inflammatory effects of phloretin and phlorizin in lipopolysaccharide-stimulated mouse macrophages[J]. Food Chemistry, 2012, 134(2): 972-979.
[16] ZHENG Yuejuan, GUO Ziyi, HE Weigang, et al. Ephedrine hydrochloride protects mice from LPS challenge by promoting IL- 10 secretion and inhibiting proinflammatory cytokines[J]. International Immunopharmacology, 2012, 13(1): 46-53.
[17] KANCZKOWSKI W, CHATZIGEORGIOU A, SAMUS M, et al. Characterization of the LPS-induced inflammation of the adrenal gland in mice[J]. Molecular and Cellular Endocrinology, 2013, 371(1/2): 228-235. [18] WU Dalei, LI Wen, LOK P, et al. AhR deficiency impairs expression of LPS-induced inflammatory gen es in mice[J]. Biochemical Biophysical Research Communication, 2011, 410(2): 358-363.
[19] LI Yiching, YEH Chunghsin, YANG Mingling, et al. Luteolin suppresses inflammatory mediator expression by blocking the Akt/ NFκB pathway in acute lung injury induced by lipopolysaccharide in mice[J]. Evidence-Based Complementary and Alternative Medicine, 2012. doi: 10.1155/2012/383608.
[20] XIE Chenghui, KANG Jie, LI Zhimin, et al. The açaí flavonoid velutin is a potent anti-inflammatory agent: blockade of LPS-mediated TNF-α and IL-6 production through inhibiting NF-κB activation and MAPK pathway[J]. The Journal of Nutritional Biochemistry, 2012, 23(9): 1184-1191.
Protective Effect of Trilobatin against Lipopolysaccharide-Induced Inflammatory Response in Mice
FAN Xia o-long1, DONG Hua-qiang2, ZHANG Y ing-hui2,*, LIU Xin1,*
(1. College of Food Science, So uth China Agricultural University, Guangzhou 510642, China; 2. College of Food and Horticultural Sciences, Foshan University, Foshan 528231, China)
This study aimed to investigate the in vivo anti-inflammatory activity of trilobatin extracted from the young leaves of Lithocarpus polystachyus Rehd on lipopolysaccharide (LPS)-induced inflammatory response in mice. After being treated intragastrically with trilobatin at three different dosage s (3, 30 and 300 mg/(kg·d)) for 3 days, the mice were administered intraperitoneally with LPS (0.1 mg/kg) 1 h after the last int ragastrical treatment on day 3. The effect of trilobatin on the expression of LPS-induced pro-inflammatory cytokines was detected. Tumor necrosis factor-α (TNF-α) and interleukin-6 (IL-6) in serum were meas ured using enzyme-linked immunosorbent assay (ELISA) and the mRNA expression levels of TNF-α and IL-6 in liver were assayed with real-time qu antitative polymerase chain reaction (RT-qPCR). The protein levels of TNF-α and IL-6 in liver were detected by immunohistochemical strept avidin-biotin complex (SABC) method. We found that trilobatin at low dosage (3 mg/(kg·d)) significantly inhibited LPS-induced TNF-α and IL-6 production in serum, and decreased their expression in liver. These results indicate that trilobatin from Lithocarpus polystachyus Rehd has protective effect on inflammatory response in mice.
Lithocarpus polystachyus Rehd; trilobatin; anti-inflammation; lipopolysaccharide (LPS); inflammatory response
TS201.4
A
1002-6630(2014)21-0186-04
10.7506/spkx1002-6630-201421036
2014-01-17
国家自然科学基金面上项目(31071537)
范小龙(1988—),男,硕士,研究方向为食品科学。E-mail:kylexiao2011@163.com
*通信作者:张英慧(1974—),女,副教授,博士,研究方向为食品安全与营养。E-mail:zhang_ying-hui@163.com刘欣(1958—),女,教授,硕士,研究方向为食品生物化学及食品添加剂。E-mail:liuxin@scau.edu.cn
