富硒猕猴桃果酒酵母的筛选及鉴定
2014-03-08李同祥
郝 瑶,王 陶,李 文,*,李同祥,袁 航
(1.徐州工程学院 江苏省食品资源开发与质量安全重点建设实验室,江苏 徐州 221008;2.中国科学院离子束生物工程学重点实验室,安徽 合肥 230031)
富硒猕猴桃果酒酵母的筛选及鉴定
郝 瑶1,王 陶1,李 文1,*,李同祥1,袁 航2
(1.徐州工程学院 江苏省食品资源开发与质量安全重点建设实验室,江苏 徐州 221008;2.中国科学院离子束生物工程学重点实验室,安徽 合肥 230031)
通过酵母菌的分离、显微镜观察和WL培养基的筛选,初筛出酵母菌10 株。采用猕猴桃果汁发酵法、CO2损失质量比较法、以及生理生化的鉴定,从中复筛出一株发酵能力好、产果香酒香浓郁的菌株Y-41。查阅《酵母菌的特征与鉴定手册》,初步鉴定该菌株为毕赤酵母属,再通过分子生物学鉴定,确定该菌株为库德里阿兹威氏毕赤酵母(Pichia kudriavzevii)。对Y-41菌种进行了耐受性检测,结果表明Y-41对葡萄糖、酒精度、pH值具有较高耐受性,可作为富硒猕猴桃果酒发酵专用菌种。
富硒猕猴桃;酵母菌;筛选;鉴定
猕猴桃(Actinidia chinensis Planch)被称为“果中之王”,含有异亮氨酸、酪氨酸、亮氨酸、苯丙氨酸、丙氨酸等10多种氨基酸,丰富的钙、磷、铁等矿物质,还含有胡萝卜素、VC及VB等多种维生素,对保持人体健康具有重要的作用[1-2]。猕猴桃具有降血脂[3]、防癌和治癌[4]、抗炎和提高免疫力[5]等作用。猕猴桃果酒中的VC含量特别高,据检测每升酒中VC含量为480 mg[6]。
我国猕猴桃野生果实蕴藏量极为丰富,但由于其果实较小,食用不方便,不耐储藏,野生猕猴桃资源一直没有得到很好的开发利用[7]。硒是人体必需的微量元素,开发生物源有机硒食品或食品添加剂是给机体提供硒源的有效途径[8-9]。万源市位于四川东北部,大巴山腹心地带,是四川省唯一的天然富硒区,其野生猕猴桃富含硒元素。
酿酒酵母是影响果酒品质的重要因素之一,它的选择会直接影响果酒的感官和理化品质[10-11]。果酒在生产过程中所采用的酵母菌株一般为葡萄酒酵母,然而这种酵母是针对葡萄酒的生产工艺特点而开发出来的,具有明显的针对性,在其他果酒生产中效果并不显著[12]。目前我国在猕猴桃酿酒研究和酿制过程中,所使用的酵母基本是酿酒活性干酵母或葡萄酒酵母[13-14]。因此,筛选猕猴桃酿酒专用的酵母具有重要意义和广阔的应用前景,猕猴桃酿酒酵母主要通过果实、自然发酵液中初步分离筛选,目前已经筛选出发酵性能较好的猕猴桃果酒酵母[15-19],但尚未见酿造富硒猕猴桃果酒的专用酵母菌株。
WL营养琼脂培养基可以根据菌落的特征形态快速地对发酵过程中大多数相关的酵母进行良好的鉴定[20]。因此本实验拟以四川万源的野生富硒猕猴桃为研究对象,通过WL营养琼脂培养基来筛选适合酿造野生富硒猕猴桃果酒所用的酵母菌,并对筛选得到的酵母菌进行形态和生理生化及分子生物学鉴定,具有一定理论意义和实际研究价值。
1 材料与方法
1.1 材料、培养基与试剂
野生富硒猕猴桃,采自四川省万源市花萼山地区。
以YPD培养基为分离培养基:酵母浸膏1%、蛋白胨2%、葡萄糖2%;WL营养琼脂培养基[20]:酵母浸粉0.5%、胰蛋白胨0.5%、葡萄糖5%、琼脂2%、磷酸二氢钾0.055%、氯化钾0.042 5%、氯化钙0.012 5%、氯化铁0.000 25%、硫酸镁0.012 5%、硫酸锰0.000 25%、溴甲酚绿0.002 2%,pH 6.5;保藏培养基:酵母浸膏0.5%、蛋白胨0.5%、葡萄糖1.5%、KH2PO40.2%、MgSO4·7H2O 0.1%、(NH4)2SO40.1%、琼脂2%、蒸馏水配制,121 ℃灭菌20 min。
酵母浸膏、蛋白胨(均为分析纯) 国药集团化学试剂有限公司;其他试剂均为分析纯。
1.2 仪器与设备
TU-1810紫外分光光度计 北京普析通用仪器有限责任公司;HH.B11.600-S-Ⅱ型电热恒温培养箱 上海跃进医疗器械厂;HYG摇瓶柜 上海欣蕊自动化设备有限公司;手持糖度计 上海米青科实业有限公司;SWCJ-1F型单人双面净化台 苏中净化设备有限公司。
1.3 方法
1.3.1 酵母菌的分离
取两个成熟的野生富硒猕猴桃,无菌条件下各切取10 g,捣碎,分别放入盛有90 mL无菌水的锥形瓶中,振荡均匀,置于30 ℃恒温摇床内培养24 h,制成菌悬液。在无菌操作条件下,取原菌悬液100 μL,用无菌水稀释至10-1、10-2、10-3、10-4、10-5、10-6、10-7、10-8、10-9。分别取9 个梯度的菌悬液100 μL,滴加到YPD平板分离培养基上,由低浓度至高浓度涂布均匀。置于30 ℃的恒温培养箱中培养2 d,观察并记录菌落质地、菌落颜色及菌落表面特征。
1.3.2 酿酒酵母的初筛
对YPD分离培养基培养的酵母菌株进行初步筛选,挑选无杂菌污染,具有单菌落,表面为球形、突起、光滑、不透明、奶油状的菌株,在10×40倍显微镜镜检,观察并记录细胞的形态特征、繁殖方式等,筛选出以多端出芽繁殖的菌株。
将初筛保藏在斜面培养基上的菌株以划线分离的方式接种到WL琼脂培养基进行酿酒酵母的筛选,30 ℃恒温培养箱中培养3~5 d后观察形态,筛选出具有明显单菌落,颜色为奶油色至绿色,表面为球形突起光滑、不透明、奶油状的菌株。
1.3.3 酿酒酵母的复筛
酿酒酵母的一级复筛:采用杜氏管发酵法,在同等条件下,将初步筛选的菌种分别接入野生富硒猕猴桃果汁,30 ℃条件下培养48 h,每隔12 h观察杜氏小管中产气情况。初步判断酿酒酵母的发酵能力和絮凝能力,进一步筛出性状良好的酵母菌株。
假酵母菌丝的鉴定:为防止假酵母菌丝对实验结果的影响,对一级复筛的菌种进行假酵母菌丝的鉴定,将一级复筛的菌种接种到玉米粉琼脂培养基,30 ℃恒温培养箱中培养5~7 d,观察并记录培养皿中是否有假酵母菌丝的生长。
酿酒酵母的二级复筛:将经过鉴定的一级复筛菌种所对应的斜面菌种接入YPD液体培养基,30 ℃活化培养24 h,然后取6 mL接入装有80 mL已灭菌猕猴桃汁的锥形瓶中,称量各锥形瓶的总质量并记录。将锥形瓶放入30 ℃恒温培养箱中发酵培养7 d,在无菌条件下释放瓶内的CO2后称量各锥形瓶的总质量,通过CO2损失质量法比较各菌株发酵能力。采用蒸馏法测量各锥形瓶中猕猴桃汁的酒精含量,每株平行3瓶,经感官评定酒的风味(色泽、香味等)。
1.3.4 菌株的初步鉴定
1.3.4.1 菌株形态学观察
观察复筛得到的性状优良菌株的菌落形态。
1.3.4.2 菌株的生理生化特性鉴定
菌株的生理生化特性鉴定参照文献[21-22]的方法进行。1.3.4.3 菌株分子生物学鉴定
提取菌株的基因组DNA[23],根据真菌26S rDNA D 1/D 2区序列保守性设计通用引物:前引物5’-C A G A G T T T G AT C C T G G C T-3’,后引物5’-AGGAGGTGATCCAGCCGCA-3’,进行PCR扩增,PCR产物送生工生物工程(上海)股份有限公司测序,将测定的序列提交GenBank数据库,使用BLAST程序与数据库中已有的26S rDNA D1/D2区序列进行相似性比较分析,分析该菌株的分类地位。
1.3.5 菌株性质实验
1.3.5.1 菌株的生长曲线
将菌株接种到灭菌的YPD液体培养基中,30 ℃恒温摇床培养,观察60 h菌株的生产情况,前期间隔2 h取样,后期间隔4、6 h和12 h取样,用可见分光光度计在560 nm波长处测其吸光度,重复5 次,绘制出Y-41菌株生长曲线的变化趋势。
1.3.5.2 菌株的耐受性实验[24]
根据菌株在胁迫梯度液体培养基中的生长情况测定。接种酵母至YPD 液态培养基中,30 ℃培养过夜。调节菌液浓度,以接种量为8%分别接种至100 mL酒精(8%、10%、12%、14%、16%)和pH值(4.0、4.5、5.0、5.5、6.0、6.5)胁迫梯度液体培养基中,30 ℃、120 r/min振荡培养,每隔12 h取样1 mL定容到5 mL,测定600 nm波长处吸光度。分别观察72 h内酵母细胞在相应胁迫条件下的生长情况。
1.3.6 分析检测方法
酵母菌的发酵能力:CO2损失质量法[25]。果汁的糖度用手持糖度计测定。
2 结果与分析
2.1 酵母菌的分离
经初步分离,共得到10 株符合条件的酵母菌菌株,记为Y-0~Y-9,其形态特征结果见表1。

表1 酵母菌分离菌株在YPD培养基上的形态特征Table1 Morphological characteristics of isolated yeasts on YPD agar plate
2.2 WL琼脂培养基初步筛选酿酒酵母

图1 酵母菌在WL培养基上的菌落形态Fig.1 Colony morphology of isolated yeasts on WL agar plate
通过WL琼脂培养基的初步筛选,共筛选出10 株具有明显单菌落,菌落颜色为奶油色至绿色,表面为球形突起光滑、不透明、奶油状的菌株(图1),对应的斜面编号分别为Y-11、Y-13、Y-33、Y-41、Y-52、Y-61、Y-62、Y-71、Y-72、Y-91。
2.3 酿酒酵母的复筛
2.3.1 酿酒酵母的一级复筛
将初筛得到的酵母菌菌株分别接入猕猴桃果汁中进行一级复筛,结果见表2。CO2损失质量越高,说明菌株发酵能力越好。菌株Y-11、Y-13、Y-62、Y-72的起始发酵力较低,而Y-71、Y-52、Y-41的起始发酵力显著高于其他菌株(P<0.05);Y-11、Y-13、Y-61、Y-72的总发酵力较低,Y-91、Y-33、Y-41的总发酵力较高。一般来讲,在一定范围内起始发酵力和总发酵力越高,越有利于果酒香气和风味物质的形成,所以Y-41、Y-71、Y-33、Y-52、Y-91更有利于提升猕猴桃酒整体品质。

表2 不同菌株发酵时CO 损失质量变化Table2 Changes in CO weight loss during fermentation by yeast isolates
2.3.2 假丝酵母的鉴定
对一级复筛得到的5 株酵母菌株进行假酵母菌丝鉴定,培养6 d后发现:Y-33、Y-41、Y-91的菌悬液所涂布的培养皿内无任何现象,说明没有假酵母菌丝;Y-52、Y-71的菌悬液所涂布的培养皿内则出现假酵母菌丝的生长,在筛选过程中可能因为假酵母菌丝的存在导致实验结果的不准确性,因此Y-52、Y-71两株菌株不适合用作猕猴桃酒的发酵。
2.3.3 酿酒酵母的二级复筛

表3 不同菌株发酵果酒的各项指标Table3 Chemical and sensory indicators of kiwifruit wine fermented by different strains
对剩余的3 株菌株进行二级复筛,结果见表3。从CO2的总损失质量来看,3 株菌株间差距不大,其中Y-41菌株CO2损失质量最高。Y-41、Y-33菌株发酵的果酒,果香酒香浓郁,酒精产率较高,适合做果酒发酵菌种。
2.4 菌株生理生化鉴定
对3 种菌株进行进一步生理生化鉴定,选择最优菌株作为发酵猕猴桃酒的酿酒酵母。由表4可知,碳源中葡萄糖、蔗糖、麦芽糖均能被菌株Y-33、Y-41、Y-91同化;乳糖、山梨醇、柠檬酸、可溶性淀粉均不能被同化。氮源中硝酸钾、肌酸和肌酐均不能被3 株菌株同化;硫酸铵不能被菌株Y-33、Y-91同化,但可被菌株Y-41同化利用。菌株Y-41和Y-91在无维生素培养实验中均能生长,Y-33在无维生素培养实验中不能生长。3 株菌株在37 ℃培养实验中均能生长。尿素酶检测和重氮基蓝B实验均为阴性。

表4 酵母菌的生理生化特征Table4 Physiological and biochemical characteristics of different yeast strains

表5 酵母菌在不同糖含量平板培养基中的生长情况Table5 Growth of yeast strains on agar plates with different concentrations of glucose
菌株Y-33、Y-41、Y-91酵母菌耐高糖实验结果见表5。3 株菌株在50%、60%、70%的葡萄糖含量下均能生长,在80%的葡萄糖含量下,只有Y-41菌株可以生长,而Y-33、Y-91菌株均不能生长。
根据以上鉴定结果,在氮源同化实验中,Y-41菌株与其他两株菌株相比,可以同化硫酸铵,对氮源的同化能力相对较强;在酵母菌的耐高糖实验中,Y-41菌株可以在80%葡萄糖的糖含量中生长,适应能力与其他两株菌株相比较强。结合酵母菌的二级复筛结果,选择Y-41菌株作为最终发酵猕猴桃的果酒酵母。根据酵母菌的特征与鉴定手册,可以初步判断Y-41菌株为毕赤酵母属(Pichia)。
2.5 Y-41菌株的形态特征
由显微镜镜检结果(图2)可知,Y-41菌株为椭圆形或近圆形,大小为7.9 μm×3.6 μm左右,无性繁殖方式均为多端出芽繁殖。
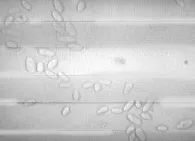
图2 显微细胞形态(40×10)Fig.2 Morphology of a single cell observed by microscope (40×10)
2.6 Y-41菌株的26S rDNA D1/D2区鉴定结果

图3 Y41菌株26S rDNA D1/D2 PCR产物扩增电泳图Fig.3 Electrophoresis of amplified products of 26S rDNA D1/D2 from yeast Y-41
由图3可知,经测序获得Y-41菌株的26S rDNA 序列,长度为588 bp。将此序列提交到NCBI基因数据库,进行序列比对分析,结果表明,菌株的序列与Pichia kudriavzevii的26S rDNA序列相似性最高,为100%。应用邻接法构建系统发育树如图4,进化树表明菌株Y-41与Pichia kudriavzevii(库德里阿兹威氏毕赤酵母)亲缘关系最近,且在一个分支中。综合形态特征、生理生化实验结果以及序列比对结果,初步鉴定该菌株为Pichia kudriavzevii。

图4 以菌株的26S rDNA序列为基础的系统发育树Fig.4 Phylogenetic relationship based on 26S rDNA of Y-41
2.7 Y-41菌株的特性
2.7.1 Y-41菌株的生长曲线
由图5可知,菌株在培养2 h后菌量以指数级增加,12 h后菌量达到稳定状态,并在较长时间(60 h)内酵母菌生长相对较平稳。
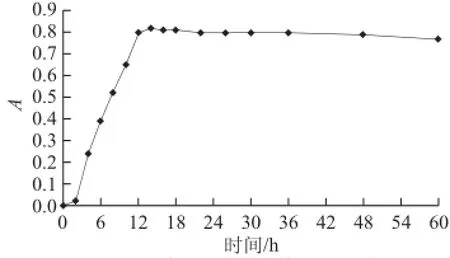
图5 Y-41在YPD培养基中的生长曲线Fig.5 Growth curve of Y-41 in YPD medium
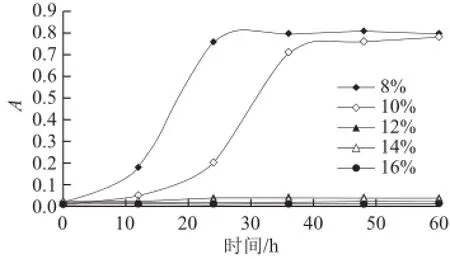
图6 Y-41在不同酒精含量的YPD培养基中的生长情况Fig.6 Growth of Y-41 in YPD medium with different concentrations of alcohol
2.7.2 Y-41菌株对酒精度的耐受性由图6可知,当酒精度≤10%时,对菌株生长的抑制作用不明显,当酒精度≥12%时,菌株生长受到严重的抑制,甚至基本不生长。酒精度为8%时,前12 h酵母菌生长缓慢,12~24 h期间(对数生长期)生长旺盛;而酒精度为10%时,前24 h生长缓慢,24~36 h期间生长旺盛,说明在此范围内,酒精度对酵母菌的生长有一定抑制作用。
2.7.3 Y-41菌株对pH值的耐受性

图7 Y-41在不同pH值的YPD培养基中的生长情况Fig.7 Growth of Y-41 in YPD medium with different pH conditions
由图7可知,当pH≤2.5时,酵母菌的生长相对于其他pH值的情况下较为缓慢,而当pH≥3.0时,酵母菌的生长曲线近乎吻合。说明酸度对Y-41菌株的生长有一定的影响,随着酸度的增加,菌体生长变慢,但是整体抑制作用不大。
3 结 论
通过分离、初筛、复筛以及生理生化的鉴定,获得一株适用于富硒猕猴桃果酒发酵的酵母菌株Y-41。该菌株发酵能力好、产果香酒香浓郁。形态学观察结果为:近圆形,多端出芽生殖,菌落突起、表面光滑、边缘整齐,乳白色,不透明。生理生化特征为:发酵葡萄糖、蔗糖;碳源同化葡萄糖、蔗糖、麦芽糖;氮源同化硫酸铵;在无维生素培养基上生长;产类淀粉实验、尿素酶检测实验、重氮基蓝B实验均为阴性;37 ℃条件下生长;在80%葡萄糖的培养基上生长;根据以上特征,初步鉴定为毕赤酵母属(Pichia)。分子生物学鉴定结果:该菌株26S rDNA D1/D2序列长588 bp,将测序得到的序列提交到GenBank数据库,与库中所有酵母菌的同源序列进行相似性比较,与毕赤酵母(Pichia)的碱基序列相似度最高,鉴定Y-41菌株为库德里阿兹威氏毕赤酵母(Pichia kudriavzevii)。对发酵用菌株Y-41的生长特性及对高酒精度和酸度的耐受性进行了研究,结果表明,该菌株耐酸能力较强,耐酒精度为10%。适合进行富硒猕猴桃果酒的发酵。
[1] 黄诚, 周长春, 李伟. 猕猴桃的营养保健功能与开发利用研究[J]. 食品科技, 2007, 32(4): 51-55.
[2] 王燕, 金利. 峨眉山野生猕猴桃酿酒酵母筛选研究[J]. 食品工业科技, 2012, 33(3): 178-179.
[3] 李加兴, 马美湖, 陈双平, 等. 猕猴桃籽油的营养成分及其保健功能[J].食品与机械, 2005, 22(4): 61-65.
[4] 林佩芳. 中华猕猴桃多糖复合物抗肿瘤作用[J]. 中华肿瘤杂志, 1988, 10(6): 440-442.
[5] 梁楚泗, 刘明义. 中华猕猴桃蛋白酶的性质及抗炎作用的研究[J].医药工业, 1985, 16(7): 24-26.
[6] 涂正顺, 李华, 束怀瑞. 猕猴桃发酵果酒优化工艺技术的研究[J]. 酿酒科技, 2006, 26(10): 43-45.
[7] HATFIELD D L, BERRY M J, GLADYSHEV V N. Selenium, its molecular biology and role in human health[M]. Netherlands: Kluwer Academic Publishers, 2001: 99-313.
[8] 王陶, 李文, 陈宏伟, 等. 氮离子注入蛹虫草选育高效富硒菌株的研究[J]. 食品科学, 2014, 35(15): 136-140.
[9] 黄宏文. 猕猴桃驯化改良百年启示及天然居群遗传渐渗的基因发掘[J]. 植物学报, 2009, 44(2): 127-142.
[10] LURTON L, SNAKKERS G, ROULLAND C, et al. Influence of the fermentation yeast strain on the composition of wine spirits[J]. Journal of the Science of Food and Agriculture, 1995, 67(4): 485-491.
[11] LAMBRECHTS M G, PRETORIUS I S. Yeast and its importance to wine aroma: a review[J]. South African Journal of Enology and Viticulture, 2000, 21(1): 97-129.
[12] HEARD G M. Novel yeasts in winemaking-looking to the future[J]. Food Australia, 1999, 51(7): 347-352.
[13] 王圣开, 董全. 国内外果酒生产工艺研究进展[J]. 中国食物与营养, 2008, 52(1): 37-39.
[14] 罗安伟, 刘兴华, 寇莉萍, 等. 猕猴桃酒用酵母的选育研究[J]. 中国食品学报, 2005, 5(3): 57-60.
[15] LOPANDIC K, ZELGER S, BANSZKY L K, et al. Identification of yeasts associated with milk products using traditional and molecular techniques[J]. Food Microbiology, 2006, 23(4): 341-350.
[16] 徐清萍, 朱广存. 野生猕猴桃果酒酵母的筛选鉴定及耐受性的研究[J].中国酿造, 2011, 29(7): 120-123.
[17] 李剑芳, 张灏. 发酵猕猴桃汁中产香酵母的分离、鉴定及生长特性的研究[J]. 食品科学, 2001, 22(9): 19-22.
[18] ORLIC S, REDZEPOVIC S, JEROMEL A, et al. Influence of indigenous Saccharomyces paradoxus strains on Chardonnay wine fermentation aroma[J]. International Journal of Food Science and Technology, 2007, 42(1): 95-101.
[19] KAPSOPOULOU K, KAPAKLIS A, SPYROPOULOS H. Growth and fermentation characteristics of a strain of the wine yeast Kluyveromyces thermotolerans isolated in Greece[J]. World Journal of Microbiology & Biotechnology, 2005, 21(8/9): 1599-1602.
[20] 薛军侠, 徐艳文, 杨莹, 等. WL培养基在酿酒酵母筛选中的应用[J].中国酿造, 2007, 25(9): 36-39.
[21] KREGER-van RI J. The yeast, a taxonomy study[M]. 3th ed. Amsterdam: Elsevier Science Publishers, 1984.
[22] 巴尼特. 酵母菌的特征与鉴定手册[M]. 胡瑞卿, 译. 青岛: 青岛海洋大学出版社, 1990.
[23] 张大为, 张洁, 洪磊东, 等. 发酵梨酒中产香酵母的分离、鉴定及生物学特性的研究[J]. 食品工业科技, 2013, 34(2): 179-185.
[24] 秦伟帅, 王海燕, 李超, 等. 不同葡萄酒酵母耐受性实验比较[J]. 中外葡萄与葡萄酒, 2009, 33(5): 16-19.
[25] 罗惠波, 李光辉. 耐酸酵母菌的筛选研究[J]. 四川理工学院学报: 自然科学版, 2004, 17(4): 151-154.
Screening and Identification of Yeast for Production of Wine from Selenium-Enriched Kiwifruits
HAO Yao1, WANG Tao1, LI Wen1,*, LI Tong-xiang1, YUAN Hang2
(1. Jiangsu Key Construction Laboratory of Food Resource Development and Quality Safe, Xuzhou Institute of Technology, Xuzhou 221008, China; 2. Key Laboratory of Ion Beam Bio-engineering, Chinese Academy of Sciences, Hefei 230031, China)
Ten yeast isolates were obtained through microscopic observation and screening using WL medium, and one of them was identified by carbon dioxide weight loss comparison as well as physiological and biochemical characterization and named as Y-41. The strain Y-41 was found to have a strong ability to ferment kiwifruit juice into wine with a strong fruity aroma. This strain was preliminarily identified as a member of the genus Pichia according to Yeasts: Characteristics and Identif i cation and further confirmed as Pichia kudriavzevii by molecular biology. Y-41 was highly tolerant to glucose, alcohol and pH, and could be used for wine fermentation from selenium-enriched kiwifruit juice.
selenium-enriched kiwifruit; yeast; screening; identification
Q939.96;TS05
A
1002-6630(2014)21-0175-05
10.7506/spkx1002-6630-201421034
2014-06-30
江苏省高校青蓝工程项目;江苏省食品资源开发与质量安全重点建设实验室开放课题(SPKF201311);国家大学生实践创新项目(201311998023);徐州市科技计划项目(XF13C034)
郝瑶(1992—),女,本科生,研究方向为生物工程。E-mail:1742706438@qq.com
*通信作者:李文(1982—),女,讲师,博士研究生,研究方向为应用微生物学。E-mail:wenlisony@126.com
