低氧胁迫下大豆发芽富集γ-氨基丁酸品种筛选及培养条件优化
2014-03-08王淑芳杨润强顾振新
王淑芳,杨润强,顾振新*
(南京农业大学食品科技学院,江苏 南京 2100 95)
低氧胁迫下大豆发芽富集γ-氨基丁酸品种筛选及培养条件优化
王淑芳,杨润强,顾振新*
(南京农业大学食品科技学院,江苏 南京 2100 95)
比较理想M-7、95-优1、苏青1号和YH-NJ大豆品种培养4 d后的生理生化变化情况,结果表明:YH-NJ的发芽率、芽长和呼吸强度显著高于其他品种,发芽4 d后YH-NJ的蛋白酶活力、游离氨基酸含量的增加量也显著高于其他品种,γ-氨基丁酸(γ-aminobutyric acid,GABA)产量及增加量均为最大。由此筛选出大豆YH-NJ是发芽富集GABA的良好品种。以YH-NJ为原料,在单因素试验结果的基础上,通过正交试验,得到发芽大豆富集GABA的最佳培养条件为:正常培养4 d、低氧胁迫培养48 h、培养液pH 5.0、发芽温度30 ℃。在此条件下,GABA产量达到1.97 mg/g,是随机组的1.56 倍。
大豆;发芽;γ-氨基丁酸;富集;品种筛选;条件优化;低氧胁迫
大豆发芽后,可提高蛋白质和淀粉消化率以及某些限制性氨基酸和维生素等物质含量,同时可降低或消除抗营养因子含量[1],尤其可富集对人体有生理调节功能的γ-氨基丁酸(γ-aminobutyric acid,G ABA)等物质[2]。植物正常生长条件下体内GABA产量很低,通常在0.3~32.5 μmol/g之间,但受到热激、机械损伤、低氧等逆境胁迫或植物激素作用时会提高数倍甚至数十倍[3-4],机械伤害可在1~5 min内使大豆叶片内的GABA含量提高17 倍,冷激5~15 mi n可使大豆叶片GABA含量提高19 倍。随着年龄的增大,人体内合成GABA的能力愈来愈低,不能满足生理需要。因此,提高食品中GABA产量的方法成为研究的热点。植物中,GABA合成通过谷氨酸直接脱羧和多胺降解途径,其中谷氨酸脱羧酶(glutamate decarboxylase,GAD)和二胺氧化酶(diamine oxidase,DAO)分别为关键限速酶[5]。低氧处理对发芽大豆GABA富集的影响已有报道,但是前人研究中在籽粒发芽初期采用低氧胁迫处理,严重抑制大豆芽生长,从而降低了大豆芽菜的生物量[6]。
本实验以大豆为试材,比较研究了不同品种的大豆在发芽过程中生理生化特性、蛋白质等营养成分含量变化,筛选发芽率高、GABA富集量大的品种。以此品种为试材,经减菌化处理后,正常培养4 d,使豆芽生长生物量大量累积,然后进行低氧胁迫处理,研究大豆发芽条件对其蛋白质、氨基酸和GABA含量变化,之后以GABA为指标通过正交试验,优化出最适富集条件。
1 材料与方法
1.1 材料
大豆:供试的大豆品种有理想M-7、95-优1、苏青1号和YH-NJ(表1),购自江苏省农业科学院;所有大豆籽粒均采收于2013年,置于-20 ℃条件下贮存,备用。

表1 大豆品种编号、特性及产区Table1 Description of soybean cultivars
1.2 试剂与仪器
GABA标 准品(纯度≥99%) 美国Sigma公司;亮氨酸、考马斯亮蓝G-250、茚三酮 国药集团(上海)化学试剂公司;牛血清白蛋白(bovine serum albumin,BSA) 上海蓝季科技发展有限公司;三乙胺 成都市科龙化工试剂厂;乙腈 上海陆都化学试剂厂。
Orion818型pH测试仪 美国Orion Research公司;755B型分光光度计 上海精密科学仪器有限公司;Agilent 1200液相色谱仪 安捷伦公司;TDL-40B离心机上海安亭科学仪器厂;PYX-DHS-BS型隔水电热恒温培养箱 上海跃进医疗器械厂。
1.3 籽粒发芽
取30 g不同品种大豆籽粒,用1%的次氯酸钠水溶液浸泡消毒15 min,去离子水冲洗至pH值中性,于30 ℃黑暗条件下浸泡6 h。浸泡后的籽粒置于24 ℃、相对湿度85%的发芽机中,以水为培养液发芽。培养4 d后,用去离子水清洗发芽籽粒并吸干表面水分,测定发芽率、芽长、呼吸速率和蛋白酶活性。鲜样干燥后粉碎过筛,测定可溶性蛋白、游离氨基酸含量等。
1.4 试验设计
将30 ℃条件下发芽4 d后的大豆芽菜置于具塞培养瓶(d 5 cm×18.5 cm)中低氧胁迫条件下(通气量为0.9 L/min)培养,以柠檬酸-柠檬酸钠缓冲溶液(10 mmol/L)作为培养液,培养期间,每隔12 h更换1 次培养液,直至培养结束。
1.4.1 单因素试验
低氧胁迫下大豆发芽富集GABA,待确定的培养条件有培养液pH值、发芽温度和发芽时间。限定培 养液pH值范围为3.0~6.5,发芽温度为22~38 ℃,发芽时间为0~72 h,进行单因素试验。
1.4.2 培养条件优化试验
在单因素试验的基础上,以低氧胁迫条件下培养液pH值、培养温度与时间为考察因素,以GABA含量为指标,进行正交试验。
1.5 测定指标与方法
发芽率:按照国家标准GB/T 5520—85《粮食、油料检验 种子发芽试验》测定;芽长:采用游标卡尺测量,每30 粒发芽大豆作为一个样本;呼吸速率:采用小篮子法测定[7];蛋白酶活力:参照文献[8]方法测定,以鲜质量计;水分含量:用105 ℃恒质量法测定;可溶性蛋白含量:采用考马斯亮蓝法测定,以BSA为标准蛋白[7];游离氨基酸:采用茚三酮溶液显色法测定,以亮氨酸为标准[7];GABA产量:参照Bai Qingyun等[9]的方法测定,以干质量计。
1.6 数据处理与统计分析
每组实验设3 次重复,结果以±s表示,数据采用SAS 9.0软件进行统计分析,设置显著性水平为P<0.05。
2 结果与分析
2.1 大豆品种筛选

表2 大豆发芽过程中主要生理生化指标变 化Table2 Changes in primary physiological and biochemical indexes during soybean germination
发芽率、芽长、呼吸速率及蛋白酶活力反映了大豆的生长状况。由表2可知,YH-NJ在发芽4 d后发芽率显著高于其他品种,比发芽率最低的苏青1号高28.84%。发芽4 d后各品种大豆芽长均大于10 cm,且YH-NJ最长,苏青1号最短。YH-NJ呼吸速率是理想M-7和苏青1号的1.79 倍、95-优1的1.48 倍。供试各品种大豆发芽后蛋白酶活力均显著增强,其中YH-NJ的蛋白酶活力增加量最大,达到310.01 U/g,其次为理想M-7、95-优1和苏青1号。由此可见,YH-NJ的生命活动代谢最为旺盛。
由表3可知,供试各大豆品种在发芽4 d后含水量均达到较高值,YH-NJ、理想M-7、95-优1和苏青1号分别为86.91%、82.45%、81.61%和79.18%。可溶性蛋白在发芽前后变化不同,理想M-7、95-优1和苏青1号在发芽4 d后可溶性蛋白含量均高于其未发芽大豆,而YH-NJ则在发芽4 d后比未发芽的可溶性蛋白含量减少了9.37 mg/g。由此可见,大豆发芽过程中可溶性蛋白既有合成也有分解。发芽4 d后,各品种游离氨基酸含量明显增加,其增加量以YH-NJ最高,达到9.39 mg/g;同时,发芽后YH-NJ的游离氨基酸含量也显著高于其他品种,比发芽后95-优1中高5.62 mg/g。在发芽0 d时,各品种GABA产量均较低,在发芽4 d后均有显著提高,其中YH-NJ发芽后GABA产量是发芽前的29.17 倍,达到840.81 øg/g,这也显著高于其他品种发芽后的含量。表明发芽过程有利于大豆体内GABA的积累。综上所述,4 个品种大豆在培养4 d后,YH-NJ的发芽率、芽长和呼吸强度显著高于其他品种。与原料相比,发芽4 d后YH-NJ的蛋白酶活力、游离氨基酸含量的增加量也显著高于其他品种,GABA产量及增加量均为最大。因此,YH-NJ是大豆发芽富集GABA的良好品种。
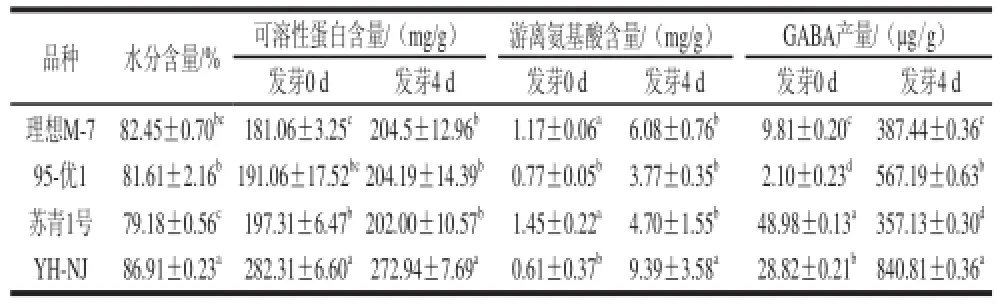
表3 大豆发芽过程中水和主要含氮物质含量变化Table3 Change in nitrogenous components during soybean germination
2.2 培养条件优化
2.2.1 培养液pH值的选择

表4 培养液pH值对大豆芽菜GABA富集的影响Table4 Effect of pH of buffer solution on GABA accumulation in germinating soybean
由表4可知,在培养液pH值为3.0~6.5时,大豆芽长无显著差别,这表明培养液pH值对大豆芽长无显著影响。可溶性蛋白含量随培养液pH值的增加呈先降低后增加再降低的趋势,在pH 3.0和pH 5.5时可溶性蛋白含量较高,在pH 4.0时含量最低,仅为39.87 mg/g。游离氨基酸含量在pH 3.0~6.5之间呈先增大后减小的变化趋势,在pH 4.5时达到最大值30.69 mg/g,显著高于其他pH值条件下的含量。不同培养液pH值对GABA富集的影响不同,低pH 3.0~4.0对GABA的积累有抑制作用,而高pH 6.0~6.5也不利于GABA的富集。当培养液pH值为5.0时,发芽大豆GABA产量最高(1 580 μg/g)。因此,确定低氧胁迫下大豆发芽富集GABA培养液pH值为5.0。
2.2.2 发芽温度的选择
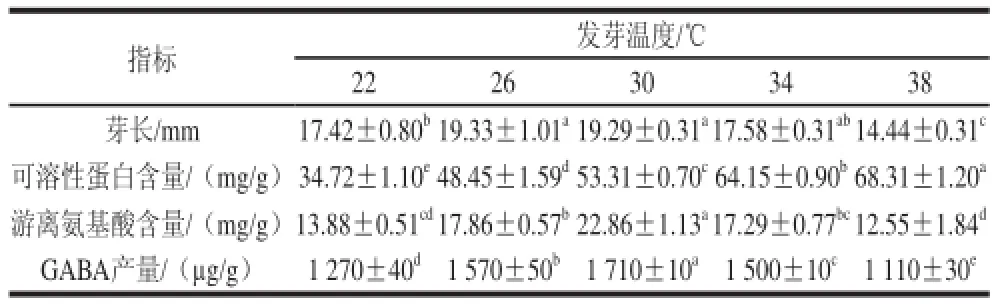
表5 低氧发芽温度对大豆芽菜GABA富集的影响Table5 Effect of germination temperature on GABA accumulation in germinating soybean
由表5可知,随发芽温度的升高,发芽大豆芽长呈现先增高后降低的趋势,在38℃时大豆芽长最短,表明34℃以上的高温条件并不适合大豆生长。在发芽温度为22~38℃之间时,可溶性蛋白含量呈上升趋势,在38℃时含量最多,是22℃时的1.97倍。表明发芽温度的升高,有利于可溶性蛋白的积累。GABA产量变化与游离氨基酸相似,均随发芽温度的升高呈现先升高后降低的趋势,在30℃时,GABA产量也达到最大值,而在38℃时其产量最低。表明GABA产量变化和游离氨基酸含量变化基本一致。
2.2.3 发芽时间的选择
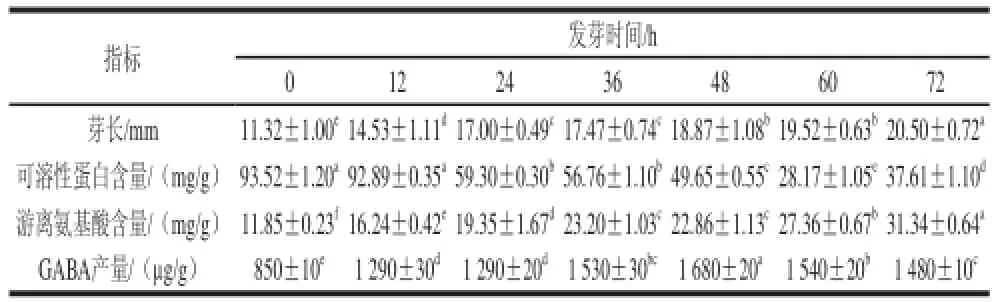
表6 发芽时间对大豆芽菜GABA富集的影响Table6 Effect of germination time on GABA accumulation in germinating soybean
由表6可知,随大豆发芽时间的延长其芽长逐渐增长,在72 h时值最大;同时,随着芽长的不断增长,大豆芽菜腐败和褐变现象也逐渐明显。在大豆生命活动中可溶性蛋白是一个合成代谢与分解代谢共同进行的过程,在发芽0~60 h过程中逐渐降低,60 h时可溶性蛋白含量仅为发芽0 h的30%,而72 h含量又变为增加,表明在发芽60 h前,大豆分解代谢大于合成代谢,而60 h后合成代谢大于分解代谢。随发芽时间的延长,大豆芽菜中游离氨基酸含量逐渐增加。发芽72 h时游离氨基酸含量分别为发芽0、24、48 h的2.65、1.62、1.37 倍。表明增加发芽时间,更多的大分子蛋白质逐渐分解为氨基酸等小分子物质。GABA产量在发芽0~72 h呈现先升高后降低的趋势,在发芽48 h时达到最大值,是发芽0 h的1.98 倍,是未发芽大豆的58.35 倍。表明低氧胁迫下发芽48 h有利于GABA的富集。
2.2.4 培养条件优化
2.2.4.1 正交试验设计及结果
以GABA产量为指标,选择影响大豆发芽富集GABA的主要因素,培养液pH值、发芽温度和发芽时间,进行三因素三水平正交试验。

表7 正交试验结果及分析Table7 Orthogonal array design results and analysis
由表7可知,极差分析表明培养液pH值、发芽温度和发芽时间三因素对大豆发芽富集GABA影响大小顺序依次为发芽时间>培养液pH值>发芽温度。大豆发芽富集GABA最适培养条件为:培养液pH 5.0、发芽温度30 ℃、发芽时间48 h。

表8 正交试验结果方差分析Table8 Analysis of variance
由方差分析(表8)可知,培养液pH值和发芽时间对GABA产量影响显著(P<0.05),发芽温度对GABA积累的影响极显著(P<0.10)。
2.2.4.2 验证实验结果
根据正交试验结果,分析得到发芽大豆富集GABA的最佳培养条件为:发芽机中正常培养4 d,再低氧胁迫培养48 h,培养液pH 5.0,发芽温度30 ℃。为了验证实验结果的准确性,在正交试验设计的各因素范围之内,随机选择一组试验组合(发芽机中正常培养4 d,再低氧胁迫培养60 h,培养液pH 4.5,发芽温度34 ℃),与正交试验所得最佳试验组合进行验证实验。最佳组合在芽长、游离氨基酸和GABA产量上均高于随机组合,其中GABA产量也高于正交试验中的最高含量(1.88 mg/g)。验证实验结果进一步证明试验结果是可靠的。
3 讨论与结论
籽粒萌发时,酶系统形成及激活,贮藏物质降解,为呼吸等生理活动提供底物,表现为籽粒内物质组成和含量发生变化。薛云皓等[10]研究得出,玉米发芽期间可溶性蛋白质含量逐渐增加。糙米随着发芽时间的延长,可溶性蛋白含量先增加后减少,游离氨基酸含量增加,增加的可溶性蛋白来自于贮藏蛋白的水解和新蛋白合成[11]。本实验结果表明,大豆发芽4 d后,不同品种大豆发芽率、含水量、呼吸速率呈显著差异,蛋白酶活力升高,可溶性蛋白降低,游离氨基酸含量升高。YH-NJ的生命活动最为旺盛,蛋白酶活力变化大,可溶性蛋白含量高,游离氨基酸合成量多。
籽粒发芽过程中,蛋白酶活性增强,使难溶的蛋白水解为易溶的小分子蛋白、肽或氨基酸,再将氨基酸运转到胚的生长部位,然后以不同的方式加以利用,使氨基酸含量和比例以及蛋白质组成发生变化,此时对人体的营养价值大为提高[1]。GABA作为一种功能性氨基酸,在发芽过程中得到了积累。发芽显著地提高了糙米的GABA产量[12]。房克敏等[13]研究了16 个品种稻米,测定其GABA产量,结果表明发芽后糙米GABA产量显著增加,也证实了糙米品种对发芽后GABA产量变化有很大影响。本实验结果表明,发芽能够增加大豆体内GABA产量,但不同品种大豆间GABA增幅存在差异,YH-NJ增幅量最大,最适宜作为富GABA大豆芽菜食品原料。
植物体内可溶性蛋白和游离氨基酸含量是反映植物代谢情况较为敏感的指标[14]。卢太白等[15]发现,小麦在低温胁迫下的生长状况与游离氨基酸的积累正相关。不同条件下大豆芽菜可溶性蛋白与游离氨基酸含量不同反应了其体内代谢情况不同。
温度影响籽粒发芽,还影响酶蛋白质构象、酶与激活剂的亲和力及参与酶促反应功能团的解离等[16]。大多数植物GAD的最适温度范围在35~40 ℃,DAO最适温度为40 ℃[16-17]。糙米发芽期间随温度升高GAD活性被激活,GABA得到积累[18]。通常植物中GAD的最适反应pH值在5.5~6.0之间,DAO的最适反应pH值在6.5左右,表明植物体内GAD在酸性环境下活性高。由于植物体内L-Glu脱羧,造成反应体系pH值升高,偏离了GAD的最适pH值,使GABA富集速率下降[19-20]。Bai Qingyun等[9]研究表明,粟谷富集GABA的最适pH值为5.8,与GAD的最适pH值相近。李岩等[21]则采用pH 3.19的柠檬酸-磷酸缓冲液富集蚕豆GABA。Carroll等[22]的实验表明,酸性环境激活了胡萝卜细胞的GAD活性,导致GABA积累,当胞质pH值恢复正常后GAD活性降低,这些实验为植物细胞质pH值变化影响GABA合成提供了证据。本研究筛选出大豆芽菜富集GABA的最优温度为30 ℃,低于最适温度,是因为大豆发芽是生命活动的过程,过高温度不利生长;最适pH值为5.0,表明植物在微酸性环境下GAD活性提高。
大豆籽粒发芽4 d后,YH-NJ的发芽率、芽长和呼吸强度显著高于理想M-7、95-优1和苏青1号品种。发芽4 d后YH-NJ的蛋白酶活力,游离氨基酸增加量也显著高于其他品种,GABA增加量为最大。YH-NJ是大豆发芽富集GABA的合适品种。大豆富集GABA的最佳培养条件为:正常培养4 d后,低氧胁迫培养48 h,培养液pH 5.0,发芽温度30 ℃。在此条件下,GABA产量达到1.97 mg/g,是随机组的1.56 倍。
[1] BAU H M, VILLAUME C, NICOLAS J P, et al. Effect of germination on chemical composition, biochemical constituents and antinutritional factors of soya bean (Glycine max) seeds[J]. Journal of the Science of Food and Agriculture, 1997, 73(1): 1-9.
[2] YIN Yongqi, YANG Runqiang, GU Zhenxin. NaCl stress and supplemental CaCl2regulating GABA metabolism pathways in germinating soybean[J]. European Food Research and Technology, 2014, 238(5): 781-788.
[3] SHELP B J, BOWN A W, MCLEAN M D. Metabolism and functions of gamma-aminobutyric acid[J]. Trends in Plant Science, 1999, 4(11): 446-452.
[4] 穆小民, 沈黎明, 吴显荣. 高等植物体内γ-氨基丁酸代谢的酶学研究进展[J]. 中国农业大学学报, 1996, 1(1): 28-33.
[5] SHELP B J, BOZZO G G, TROBACHER C P, et al. Hypothesis/ review: contribution of putrescine to 4-aminobutyrate (GABA) production in response to abiotic stress[J]. Plant Science, 2012, 193-194: 130-135.
[6] GUO Yuanxin, YANG Runqiang, CHEN Hui, et al. Accumulation of γ-aminobutyric acid in germinated soybean (Glycine max L.) in relation to glutamate decarboxylase and diamine oxidase activity induced by additives under hypoxia[J]. European Food Research and Technology, 2012, 234(4): 679-687.
[7] 李合生. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社, 2000.
[8] LI Cuijuan, CAO Xiaohong, GU Zhenxin, et al. A preliminary study of the protease activities in germinating brown rice (Oryza sativa L.)[J]. Journal of the Science of Fo od and Agriculture, 2011, 91(5): 915-920.
[9] BAI Qingyun, FAN Gongjian, GU Zhenxin, et al. Effects of culture conditions on γ-aminobutyric acid accumulation during germination of foxtail millet (Setaria italica L.)[J]. European Food Research and T echnology, 2008, 228(2): 169-175.
[10] 薛云皓, 仵红梅, 王爱月, 等. 玉米发芽前后的营养变化[J]. 河南医学研究, 2001, 3(1): 5-7.
[11] 郑艺梅, 何瑞国, 郑琳, 等. 糙米发芽过程中营养成分及植酸含量变化的研究[J]. 中国粮油学报, 2006, 21(5): 1-4.
[12] 孙向东, 任红波, 姚鑫淼. 糙米发芽期间生理活性成 分γ-氨基丁酸变化规律研究[J]. 粮油加工与食品机械, 2006(1): 63-68.
[13] 房克敏, 李再贵, 袁汉成, 等. HPLC 法测定发芽糙米中γ-氨基丁酸含量[J]. 食品科学, 2006, 27(4): 208-211.
[14] 高洪波. 根际低氧胁迫下网 纹甜瓜幼苗生理代谢的特征及Ca2+、GABA生理调节功能[D]. 南京: 南京农业大学, 2005.
[15] 卢太白, 吕金印, 陆和平, 等. 越冬及返青期冬小麦叶片中可溶性蛋白质, 氨基酸含量与抗寒性的关系[J]. 西北农业学报, 2009, 18(1): 55-59.
[16] ZHANG Hui, YAO Huiyuan, CHEN Feng, et al. Purification and characterization of glutamate decarboxylase from rice germ[J]. Food Chemistry, 2007, 101(4): 1670-1676.
[17] SAT YANARAYAN V, NAIR P M. Purification and characterization of glutamate decarboxylase from Solanum tuberosum[J]. European Journal of Biochemistry, 1985, 150(1): 53-60.
[18] 郑艺梅. 发芽糙米营养特性, γ-氨基丁酸富集及生理功效的研究[D].武汉: 华中农业大学, 2006.
[19] UENO H. Enzymatic and structural aspects on glutamate decarboxyl ase[J]. Journal of Molecular Catalysis B: Enzymatic, 2000, 10(1): 67-79.
[20] JOHNSON B S, SINGH N K, CHERRY J H, et al. Purification and characterization of glutamate decarboxylase from cowpea[J]. Phytochemistry, 1997, 46(1): 39-44.
[21] LI Yan, BAI Qingyun, JIN Xinjiang, et al. Effe cts of cultivar and culture conditions on γ-aminobutyric acid accumulation in germinated fava beans (Vicia faba L.)[J]. Journal of the Science of Food and Agriculture, 2010, 90(1): 52-57.
[22] CARROLL A D, FOX G G, LAURIE S, et al. Ammonium assimilation and the role of [gamma]-aminobutyric acid in pH homeostasis in carrot cell sus pensions[J]. Plant Physiology, 1994, 106(2): 513-520.
Cultivar Selection and Culture Condition Optimization for γ-Amino Butyric Acid (GABA) Accumulation in Germinating Soybean under Hypoxia Stress
WANG Shu-fang, YANG Run-qiang, GU Zhen-xin*
(College of Food Science and Technology, Nanjing Agricultural University, Nanjing 210095, China)
After 4-day germination, t he germination percentage, sprout length and respiratory rate of the soybean cultivar YH-NJ were higher than those of all other cultivars tested. The increment of soluble protein, free amino acids and protease activity in YH-NJ sprouts were higher than those of the other cul tivars. The content of (GABA) was increased and its level in YH-NJ sprouts was the highest. Thus, the cultivar YH-NJ was selected for GABA accumulation in further experiments. Using orthogonal design method, the optimal culture conditions for GABA accumulation in 4-day germinated YH-NJ sprouts were determined as germination in a culture solution at pH 5.0 for another 48 h under hypoxia stress at 30 ℃. Under these conditions, the content of GABA was 1.97 mg/g DW, which was 1.56 times higher than the contro l.
soybean; germination; γ-aminobutyric acid (GABA); accumulation; cultivar selection; condition optimization; hypoxia stress
TS214.2
A
1002-6630(2014)21-0159-05
10.7506/spkx1002-6630-201421031
2014-06-03
国家自然科学基金青年科学基金项目(31401614);江苏高校优势学科建设工程资助项目
王淑芳(1989—),女,硕士研究生,研究方向为食品中功能成分的富集技术。E-mail:2013808120@njau.edu.cn
*通信作者:顾振新(1956—),男,教授,博士,研究方向为生物技术与功能食品。E-mail:guzx@njau.edu.cn
