超高效液相色谱-质谱法测定豆芽 中多菌灵、2,4-二氯苯氧乙酸、恩诺沙星残留
2014-03-08曾绍东魏晓奕王明月李积华程盛华
丁 丽,曾绍东,魏晓奕,王明月,李积华,*,程盛华
(1.中国热带农业科学院农产品加工研究所,广东 湛江 524001;2.农业部农产品加工质量安全风险评估实验室, 广东 湛江 524001)
超高效液相色谱-质谱法测定豆芽 中多菌灵、2,4-二氯苯氧乙酸、恩诺沙星残留
丁 丽1,2,曾绍东2,魏晓奕1,王明月2,李积华1,*,程盛华1,2
(1.中国热带农业科学院农产品加工研究所,广东 湛江 524001;2.农业部农产品加工质量安全风险评估实验室, 广东 湛江 524001)
建立豆芽中多菌灵、2,4-二氯苯氧乙酸(2,4-dichlorophenoxyacetic acid,2,4-D)、恩诺沙星残留检测的超高效液相色谱-质谱的分析方法。样品经酸化乙腈提取,浓缩后经WAX小柱净化,采用Waters C18色谱柱分离,以甲醇和0.1%甲酸溶液为流动相进行梯度洗脱,采用电喷雾-正负离子多反应监测模式,外标法定量。在5~150 μg/L的质量浓度范围内,各种添加剂相关系数均大于0.999 0,该方法的检出限在0.5 μg/kg之间,定量限在1.5 μg/kg之间。添加5.0、10.0 μg/kg和25.0 μg/kg三个不同水平时,多菌灵、2,4-D、恩诺沙星的回收率在80.4%~97.8%之间,日内和日间相对标准偏差在1.25%~5.47%之间。该方法简单、灵敏度高、分析时间短,适用于多菌灵、2,4-D、恩诺沙星的测定。
超高效液相色谱-质谱;多菌灵;2,4-D;恩诺沙星;残留;豆芽
豆芽又叫“活体蔬菜”、如意菜,是老百姓餐桌上最普通不过的蔬菜,其品种繁多、营养全面、风味独特、清香脆嫩,深受人们喜爱。豆芽的正常生产周期一般为4~5 d左右,一些不法商贩为了提高豆芽产量和缩短生产周期,会在 豆芽上喷洒非法添加剂进行催生,被催生的豆芽一般只需2 d便可出售,使用这种添加剂的豆芽胚轴会长得又长、又白、又嫩,极少有胚根的生发,卖相较好。近期全国正在开展关 于打击“毒豆芽”食品安全整顿行动,“毒豆芽”危害非常大,可以导致儿童发育早熟、女性生理改变、老年人骨质疏松等,对人体有致癌、致畸形的作用,即使有些危害不会在短时间内出现,但是长久沉积必然会给健康带来不利影响[1-8]。多菌灵、2,4-二氯苯氧乙酸(2,4-dichlorophenoxyacetic acid,2,4-D)、恩诺沙星在豆芽生产中作用各不相同:多菌灵可以杀死豆芽中的霉菌、细菌;2,4-D处理绿豆下胚轴可以促进细胞恢复分裂能力,诱导根源发生,促进不定根的生长;恩诺沙星是一种受孕的抗生素,使豆芽很白很嫩,主要是保鲜[9-14]。目前关于多菌灵、2,4-D、恩诺沙星的检测方法及标准主要为气相色谱法[15-19]、液相色谱法[20-24]、气相色谱-质谱联用法。气相色谱和气相色谱-质谱联用需要对2,4-D进行衍生;液相色谱检测方法干扰严重,以保留时间进行定性,易出现假阳性。虽然有少量文献报道了豆芽中添加剂的检测方法,但多组分添加剂的国家检测标准尚未建立,因此,选择合适的提取方法和分析手段解决多组分添加剂的同时测定尤为重要。液相色谱-质谱具有高灵敏度和高选择性的优势增加了定性和定量的可靠性,是近年来常用的色谱检测手段[25-41]。应用液相色谱-质谱技术测定豆芽中的添加剂,不仅可以实现多种添加剂的同时测定,而且可以对其结构进行确证。
本实验采用超高效液相色谱-质谱(ultra performance liquid chromatography-tandem mass spectrometry,UPLCMS-MS)技术对豆芽中多菌灵、2,4-D、恩诺沙星同时进行分析测定。对前处理技术、仪器条件和方法学作了相关探讨研究,应用该技术分析豆芽中多种组分多菌灵、2,4-D、恩诺沙星残留,具有简单、灵敏度高、选择性好、分析时间短、回收率高等优点,完全满足日常检测的需求。
1 材料与方法
1.1 材料与试剂
绿豆芽、黄豆芽、黑豆芽、豌豆芽均为市售,基质豆芽为优质黄豆实验室不加添加剂培养。
多菌灵(纯度≥99.0%)、恩诺沙星(纯度≥98.5%)标准品 德国Dr Ehrenstorfer公司;2,4-D标准品(纯度≥99.9%) 德国Riedel-deHaen公司;甲醇、乙腈、甲酸、乙酸(均为色谱纯) 美国Fisher公司;水为Milli-Q系统纯化水;氯化钠(分析纯) 广州试剂厂;酸化乙腈(V(乙酸)∶V(乙腈)=1∶100)。
标准储备溶液的配制:分别准确称取10 mg多菌灵、2,4-D、恩诺沙星标准品于10 mL棕色容量瓶中,用甲醇定容,配制成1 mg/mL的储备液,密封储存于-20 ℃冰箱中。
混合标准中间溶液:分别吸取1 mg/mL的多菌灵、2,4-D、恩诺沙星标准溶液50 μL于10 mL棕色容量瓶中,用甲醇定容,配制成5 μg/mL的混合标准溶液,密封储存于-20 ℃冰箱中。
上机混合标准溶液:用流动相或者空白基质配制系列上机质量浓度,现配现用。
1.2 仪器与设备
AcquityTM超高效液相色谱仪和XevoTMTQ-MS质谱仪(配有电喷雾电离(electrospray ionization,ESI)接口及Masslynx数据处理系统)、固相萃取装置 美国Waters公司;MilliQ超纯水器 美国Millipore公司;高速离心机 日本Hitachi公司;电子天平 日本Shimadzu公司;N-Evap112氮气吹干仪;IKA MS3涡旋混合器;IKA T25分散均浆机。
1.3 方法
1.3.1 色谱条件
色谱柱:Waters ACQUITY UPLC BEH C18柱(2.1 mm×100 mm,1.7 μm);柱温:35 ℃;样品温度:25 ℃;进样体积:5 μL;流速:0.3mL/min;流动相:甲醇(A),0.1%甲酸溶液(B);洗脱程序:0~0.6 min,65%~30% B,0.6~2.5 min,30%~20% B,2.5~3.5 min,20%~50% B,3.6~3.8 min,50%~65% B,3.8~4.0 min,65%~65% B。
1.3.2 质谱条件
离子源:ESI;扫描方式:2,4-D负离子模式,多菌灵、恩诺沙星正离子模式;检测方式:多反应监测(multiple reaction monitoring,MRM);毛细管电压:2.50 kV;离子源温度:150 ℃;脱溶剂气温度:500 ℃;脱溶剂气流量:1 000 L/h。
1.3.3 前处理方法
1.3.3.1 提取
称取10 g粉碎试样于50 mL离心管中,加入15 mL酸化乙腈(V(乙酸)∶V(乙腈)=1∶100)提取液,用均质机以10 000 r/min均质2 min,然后在4 ℃、8 000 r/min离心10 min,离心后取出上清液,再加入10 mL 酸化乙腈(V(乙酸)∶V(乙腈)=1∶100)提取液,涡旋3 min,重复上述操作,合并提取液,加入7 g NaCl,涡旋3 min,静置30 min,分离上层有机相于50 mL烧杯中,在45 ℃条件下氮吹至近干,加5 mL水溶解残渣,涡旋。
1.3.3.2 净化
WAX柱用3 mL甲醇、3 mL水活化,将上述5 mL溶解液上样,依次用3 mL水和3 mL 2%的甲酸溶液淋洗,抽至近干后,分别3.0 mL 5%的氨水-甲醇溶液洗脱,于45 ℃条件下氮吹至干,再加1 mL 0.1%甲酸-甲醇溶液溶解,涡旋混合1 min,过0.22 μm微孔滤膜后,于UPLC-MS-MS仪上分析。
2 结果与分析
2.1 萃取溶剂的选择
为使各种豆芽有较好的提取效率,分别采用乙腈、甲醇、丙酮、二氯甲烷、酸化乙腈(V(乙酸)∶V(乙腈)=1∶100)作为萃取溶剂,其中丙酮、二氯甲烷提取杂质较多,对环境污染大,特别是二氯甲烷,尽量减少使用;乙腈、甲醇对2,4-D提取回收率只有60%,乙酸-乙腈溶液的提取效果较好,当乙酸-乙腈的体积比为1∶100时,干扰物质少,回收率高,因而采取酸化乙腈(V(乙酸)∶V(乙腈)=1∶100)溶液作为萃取溶剂。
2.2 提取条件的选择
本实验比较超声波、涡旋、均质3 种不同的提取方式,通过回收率和实际样品验证,3 种方式最优条件下的回收率差别不大,但实际样品中阳性含量有一定的差别,均质方式测定豆芽中的多菌灵含量最高,分析原因,可能是添加药物未渗透到样品中,直接提取回收率影响不大,但是豆芽在生长过程中添加药物,通过代谢进入到组织,还有可能以不同化合物形态存在,均质在10 000 r/min时能够破碎组织中的细胞,使得药物能过被充分提取。在一定量的提取溶剂情况下,少量多次提取效果比一次性加入溶剂提取,提取药物效果要好很多,对恩诺沙星药物尤为明显。
2.3 净化条件的选择
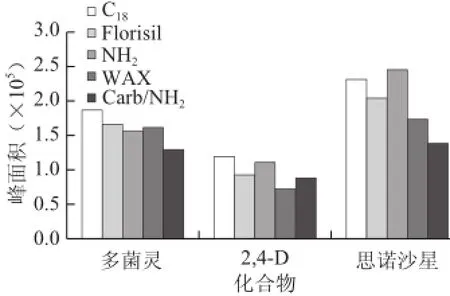
图1 5 种固相萃取小柱的净化效果比较Fig.1 Comparison of the effectiveness of 5 different solid-phase extraction cartridges
由于净化效果对基质效应具有较大的影响,为了获得较好的净化效果,本实验分别选用C18、Florisil、NH2、WAX、Carb/NH2五种类型的固相萃取小柱,分别考察净化效果和保留行为,由多菌灵、2,4-D、恩诺沙星在不同固相萃取小柱上的净化效果(图2)可知,WAX固相萃取小柱对多菌灵、2,4-D、恩诺沙星具有较好的吸附作用,净化效果较好,从多菌灵、2,4-D、恩诺沙星的综合保留与净化效果来看,WAX固相萃取小柱比其他4 类固相萃取小柱更适合于多菌灵、2,4-D、恩诺沙星的保留与净化,所以选择WAX固相萃取小柱进行净化。
2.4 色谱条件的优化
高效的色谱柱是多组分分析的前提条件,本实验比较选用Waters ACQUITY UPLC BEH C18(2.1 mm×100 mm,1.7 μm)色谱柱分离多菌灵、2,4-D、恩诺沙星,此色谱柱对各化合物具有较强地保留,各色谱峰峰形较好,并得到了有效地分离,减少了杂质的干扰。
分别选择甲醇和乙腈作为强洗脱流动相。实验证明:当甲醇作流动相时,离子化受到不同程度的抑制,丰度明显降低,导致灵敏度下降,而甲醇的离子化效率明显优于乙腈,故本实验采用甲醇强洗脱流动相。在流动相中加入 甲酸能增加2,4-D在ESI-模式下的离子化效率,改善2,4-D的峰形,而且甲酸的加入明显地提高了洗脱效果,加快出峰时间。本实验分别配制0、0.1%、0.5%的甲酸溶液作为流动相,经实验表明0.1%的甲酸溶液体系能提供最佳离子化条件,峰面积信号最强,灵敏度最高。图2为多菌灵、2,4-D、恩诺沙星混合标准溶液、空白样品和加标样品的MRM色谱图。
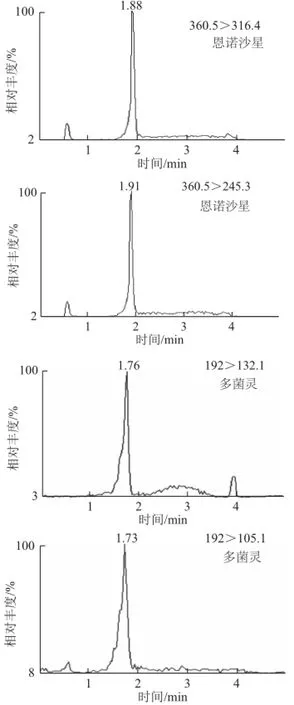
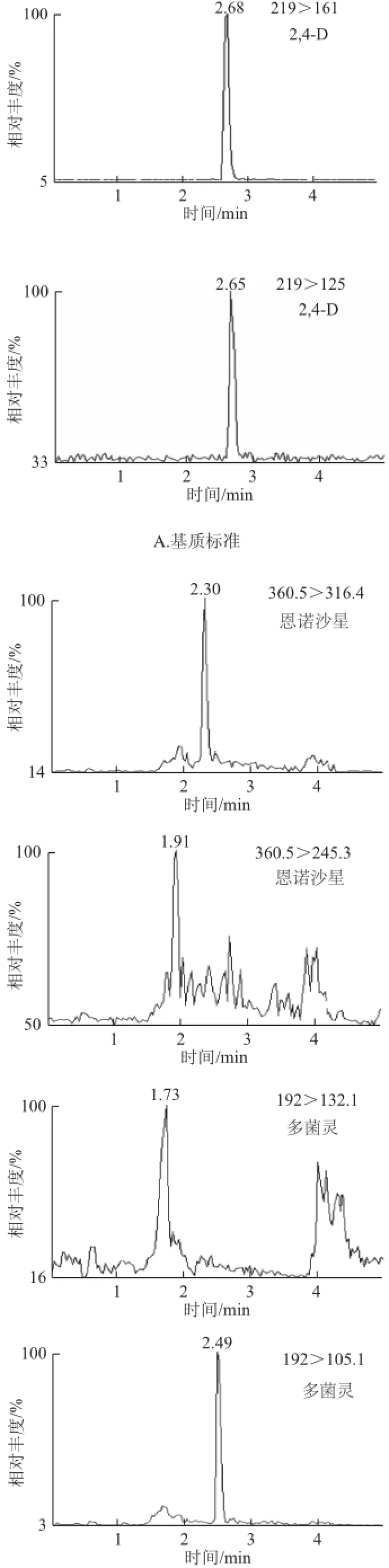
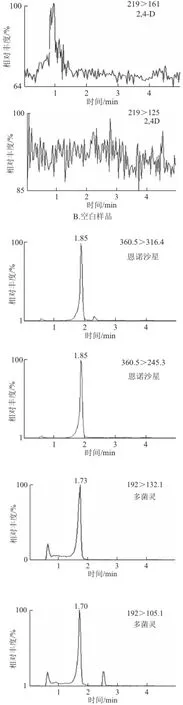
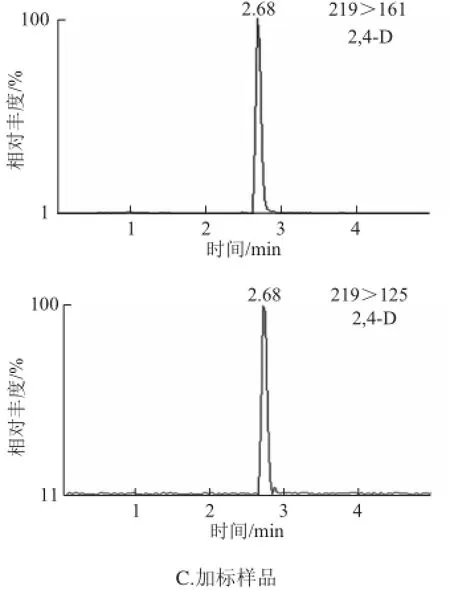
图2 50 μg/L多菌灵、2,4-D、恩诺沙星的MRM色谱图Fig.2 MRM chromatograms of 50 μg/L carbendazim, 2,4-D and enrofloxacin
2.5 质谱条件的优化
在电喷雾质谱、正负离子监测模式下,分别对毛细管电压、锥孔电压、碰撞能量和选择离子等进行了充分的优化,选取经碰撞后所得丰度较高的两个子离子作为定量和定性离子,并确定最佳碰撞能量的电压值。最终所选择确定的母离子、子离子和碰撞能量等参数见表1。
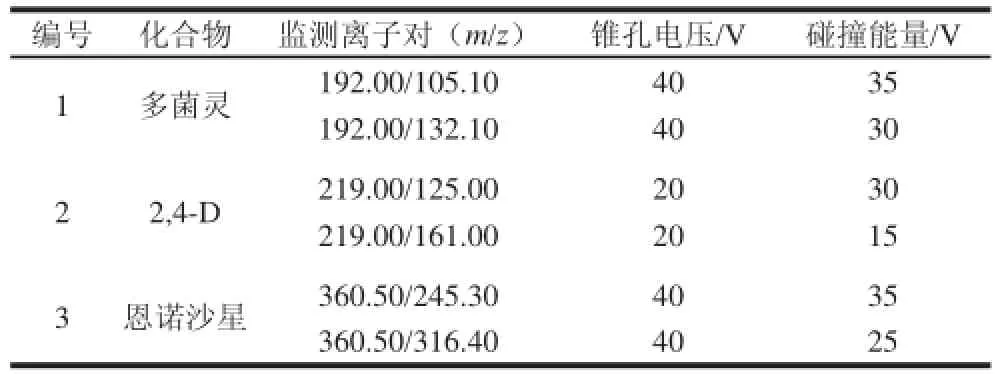
表1 多菌灵、2,4-D、恩诺沙星的质谱分析参数Table 1 LC-MS-MS parameters for carbendazim, 2,4-D, and enrofloxacin
2.6 方法学验证
2.6.1 线性范围和检出限
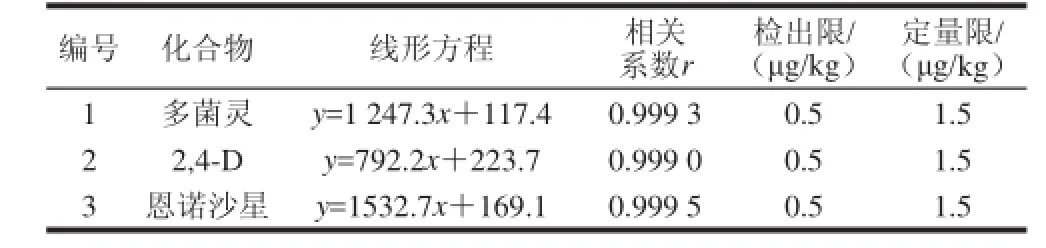
表2 多菌灵、2,4-D、恩诺沙星的线性方程、相关系数、检出限和定量限Table 2 Linear equations, correlation coefficients, LOD and LOQ of carbendazim, 2,4-D and enrofloxacin
取质量浓度分别为0、5、10、20、50、100、150 μg/L一系列基质标准溶液,以峰面积(y)对相应的质量浓度(x)作图,得标准曲线,并求出相应的线性回归方程及相关系数,结果见表2。结果表明:多菌灵、2,4-D、恩诺沙星在5~150 μg/L的质量浓度范围内具有良好的线性关系,相关系数r均在0.999 0以上。按信噪比为3的条件下得到样品中多菌灵、2,4-D、恩诺沙星的检出限为0.5 μg/kg。按信噪比为3的条件下得到样品中多菌灵、2,4-D、恩诺沙星的定量限为1.5 μg/kg。
2.6.2 精密度和稳定性实验
在阴性的黄豆芽样品中添加10 μg/kg的多菌灵、2,4-D、恩诺沙星标准溶液 ,按1.3.3节方法进行预处理,平行操作7 次,以黄豆芽基质配制标准溶液进行校正分析,结果见表3,按日内精密度的预处理 方法,多菌灵、2,4-D、恩诺沙星的相对标准偏差(relative standard deviation,RSD)范围为1.25%~2.10%。按日间精密度的预处理方法,每天取样1份,连续7 d测定,多菌灵、2,4-D、恩诺沙星的RSD范围为3.16%~5.47%,结果表明,该实验重复性较好。

表3 多菌灵、2,4-D、恩诺沙星的精密度结果Table 3 Precision (RSD) of the UPLC-MS-MS method %
2.6.3 回收率实验
分别在阴性的黄豆芽、绿豆芽、黑豆芽和豌豆芽样品基质中添加5、10、25 μg/kg三种不同水平的多菌灵、2,4-D、恩诺沙星标准溶液,以各种样品基质配制标准溶液进行校正分析,按1.3.3节方法进行预处理,回收率见表4。结果表明:多菌灵回收率在85.5%~93.1%,2,4-D回收率在80.4%~88.6%,恩诺沙星回收率在88.6%~97.8%。
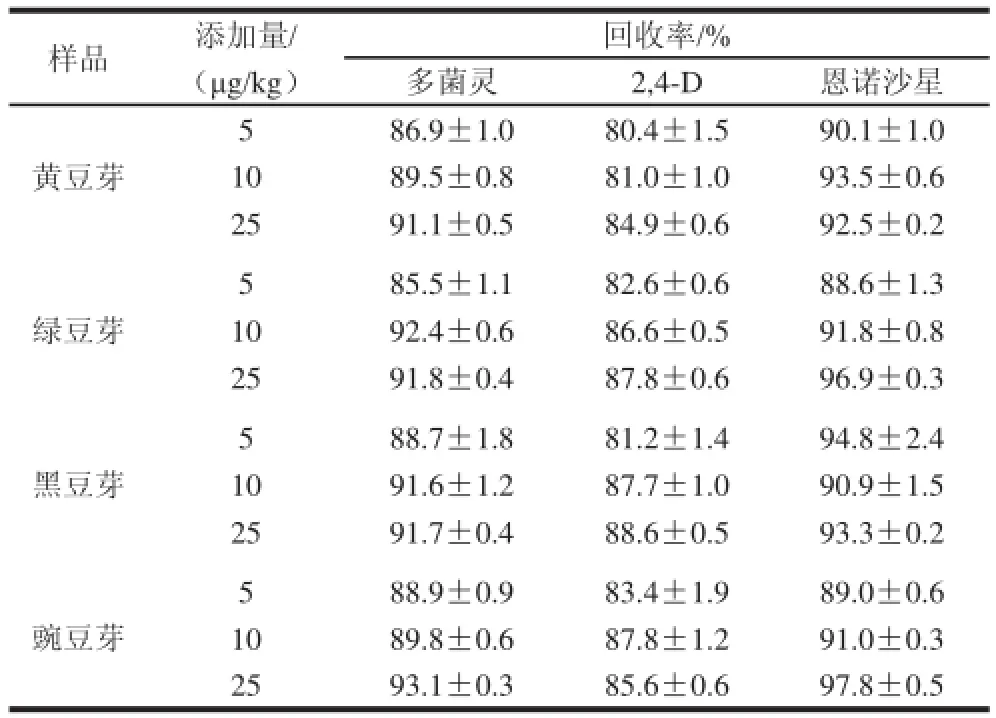
表4 多菌灵、2,4-D、恩诺沙星的回收率结果(n=3)Table 4 Recovery rates of carbendazim, 2,4-D and enrofloxacin from spiked samples (n= 3)
2.7 基质效应
本实验采用固相萃取净化的前处理程序以消除部分基质效应的影响,但是基质效应在药物残留分析中非常普遍,药物和样品本身的性质都是影响基质效应的因素,因此,本实验分别用流动相和空白样品溶液稀释了一系列的标准溶液,进行液相色谱-串联质谱对比检测。结果表明:多菌灵、2,4-D、恩诺沙星的基质标样峰面积较流动相标样的峰面积大,说明基质对多菌灵、2,4-D、恩诺沙星存在一定的电离增大作用。因而,在实际样品测试中,采用空白基质提取液配制标样以消除基质效应,不同种类豆芽的基质效应依次为黑豆芽>绿豆芽>黄豆芽>豌豆芽。多菌灵、2,4-D、恩诺沙星在甲醇和提取空白基质中的标准曲线见图3。
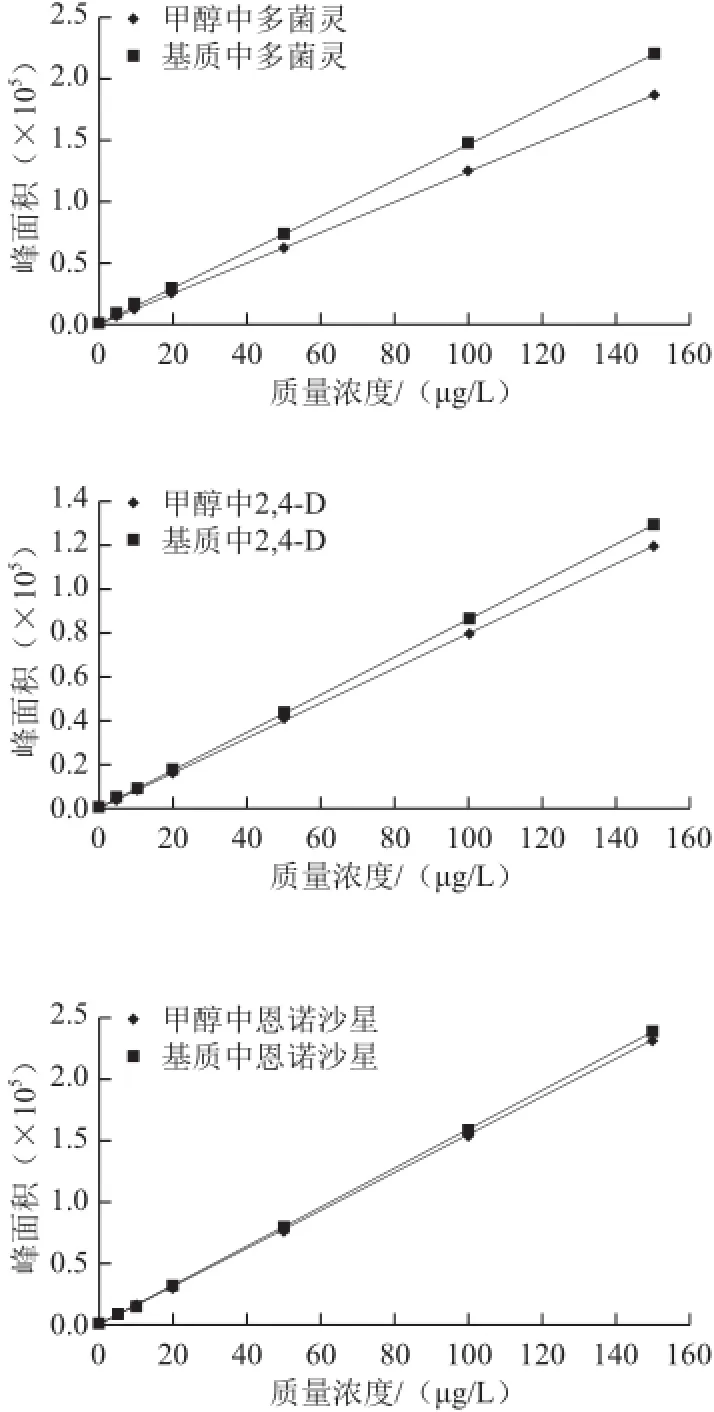
图3 多菌灵、2,4-D、恩诺沙星在甲醇和提取空白基质中的标准曲线图Fig.3 Calibration curves of carbendazim, 2,4-D and enrofloxacin in pure solvent (methanol) and blank matrix extract
2.8 实际样品测试
在当地超市购买20 批次豆芽(其中黄豆芽5 批、绿豆芽5 批、黑豆芽5 批、豌豆芽5 批)进行分析测试,部分样品发现多菌灵和恩诺沙星药物,其中阳性豆芽中多菌灵的含量为16.73~124.66 μg/kg,阳性豆芽中恩诺沙星的含量为8.63~37.89 μg/kg,而2,4-D都检出。
3 结 论
本实验建立了超高效液相色谱-质谱法同时测定豆芽中多菌灵、2,4-D、恩诺沙星残留量的分析方法。该方法具有灵敏度高,前处理方法简单,回收率高且稳定,准确度和精密度高等优点,适用于多类豆芽中多菌灵、2,4-D、恩诺沙星残留量的检测和确证。此外,与传统的液相色谱和气相色谱检测方法相比,串联质谱有效地降低了由仪器检测所产生假阳性,保证了定性和定量结果的可靠性,而且液相色谱不能同时测定恩诺沙星和多菌灵,2,4-D用气相色谱或气相色谱-质谱联用测定时需要衍生化。
[1] 孙洪磊. 一根豆芽几多毒[N]. 新华每日电讯, 2013-11-27(6).
[2] 詹思佳. 无根素“催肥”豆芽检出尿素、亚硝酸盐、6-苄基腺嘌呤[N].银川晚报, 2011-06-04(3).
[3] 钱文娟. 胖大无根豆芽有毒吗[J]. 农药市场信息, 2011(8): 2.
[4] 余露. 豆芽生产禁用农药、化学添加剂[J]. 农药市场信息, 2013(3): 4.
[5] 马意翀, 宋晓东. 豆芽小作坊成“化学实验室”[N]. 新华每日电讯, 2013-08-04(1).
[6] 马坤明. “毒豆芽”溯源[J]. 农产品市场周刊, 2013(15): 42-43.
[7] 陈梦茜, 李清雅, 单晓云, 等. 江苏省四市消费者无根豆芽认知、态度、行为调查[J]. 中国食物与营养, 2013, 19(5): 75-77.
[8] 张菊平, 张兴志, 王进涛, 等. 无根豆芽激素对豌豆芽菜生长的影响[J].洛阳农业高等专科学校学报, 2000, 20(2): 16.
[9] 傅腾腾, 朱建强, 张淑贞, 等. 植物生长调节剂在作物上的应用研究进展[J]. 长江大学学报: 自然科学版, 2011(10): 233-235.
[10] 张锋, 潘康标, 田子华. 植物生长调节剂研究进展及应用对策[J]. 现代农业科技, 2012, 33(2): 193-195.
[11] 陈卫军, 张耀海, 李云成, 等. 果蔬中常用植物生长调节剂分析方法研究进展[J]. 食品科学, 2012, 33(11): 283-289.
[12] 王一茜, 张广华, 何洪巨. 蔬菜中主要生长调节剂残留检测方法的研究进展[J]. 现代仪器, 2012, 18(2): 6-10.
[13] 史晓梅, 金芬, 黄玉婷. 水果中常用植物生长调节剂的研究进展[J].食品工业科技, 2012, 33(4): 417-426.
[14] 徐爱东. 我国蔬菜中常用植物生长调 节剂的毒性及残留问题研究进展[J]. 中国蔬菜, 2009, 22(8): 1-6.
[15] 常宇文, 吴晓宗, 李伟, 等. 凝胶渗透色谱-气相色谱法测定豆芽中2,4 -二氯苯氧乙酸残留量[J]. 食品工业科技, 2007, 28(12): 203-204.
[16] 杜黎明, 许庆琴. 气相色谱法直接测定植物生长素[J]. 色谱, 2000, 18(2): 160-161.
[17] 杨挺, 芦晓红, 皇甫伟国. 柱前衍生-气相色谱法测定柑橘中2,4-D残留量研究初报[J]. 中国农学通报, 2006, 22(10): 330-333.
[18] NY 5317—2006 无公害食品芽类蔬菜[S].
[19] DB 11/377—2006 豆芽安全卫生要求[S].
[20] 符继红, 褚金芳, 王吉德, 等. 固相萃取反相高效液相色谱荧光检测法测定拟南芥中的生长素[J]. 分析化学, 2009, 37(9): 1324-1327.
[21] 孔德洋, 石利利, 单正军, 等. 萘乙酸残留的高效液相色谱法测定[J].分析测试学报, 2010, 29(4): 382-385.
[22] 李小平, 陈晓虹, 姚浔平, 等. HPLC法测定豆芽中6-苄氨基嘌呤残留研究[J]. 中国卫生检验杂志, 2005, 15(2): 149-150.
[23] 汪伟. 几种植物生长调节剂的高效液相色谱分析[J]. 农药, 2009, 48(2): 116-117.
[24] NY/T 1680—2009 蔬菜水果中多菌灵等4种并咪唑类农药残留量的测定: 高效液相色谱法[S].
[25] 曹慧, 陈小珍, 王瑾, 等. 超高效液相色谱-串联质谱技术同时分析食品中多种植物激素残留[J]. 农药, 2012, 51(10): 738-741.
[26] 吴凤琪, 靳保辉, 陈波, 等. 水果中8 种外源性植物生长调节剂的液相色谱-串联质谱测定[J]. 中国农学通报, 2010, 26(15): 115-119.
[27] 王静静, 鹿毅, 杨涛, 等. HPLC-MS/MS法同时测定果蔬中6 种植物生长抑制剂残留[J]. 分析测试学报, 2011, 30(2): 128-134.
[28] 陈宁宁. 苹果中天然产物及蔬菜中农药残留的测定方法研究[D]. 济南: 山东大学, 2012.
[29] 史晓梅. 多效唑等5 种植物生长 调节剂检测技术及多效唑在桃上的残留研究[D]. 北京: 中国农业科学院, 2012.
[30] 解静. 苹果中三类植物生长调节剂残留的色谱分离分析方法研究[D].郑州: 郑州大学, 2010.
[31] 唐莉娟. 食品中多种植物生长调节剂同时分析新技术研究及应用[D].南昌: 南昌大学, 2012.
[32] 陆益民. 水果常用植物生长调节剂分析方法的研究[D]. 广州: 广东工业大学, 2011.
[33] BHARAT U, KAUSHIK B, RAMTEKE S D, et al. Dissipation kinetics of forchlorfenuron, 6-benzyl aminopurine, gibberellic acid and ethephon residues in table grapes[J]. Food Chemistry, 2013, 141(4): 4208-4214.
[34] CHO S K, El ATY A M A, PARK K H, et al. Simple multiresidue extraction method for the determination of fungicides and plant growth regulator in bean sprouts using low temperature artitioning and tandem mass spectrometry[J]. Food Chemistry, 2013, 136(3/4): 1414-1420.
[35] AXEL M, PETRA D, WEILER E W. A multiplex GC-MS/MS technique for the sensitive and quantitative single-run analysis of acidic phytohormones and related compounds, and its application to Arabidopsis thaliana[J]. Planta, 2002, 216(1): 44-56.
[36] GB/T 20366—2006 动物源产品中喹诺酮类残留量的测定: 液相色谱-串联质谱法[S].
[37] SHI Xiaomei, JIN Fen, HUANG Yuting, et al. Simultaneous determination of five growth regulators in fruits by modified quick, easy, cheap, effective rugged and safe (QuEChERS) extraction and liquid chromatography-tandem mass spectrometry[J]. Journ al of Agricultural and Food Chemistry, 2012, 60(1): 60-65.
[38] XUE Jiaying, WANG Suli, YOU Xiangwei, et al. Multi-residue determination of plant growth regulators in apples a nd tomatoes by liquid chromatography/tandem mass spectrometry[J]. Rapid Commun Mass Spectrom, 2011, 25(5): 3289-3297.
[39] GE Li, PE H C Y, YONG J W, et al. Analyses of gibberellins by capillary electrophoresis-mass spectrometry combined with solidphase extraction[J]. Journal of Chromatography A, 2007, 1159(1/2): 242-249.
[40] 徐生坚, 曹慧, 陈小珍. 超高效液相色谱-串联质谱法测定粮谷中六种植物生长调节剂残留[J]. 食品科学, 2013, 34(18): 218-222.
[41] JIN Micong, REN Yiping, CHEN Xiaohong. Determination of 6-benzyladenine in bean sprout by LC-ESI-IT-MS-MS[J]. Chromatographia, 2007, 66(3/4): 407-410.
Determination of Carbendazim, 2,4-D and Enrofloxacin Residues in Bean Sprouts by Ultra Performance Liquid Chromatography-Tandem Mass Spectrometry
DING Li1,2, ZENG Shao-dong2, WEI Xiao-yi1, WANG Ming-yue2, LI Ji-hua1,*, CHENG Sheng-hua1,2
(1. Agricultural Products Processing Research Institute, Chinese Academy of Tropical Agricultural Sciences, Zhanjiang 524001, China; 2. Laboratory of Quality and Safety Risk Assessment on Agro-products Processing, Ministry of Agriculture, Zhanjiang 524001, China)
A method was established for determining carbendazim, 2,4-D, enrofloxacin residues in bean sprouts by ultra performance liquid chromatography-tandem mass spectrometry (UPLC-MS-MS). Samples were extracted with acidified acetonitrile, and cleaned up on a WAX cartridge. Th e target analytes were separated on a Waters C18column with gradient elution using a mobile phase made up of methanol and 0.1% formic acid. Detection was carried out using positive/ negative electrospray ionization and multiple-reaction monitoring (MRM), and the external standard method was used for quantification. In the linear range of 5–150 μg/L, the correlation coefficients were all larger than 0.999 0 f or carbendazim, 2,4-D and enrofloxacin. The limits of detection (LODs) were 0.5 μg/kg and the limits of quantitation (LOQs) were 1.5 μg/kg. The recovery rates at three spiked levels of 5.0, 10.0 and 25.0 μg/kg were in the range of 80.4%–97.8%. The relative standard deviation (RSD) of intra-day and inter-day assays was 1.25%–5.47%. The method proved to be simple, sensitive, rapid and suitable for the determination of carbendazim, 2,4-D and enrofloxacin residues in bean sprouts.
ultra performance liquid chromatography-tandem mass spectrometry (UPLC-MS-MS); carbendazim; 2,4-D; enrofloxacin; residue; bean sprout
O657.63
A
1002-6630(2014)22-0169-07
10.7506/spkx1002-6630-201422032
2014-01-16
农业部财政专项,农产品质量安全监管(风险评估)项目
丁丽(1982—),女,助理研究员,硕士研究生,研究方向为食品加工。E-mail:gdzjding@hotmail.com
*通信作者:李积华(1979—),男,研究员,博士,研究方向为食品加工与副产品综合利用。E-mail:1105063165@qq.com
