紫外照射处理对蒜薹品质与活性氧代谢影响的多变量解析
2014-03-08王友升蔡琦玮谷祖臣李兵霞杨宏伟陈小燕李丽萍王贵禧
王友升 ,蔡琦玮,谷祖臣,李兵霞,杨宏伟,陈小燕,李丽萍,王贵禧*
(1.北京工商大学食品学院,北京市食品添加剂工程技术研究中心,食品质量与安全北京实验室,北京 100048;2.中国林业科学院林业研究 所,国家林业局林木培育实验室,北京 100091)
紫外照射处理对蒜薹品质与活性氧代谢影响的多变量解析
王友升1,蔡琦玮1,谷祖臣1,李兵霞1,杨宏伟1,陈小燕1,李丽萍1,王贵禧2,*
(1.北京工商大学食品学院,北京市食品添加剂工程技术研究中心,食品质量与安全北京实验室,北京 100048;2.中国林业科学院林业研究 所,国家林业局林木培育实验室,北京 100091)
运用多变量分析方法探讨紫外照射处理对蒜薹品质与活性氧代谢的影响。采后常温贮藏过程中,蒜薹的呼吸强度上升,光泽降低、颜色泛黄,导致蒜薹的品质降低,紫外照射处理加速了蒜薹劣变过程,其中处理15 min的效果最显著。主成分分析发现,a*、b*是影响紫外照射处理对蒜薹劣变作用的主要品质指标,过氧化氢(H2O2)含量、超氧化物歧化酶(SOD)活性、丙二醛(MDA)含量、多酚氧化酶(PPO)活性、总酚、花青素、谷胱甘肽(GSH)含量是主要决定指标。相关性分析、偏最小二乘分析和通径分析的结果都表明:H2O2含量与SOD活性呈显著正相关,与总酚含量呈显著负相关;可食率与DPPH自由基清除能力呈显著正相关,与GSH、MDA和花青素含量呈显著负相关。
蒜薹;紫外照射处理;品质;活性氧代谢
蒜薹为大蒜(Allium sativum L.)的幼嫩花薹,在贮藏期间极易老化,出现黄化、糠化、凹陷斑、蒜苞膨大、薹梢霉变、腐烂等[1]。目前已报道的蒜薹保鲜措施有减压处理[2]、气调贮藏、冷藏法[3]和γ射线处理[4]等。近年来,研究表明短波紫外照射可通过净化果蔬表面的微生物,而达到控制果蔬腐烂情况、延长果蔬采后货架期的目的,紫外保鲜已在西红柿、草莓、韭菜等上取得良好效果[5],而对蒜薹的紫外保鲜还未见报道。果蔬衰老过程伴随着活性氧的大量产生和膜脂过氧化作用,其中对植物生理活动影响最大的活性氧为超氧阴离子自由基、羟自由基和过氧化氢(H2O2),H2O2不仅自身能够对植物系统造成伤害,还可直接引发脂质过氧化[6],产生脂质过氧化物、脂过氧化物自由基及丙二醛(malondialdehyde,MDA)[7]。在活性氧代谢体系中,超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)、抗坏血酸过氧化物酶(ascorbate peroxidase,APX)、过氧化物酶(peroxidase,POD)、抗氧化酶以及还原型谷胱甘肽(glutathione,GSH)、花青素等为非酶类抗氧化物均关系着果蔬的品质[8]。但对于紫外照射处理对蒜薹活性氧代谢及其品质的影响,至今国内外鲜有报道。
目前,多数统计学方法已被应用到果蔬的保鲜研究中,如单因素方差分析法(one-way ANOVA)[9]、主成分分析法(principal component analysis,PCA)[10]、相关性分析[11]、偏最小二乘法回归(partial least squares regression,PLSR)[12]、通径分析[13]。利用多种统计学方法分析生物学意义的报道较少,已有研究综合分析了油桃品质与活性氧之间的关系[14], 然而对蒜薹的生物学意义研究还未见报道,本实验综合采用这5 种不同的统计学方法研究了紫外照射处理对蒜薹品质及活性氧代谢指标的影响,并采用多变量分析揭示它们之间的内在联系,以期为获得蒜薹的高效保鲜技术提供理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 材料及处理
实验所用蒜薹为苍山草蒜,来自北京新发地农贸市场,选择长短、色泽一致、无病虫害且无机械伤的样品进行实验。本实验设计3组处理:1)未经处理,即对照组;2)紫外照射5 min,UV-5组;3)紫外照射10 min,UV-10组;4)紫外照射15 min,UV-15组。每组都选择同等成熟度、长度的蒜薹。常温(20 ℃)贮藏0、7 d后测定蒜薹品质和活性氧代谢相关指标。
1.1.2 试剂
三吡啶三吖嗪(2,4,6-tris(2-pyridyl)-s-triazine,TPTZ)、2,2′-联氮-双-(3-乙基苯并噻唑啉-6-磺酸)(2,2′-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid) diammonium salt,ABTS)、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH) 美国Sigma-Aldrich公司;其他试剂均为分析纯。
1.2 仪器与设备
T25分散机 德国Ultra-turrax公司;F-80C型制冰机 北京博威兴业发展有限公司;5810R型离心机德国Eppendorf公司;TB-214型分析天平 美国Demcer仪器公司;UV-2450型分光光度计 日本Shimadzu公司;DHG 9145A型电热鼓风干燥箱 上海一恒科技有限公司;LFRA质构仪 美国Brookfield公司;ADCI-60C色差计 北京辰泰克仪器技术有限公司。
1.3 方法
1.3.1 品质指标的测定
果肉色度L*、a*、b*值:采用PCQC色彩品质控制仪进行测定,L*表示样品的明度,样品L*值越大,色调越亮;a*值表示颜色的红绿,样品a*值越小,色调越绿;b*表示颜色的黄蓝,样品b*值越小,色调越黄。可食率:以蒜薹可食数量占调查总蒜薹数的百分率表示。硬度:采用FT-327型手持式硬度计测定,每次取样15 个果实。
1.3.2 呼吸强度的测定
参考静置碱液吸收法[15]。呼吸强度以mg CO2/(kg·h)表示。
1.3.3 乙烯释放量的测定
参考胡花丽等[16]方法。将300~550 g待测果实置于干燥器中密闭2 h,控制环境温度为20 ℃,顶空抽取气体进行气相色谱检测,每个处理重复3次。检测仪器为安捷伦6890GC,检测条件为进样口温度50 ℃;检测器温度150 ℃;柱温50 ℃;氮气为载气,流速23.3 mL/min;氢气为燃气,流速30 mL/min;空气为助燃气,流速300 mL/min。
1.3.4 H2O2和MDA含量的测定
H2O2含量的测定:参照Brennan等[17]的方法,以每克鲜质量样品所含H2O2物质的量表示(μmol/g);MDA含量根据Wang yousheng等[18]的方法测定。
1.3.5 GSH含量的测定
参照Huang Renhua等[19]的方法,并有所改进。0.5 mL提取液加入2.3 mL磷酸盐缓冲液(phosphate buffer,PBS,0.15 mol/L pH 7.8)和0.2 mL 5,5’-二硫双(2-硝基苯甲酸)(5,5’-dithiobis(2-nitrobenzoic acid),DTNB),在此反应体系下30 ℃水浴1 h,测定412 nm波长处吸光度。
1.3.6 总酚和花青素含量测定
总酚含量测定:参照郑仕宏等[20]的方法。以没食子酸作标准曲线,样品的总酚含量换算为每100 g鲜质量样品中没食子酸的含量(mg/100 g); 花青素含量的测定:参照Wang等[21]的方法,采用pH示差法,矢车菊素3-O-葡萄糖苷的消光系数为29 600,样品的花青素含量换算为每100g鲜质量样品中矢车菊素3-O-葡萄糖苷的含量(mg/100 g)。
1.3.7 抗氧化能力
参考Blois[22]的方法进行清除DPPH自由基能力的测定。将对DPPH自由基50%清除率定义为1个活性单位(U),清除DPPH自由基能力以每克鲜质量样品中含有的活性单位来表示(U/g)。
采用NBT光还原法测定清除超氧阴离子自由基能力和SOD活性[23],以抑制NBT光化还原的50%为一个SOD酶活单位(U)。
1.3.8 活性氧代谢相关酶的测定
脂氧合酶(lipoxygenase,LOX)活性的测定参考Pérez等[24]的方法,以每分钟酶促反应体系吸光度变化0.01为一个LOX活力单位(U);APX活性的测定参考Jimenez等[25]的方法,以每分钟酶促反应体系吸光度变化0.01为一个APX活力单位(U);POD活性的测定参考Jiang Aili等[26]的方法,以每分钟酶促反应体系吸光度变化0.01为一个POD活力单位(U);PPO活性参照Waite[27]的方法,以每分钟酶促反应体系吸光度变化1为一个PPO活力单位(U)。酶活性均以U/g表示。
1.4 数据处理与分析
采用SPSS统计软件进行单因素方差分析(One-way ANOVA)和相关性分析,邓肯氏多重差异比较或t检验,当P<0.05时,表示差异显著。采用Unscrambler 9.7统计分析软件进行PCA和PLSR,采用DPS(v.8.01)软件进行通径分析,数据在进行分析前均先做标准化处理。
2 结果与分析
2.1 单因素方差分析
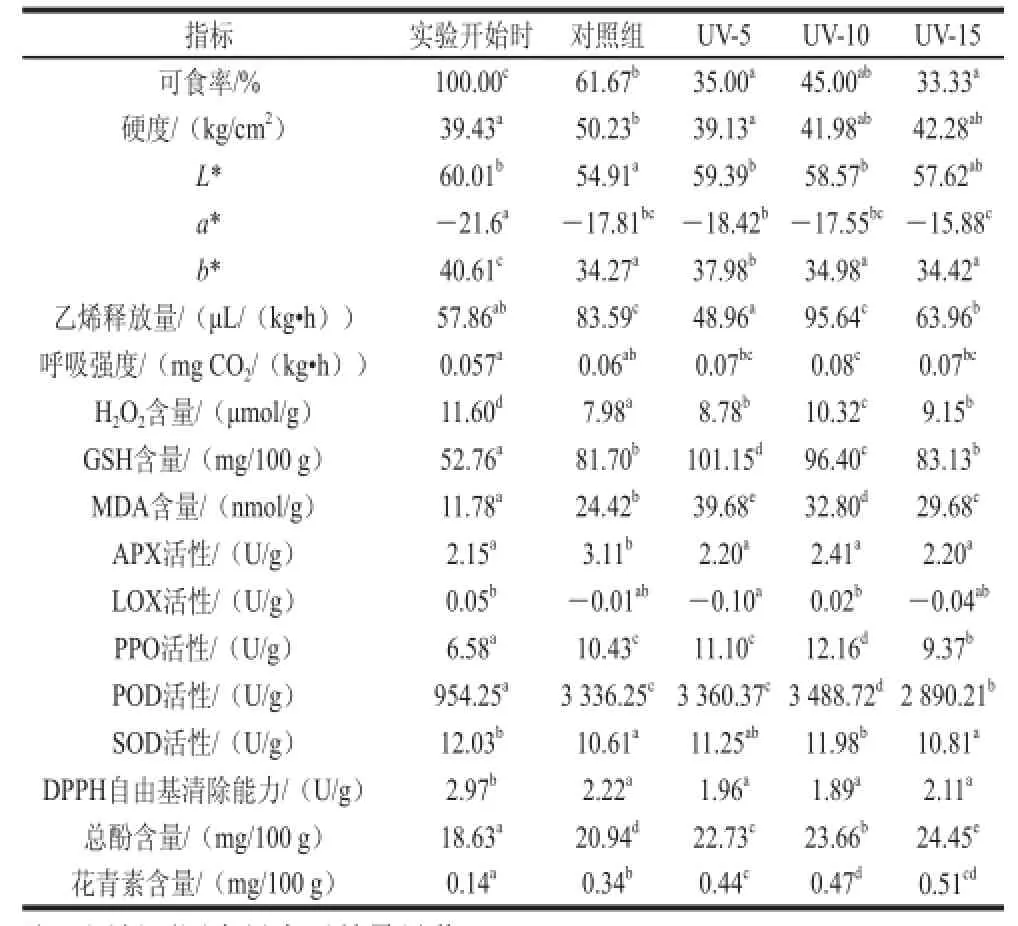
表1 蒜薹贮藏期间不同处理下品质与活性氧代谢相关物质的变化Table 1 Changes in quality and active oxygen metabolism indicators in garlic sprouts during postharvest storage with different treatments
表1表明:从蒜薹的品质指标来看,随贮藏时间的延长,蒜薹可食率、L*和b*值呈下降趋势,而硬度、a*值、乙烯释放量和呼吸强度呈上升趋势。蒜薹在贮藏过程中失水,使得其呼吸强度上升,蒜薹的光泽降低(L*下降)、颜色泛黄(a*上升和b*下降),从而导致蒜薹品质下降,可食率降低。而不同紫外照射处理对蒜薹可食率和a*值的影响相近,其中UV-15的紫外照射处理促进了蒜薹绿色和可食率的降低。
从蒜薹的活性氧代谢来看,随贮藏时间的延长,蒜薹的H2O2含量、LOX、SOD活性和DPPH自由基清除能力呈下降趋势,而MDA含量、APX、PPO和POD活性则逐渐升高。相比于对照处理,不同紫外照射处理均能够抑制H2O2含量和SOD活性的下降、促进DPPH自由基清除能力下降,其中UV-10的紫外照射处理的作用效果最显著;不同的紫外照射处理均能够促进蒜薹中MDA含量、PPO和POD活性的上升,而UV-15的促进效果最弱,甚至会降低其含量。
从蒜薹的活性物质含量来看,随贮藏时间的延长,蒜薹的GSH含量、总酚和花青素含量呈上升趋势。相比于对照处理,不同的紫外照射处理均能够促进蒜薹的总酚和花青素含量的上升,其中,UV-15的促进效果强于其他处理。
2.2 主成分分析
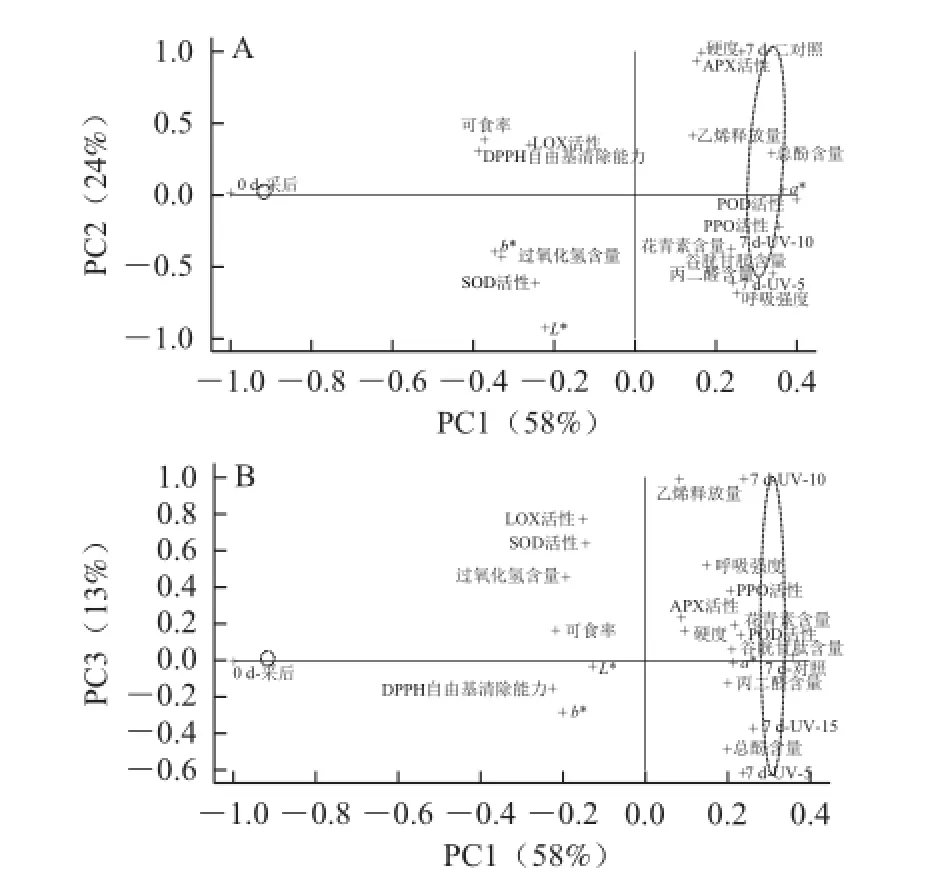
图1 蒜薹果实主成分的因子载荷和得分的双标图Fig.1 Loadings and scores from PCA of garlic sprouts
通过主成分分析得到前3 个主成分的累计贡献率为95%,因此设定这3 个主成分即能够代表整体数据的信息特征。图1是各个理化指标在不同贮藏时间、不同处理下的载荷和得分散点的PCA双标图。由图1可知,实验开始时与7 d时分别分布在PC1的两端,可见蒜薹贮藏7 d时与实验开始时的差异显著。
图1A中的PC1、PC2分别解释了变量的58%、24%。POD、PPO、a*、总酚、花青素、GSH、MDA含量在PC1的正坐标处有较高的载荷,可食率、DPPH自由基清除能力、LOX活性、b*和H2O2含量在PC1的负坐标处有较高的载荷。硬度、APX活性在PC2的正坐标处有较高的载荷,L*、SOD活性、呼吸强度在PC2的负坐标处有较高的载荷。由于POD、PPO活性、a*、总酚、花青素、GSH、MDA含量、可食率、DPPH自由基清除能力、LOX活性在PC1的高载荷量,PC1较好地区分了0 d与7 d的样本差异。由于硬度、APX活性、L*、SOD活性、呼吸强度在PC2的高载荷量,PC2较好地区分了7 d时紫外照射5 min与对照的样本差异。
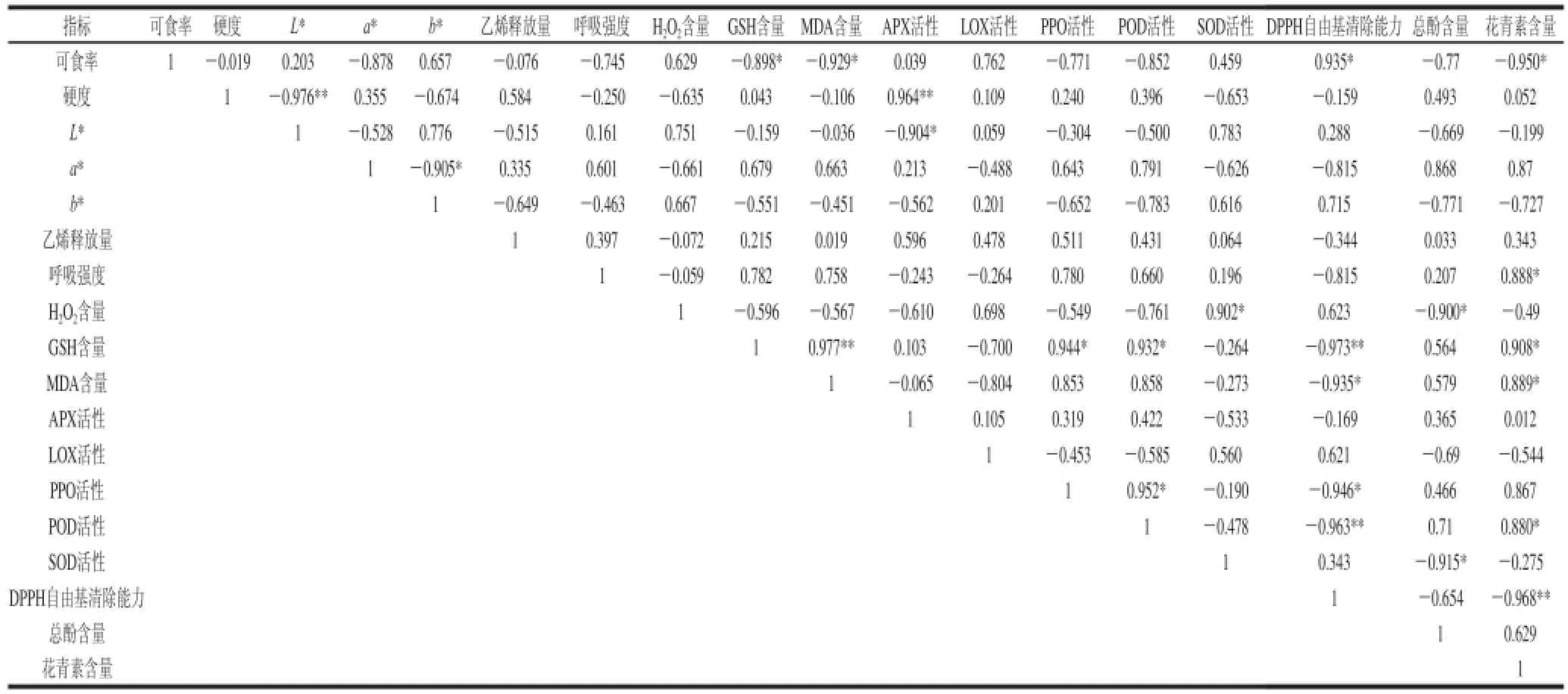
表2 蒜薹果实品质与活性氧代谢的相关性分析Table 2 Analysis of the correlation between the quality of garlic sprouts and reactive oxygen species metabolism
图1B中的PC3解释了变量的13%,由于乙烯释放量、LOX、SOD活性在PC3的正坐标上有较高的载荷,总酚在PC3的负坐标上有较高的载荷。使PC3较好地区分了7 d时紫外照射5 min与10 min的差异。
2.3 相关性分析
表2的结果表明,蒜薹的可食率与DPPH自由基清除能力呈显著正相关,与GSH、MDA、花青素含量呈显著负相关,与其他指标相关性不显著;硬度与APX活性呈极显著正相关,与L*呈极显著负相关。
H2O2含量与SOD活性呈显著正相关,与总酚含量呈显著负相关;花青素含量与呼吸强度、GSH、MDA含量、POD活性呈显著正相关,与可食率和DPPH自由基清除能力呈显著负相关;GSH与MDA含量、PPO、POD活性、花青素含量呈显著或极显著正相关,与DPPH自由基清除能力呈极显著负相关。
2.4 偏最小二乘回归分析
可食率为果实品质的直观指标,H2O2为活性氧代谢的中心物质,为了分析其他指标与它们之间的关系,选取可食率、H2O2含量为因变量,其他指标为自变量,建立PLSR模型图(图2)。结果表明,该模型中80%的X变量解释了92%的Y变量。以因子2来区分,H2O2含量与可食率、L*、SOD活性等均呈正相关关系,与呼吸强度、MDA、GSH和花青素含量呈负相关关系;可食率与DPPH自由基清除能力、APX活性等均呈正相关关系,与硬度和总酚含量呈负相关关系。这与相关性分析结果相近,即H2O2含量与SOD活性呈显著正相关,与总酚含量呈显著负相关;可食率与DPPH自由基清除能力呈显著正相关,与GSH、MDA、花青素含量呈显著负相关。
以因子1来区分,各指标对可食率的影响的结果与相关性分析的结果一致,这表明紫外照射处理蒜薹导致其可食率变化的主要影响指标为H2O2含量、SOD活性、GSH、MDA、花青素和总酚含量等。
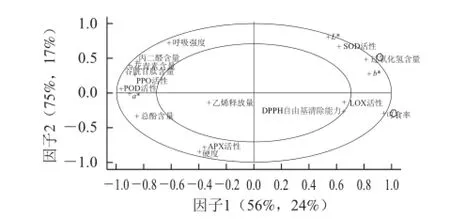
图2 基于主成分1与2的PLSR回归模型的相关载荷图Fig.2 Correlation loading plot from a PLSR model
2.5 通径分析
以可食率为因变量、其他指标为自变量,做逐步回归分析,得到逐步回归方程:Y=101.22+1.116X9+ 258.59X11-192.01X17,并进行显著性检验,得知该回归方程有显著意义,可进一步做通径分析。从通径系数表(表3)的结果可知,MDA含量(X9)、LOX活性(X11)、花青素含量(X17)为影响蒜薹可食率的主要因素(直接通径系数),各因变量对可食率的决定系数R2为0.999 5,其直接通径系数排序为:LOX活性>MDA含量>花青素含量,其中花青素含量对可食率有显著的负直接作用。MDA含量(间接通径系数为-0.917 7)通过花青素对可食率有较强的负间接作用。在前面的相关性分析中,可食率与MDA、花青素含量呈显著负相关,但通径分析却显示了MDA含量对蒜薹可食率的作用是正相关作用,说明其对可食率的影响是通过花青素的间接效应来表达的,而花青素对可食率的作用效果与相关性分析中的结果一致。

表3 以可食率为因变量的通径分析结果Table 3 Results of path analysis using edible rate as the dependent variable
以H2O2含量为因变量、其他指标为自变量做逐步回归分析,得到逐步回归方程:Y=-7.12+0.23X4-0.38X12+ 2.17X14,并进行显著性检验,得知该回归方程有显著意义,可进一步做通径分析。从通径系数表(表4)的结果可知,a*(X4)、PPO活性(X12)和SOD活性(X14)为影响蒜薹H2O2含量的主要因素(直接通径系数),各因变量对可食率的决定系数R2为0.997 2,其直接通径系数排序为:SOD活性>a*>PPO活性,其中SOD活性和a*对H2O2含量有显著的正直接作用,PPO活性对其有较强的负直接作用。

表4 以H2O2为因变量的通径分析结果Table 4 Results of path analysis using H2O2as the dependent variable
3 讨论与结论
果实的外观品质指标是影响其直观评价的重要因素,主要包括果面色泽、亮度、果实大小、形态等[28-29],其中果面色泽、亮度属于果实色度指标(亮度值L、红绿值a*和黄蓝值b*等)。本研究结果表明,蒜薹可食率、L*和b*值随贮藏时间延长呈下降趋势,而硬度、a*值、乙烯释放量和呼吸强度而上升。而不同的紫外照射处理促进蒜薹可食率降低、呼吸强度升高、蒜薹颜色泛黄,且紫外照射处理对蒜薹可食率的影响与呼吸强度、a*值和b*值具有正相关。主成分分析的结果也表明,可食率、a*、b*、H2O2含量、SOD活性、MDA含量、PPO活性、总酚、花青素、GSH含量是影响蒜薹劣变作用的主要指标,且这些指标较好地区分了0 d与7 d、紫外照射处理与对照的样本差异,表明蒜薹常温贮藏7 d时品质已显著劣变,紫外照射处理加速了其劣变。
蒜薹的H2O2含量、LOX、SOD活性和DPPH自由基清除能力随贮藏时间延长而呈下降趋势,而MDA含量、PPO、POD活性和抗氧化活性物质(GSH、总酚和花青素含量)则呈现上升趋势。相比于对照处理,不同的紫外照射处理能够抑制H2O2含量和SOD活性的下降,促进蒜薹中MDA含量、PPO和POD活性的上升,加速蒜薹的劣变。研究证明,H2O2能够通过Haber-Weiss反应产生更活跃、更有毒性的羟自由基,产生脂质过氧化物、脂过氧化物自由基及MDA[7],MDA可使PPO、酚类与其底物相接触而发生酶促褐变[30]。本研究结果显示,紫外照射处理加速蒜薹品质劣变,这可能由于蒜薹体内活性氧生成反应比其自由基清除反应活跃,因此,综合作用结果反应在蒜薹品质上即为促进其贮藏品质降低。
由相关性分析和偏最小二乘回归分析可知,蒜薹的可食率与DPPH自由基清除能力呈显著正相关,与GSH、MDA、花青素含量呈显著负相关;H2O2与呼吸强度、MDA、GSH和花青素含量呈负相关关系,且与总酚含量呈显著负相关,这暗示H2O2的积累伴随着蒜薹色泽和呼吸强度等品质的劣变和总酚的降低,同时又诱导其产生SOD活性、GSH、花青素含量等抗氧化活性物质[8]。通径分析显示花青素对可食率有显著负直接作用,SOD活性对H2O2含量有显著的正直接作用,这也与相关性分析中结果相一致,表明紫外照射处理蒜薹导致其劣变是H2O2含量、SOD活性、GSH、MDA、花青素和总酚含量等指标的作用结果。
紫外照射处理可降低蒜薹可食率、增强呼吸强度升高、加速色泽泛黄,其中处理15 min的效果最显著。主成分分析发现,a*、b*是影响紫外照射处理对蒜薹劣变作用的主要品质指标,H2O2含量、SOD活性、MDA含量、PPO活性、总酚、花青素、GSH含量是主要决定指标。相关性分析、偏最小二乘分析和通径分析的结果均表明可食率与DPPH自由基清除能力呈显著正相关,与GSH、MDA、花青素含量呈显著负相关;H2O2含量与SOD活性呈显著正相关,与总酚含量呈显著负相关。
[1] 周晓琳, 牟文良, 王庆国. 3种植物提取液对蒜薹货架期品质的影响[J].农学学报, 2012, 2(1): 48-52.
[2] 韩军岐, 张有林. 蒜薹减压贮藏技术研究[J]. 吉林农业大学学报, 2006, 28(2): 222-225.
[3] 李琴. NO对蒜薹的保鲜作用研究[J]. 天津农业科学, 2010, 16(6): 57-60.
[4] PEREZ M B, AVELDANO M I, CROCI C A. Growth inhibition by gamma rays affects lipids and fatty acids in garlic sprouts duringstorage[J]. Postharvest Biology and Technology, 2007, 44(2): 122-130.
[5] 郑杨, 曹敏, 申琳, 等. 短波紫外线照射对韭菜采后贮藏品质及活性氧代谢相关酶的影响[J]. 食品科学, 2011, 32(20): 307-311.
[6] 张刚, 李里特, 丹阳. 果蔬成熟衰老中的活性氧代谢[J]. 食品科学, 2004, 25(增刊1): 225-230.
[7] KEHRER J P. The Haber-Weiss reaction and mechanisms of toxicity[J]. Toxicology, 2000, 149(1): 43-50.
[8] GILL S S, TUTEJA N. Reactive oxygen species and antioxidant machinery in abiotic stress tolerance in crop plants[J]. Plant Physiology and Biochemistry, 2010, 48(12): 909-930.
[9] WANG yousheng, TIAN Shiping. Interaction between Cryptococus laurentii, Monilinia fructicola and sweet cherryfruit at different temperatures[J]. Agricultural Sciences in China, 2008, 7(1): 48-57.
[10] 陈小燕, 王友升, 李丽萍, 等. 1-MCP对桃果实低温贮藏期间挥发性物质的影响: 主成分分析法[J]. 北京工商大学学报: 自然科学版, 2010, 28(3): 48-54.
[11] RUIZ D, EGEA J. Analysis of the variability and correlations of fl oral biology factors affecting fruit set in apricot in a Mediterranean climate[J]. Scientia Horticulturae, 2008, 115(2): 154-163.
[12] 陈小燕, 王友升, 安琳, 等. 桃果实低温贮藏期间挥发性物质与感官特性的关系: 偏最小二乘回归分析法[J]. 北京工商大学学报: 自然科学版, 2010, 28(4): 36-40.
[13] BEHROUZ E M, JENNIFER D. Correlation and path-coefficient analyses of ripening attributes and storage disorders in ‘Ambrosia’ and‘Empire’ apples[J]. Postharvest Biology and Technology, 2009, 51(2): 168-173.
[14] 杨宏伟, 陈小燕, 张影, 等. 油桃采后衰老与病害发生中品质与活性氧代谢相关性分析[J]. 食品科学, 2011, 32(20): 244-248.
[15] 张桂. 果蔬采后呼吸强度的测定方法[J]. 理化检验: 化学分册, 2005, 41(8): 596-597.
[16] 胡花丽, 梁丽松, 李鹏霞, 等. 外源乙烯对CA贮藏桃果实内源乙烯生物合成的影响[J]. 保鲜与加工, 2008, 8(5): 34-37.
[17] BRENNAN T, FRENKEL C. Involvement of hydrogen peroxide in the regulation of senescence in pear[J]. Plant Physiology, 1977, 59(3): 411-416.
[18] WANG yousheng, TIAN Shiping, XU yong, et al. Changes in the activities of pro- and anti-oxidant enzymes in peach fruit inoculated with Cryptococcus laurentii or Penicillium expansum at 0 or 20 ℃[J]. Postharvest Biology and Technology, 2004, 34(1): 21-28.
[19] HUANG Renhua, XIA Renxue, HU Liming, et al. Antioxidant activity and oxygen-scavenging system in orange pulp during fruit ripening and maturation[J]. Scientia Horticulturae, 2007, 113(2): 166-172.
[20] 郑仕宏, 张海德, 何双, 等. Folin-Ciocalteus法测定槟榔中多酚含量的研究[J]. 中南林业科技大学学报, 2009, 29(6): 165-169.
[21] WANG S y, CHEN C T, WANG C y. The influence of light and maturity on fruit quality and fl avonoid content of red raspberries[J]. Food Chemistry, 2009, 112(3): 676-684.
[22] BLOIS M S. Antioxidant determination by the use of a stable free radical[J]. Nature, 1958, 181: 1199-1200.
[23] CONSTANTINE N G, STANLEy K R. Superoxide dismutases[J]. Plant Physiology, 1977, 59: 309-314.
[24] PÉREZ AG, SANZ C, OLÌAS R, et al. Lipoxygenase and hydroperoxidelyase activities in ripening strawberry fruits[J]. Journal of Agriculture and Food Chemistry, 1999, 47: 249-253.
[25] JIMENEZ A, HERNANDEZ J A, RIO L A D, et al. Evidence for the presence of the ascorbate-glutathione cycle in mitochondria and peroxisomes of pea leaves[J]. Plant Physiology, 1997, 114(1): 275-284.
[26] JIANG Aili, TIAN Shiping, XU yong. Effects of controlled atmospheres with high-O2or high CO2concentrations on postharvest physiology and storability of “Napoleon” sweet cherry[J]. Acta Botanica Sinica, 2002, 44(8): 925-930.
[27] WAITE J H. Calculating extinction coefficients for enzymatically produced o-quinones[J]. Analytical Biochemistry, 1976, 75: 211-218.
[28] 谢兆森, 曹红梅, 王世平. 影响葡萄果实品质的因素分析及栽培管理[J]. 河南农业科学, 2011, 40(3): 125-128.
[29] 曹颖, 郜海燕, 陈杭君, 等. 荔枝加工品质评价研究进展[J]. 中国食品学报, 2012, 11(8): 126-132.
[30] 程双, 胡文忠, 马跃, 等. 鲜切果蔬酶促褐变发生机理的研究[J]. 食品工业科技, 2010, 31(1): 74-77; 80.
Multivariate Statistical Analysis of the Effect of UV Treatment on Quality and Reactive Oxygen Metabolism of Garlic Sprouts
WANG You-sheng1, CAI Qi-wei1, GU Zu-chen1, LI Bing-xia1, YANG Hong-wei1, CHEN Xiao-yan1, LI Li-ping1, WANG Gui-xi2,*
(1. Beijing Engineering and Technology Research Center of Food Additives, Beijing Laboratory for Food Quality and Safety, School of Food and Chemical Engineering, Beijing Technology and Business University, Beijing 100048, China; 2. State Forestry Administration Key Laboratory of Tree Breeding and Cultivation, Research Institute of Forestry, Chinese Academy of Forestry, Beijing 100091, China)
The effect of UV treatment on quality and reactive oxygen metabolism of garlic sprouts was explored in this study by multivariate analysis. During postharvest storage, the respiration rate of garlic sprouts increased, the color remained yellow, and its quality decreased. The UV treatment accelerated the deterioration process, especially when it was treated with 15 min. The results of principal component analysis (PCA) indicated that a* and b* were the main quality indicators for the deterioration o f garlic sprouts. Meanwhile, H2O2, SOD, MDA, PPO, GSH, total phenolics and anthocyanin were the critical determinant indicators. The results of correlation analysis, path coefficient analysis and partial least squares regression (PLSR) showed that H2O2was strongly correlated with total phenolics in a negative manner and closely related to SOD in a positive manner. In addition, edible rate had a significantly positive relationship with DPPH radical scavenging ability and was significantly negatively correlated with GSH, MDA and anthocyanin content.
garlic sprouts; UV treatment; vegetable quality; reactive oxygen metabolism
TS255.1
A
1002-6630(2014)14-0223-06
10.7506/spkx1002-6630-201414 043
2014-02-17
“十二五”国家科技支撑计划项目(2011BAD24B03)
王友升(1976—),男,副教授,博士,研究方向为食品生物技术。E-mail:wangys@th.btbu.edu.cn
*通信作者:王贵禧(1962—),男,研究员,博士,研究方向为果品采后生物学和贮藏保鲜技术。E-mail:wanggx0114@126.com
