处理发酵剂对促熟干酪中生物胺和游离氨基酸的影响
2014-03-08谢爱英党亚丽
谢爱英,陈 祎,党亚丽*,周 玲
(1.西南大学荣昌校区, 重庆 402460;2.重庆市威士化 工有限公司,重庆 400060;3.浙江省医学科学院保健食品研究所,浙江 杭州 310013)
处理发酵剂对促熟干酪中生物胺和游离氨基酸的影响
谢爱英1,陈 祎2,党亚丽3,*,周 玲1
(1.西南大学荣昌校区, 重庆 402460;2.重庆市威士化工有限公司,重庆 400060;3.浙江省医学科学院保健食品研究所,浙江 杭州 310013)
以0、30、60、90 d促熟干酪中生物胺(组胺、色胺、苯乙胺、尸胺、酪胺)和游离氨基酸含量为指标,研究了添加复合处理发酵剂对干酪产生游离氨基酸和生物胺量的影响。结果表明:不同处理发酵剂添加量对各种生物胺产生的影响不同;添加处理发酵剂干酪中生物胺和游离氨基酸含量增加,其含量随着复合处理发酵剂添加量增加而增加。
促熟干酪;生物胺;游离氨基酸
干酪是以乳、稀奶油、脱脂乳或部分脱脂乳、酪乳或这些原料的混合物为原料,经凝乳酶或其他凝乳剂,并排出部分乳清而制成的新鲜或经发酵成熟的乳制品[1]。干酪中含有丰富的蛋白质、脂肪、矿物质以及多种维生素,是乳制品中营养价值很高的一种产品,在国外被称为“乳品之王”,是世界上乳制品的大宗产品之一。干酪的成熟主要是通过蛋白质、脂肪降解形成干酪独特的风味物质,该过程需在低温条件下3~6 个月完成,其成熟时间较长且费用较高,因此,干酪促熟已成为研究热点。自20世纪50年代以来,人们就不断寻求加速干酪成熟的方法,其基本机理是采用各种物理、化学和生物的方法加快蛋白质和脂肪的分解,在增强干酪的风味、保证风味平衡、感官良好的同时缩短成熟时间。干酪成熟过程中伴随着蛋白质降解为风味物质的小分子肽及游离氨基酸也积累了胺类物质。生物胺(biogenic amine,BA)是生物胺是具有生物活性的有机的、基本的含氮化合物,主要由氨基酸脱羧形成[2]。生物胺可与亚硝酸盐发生反应,生成致癌、致突变、致畸的某些亚硝酸胺类物质,因此摄入过多的生物胺引起人体中毒。采用溶菌酶和超声波复合处理发酵剂促熟干酪中生物胺研究的文献鲜见,本实验拟在干酪制作过程中添加0、0.5%、1%、2%复合处理发酵剂,测定促熟干酪中0、30、60、90 d的主要生物胺和游离氨基酸含量,研究促熟生物胺的生成及干酪蛋白的降解,分析二者关系,为干酪生产及质量控制提供理论依据。
1 材料与方法
1.1材料与试剂
原料乳由重庆市荣昌县远觉镇鑫旺公司提供。
干酪发酵剂FD-DVS R-707、凝乳酶CHY-MAX®M丹麦科汉森公司;溶菌酶(lysozyme,酶活力≥20 000 U/mg);甲醇、乙腈均为色谱纯;水为纯净水;乙醚、丙酮、盐酸、三氯乙酸、氯化钠、碳酸氢钠均为分析纯;标准品:组胺(histamine)、酪胺(tyramine)盐酸盐、色胺(serotonin)、苯乙胺(phenethylamine)、尸胺(codetermine)、1,7-庚二胺、丹磺酰氯 美国Sigma-Aldrich公司。
1.2仪器与设备
JY96-II超声波细胞粉碎机 南京马内利仪器设备有限公司;Avanti J-25贝克曼冷冻离心机 美国贝克曼库尔特有限公司;BvAgilent1100 系列高效液相色谱仪(配有G1311A四元泵、G1321A荧光检测器、G1331A自动进样器、G1316A恒温箱、G1322A在线脱气装置及化学工作站、涡流混合器、0.45 μm针头微孔滤膜过滤器) 日本岛津公司;色谱柱:Ultimate XB-C18(4.6 mm×250 mm,5 μm) 月旭材料科技(上海)有限公司;日立L-8900氨基酸分析仪 日本日立高新技术公司。
1.3方法
1.3.1干酪加工工艺流程
鲜牛乳→标准化→杀菌(在63 ℃杀菌30 min)→冷却至32 ℃→添加2%的发酵剂→调整酸度→加0.02%氯化钙→加凝乳酶→凝块切割→搅拌→加温→排除乳清→添加处理发酵剂→混匀→压榨→成熟→取样
1.3.2发酵剂的处理
取2 g发酵剂添加200 mL脱脂乳,37 ℃培养12 h,添加溶菌酶1.6 kU/mL,在43 ℃条件下酶解1 h,后经超声波处理6 min(120 W,10 ℃)。
1.3.3实验设计
在干酪成熟0、30、60、90 d时,分别取对照(不添加超声波和溶菌酶复合处理的发酵剂)、添加0.5%、1.0%、2.0%复合处理发酵剂的干酪样品编号后密封并放入冰箱中冻藏。取样结束后,统一进行生物胺和游离氨基酸含量的测定。
1.4指标测定
1.4.1生物胺含量的测定
1.4.1.1标准溶液的配制与衍生
参照Martuscelli等[3]方法,组胺、酪胺、苯乙胺、尸胺、色胺标准溶液:分别准确称取0.034 4、0.024 0、0.021 6、0.034 6、0.029 0 g,水溶后定容至100 mL。每份取样0.5 mL与150 μL饱和NaHCO3混合,用150 μL 0.1 mol/L NaOH将pH值调至11.5。将2 mL的10 mg/mL的丹磺酰氯加入到胺的提取液中,混合液在40 ℃振荡保温60 min进行衍生,剩余的丹黄酰氯用300 g/L的氨水200 μL溶解。20 ℃避光条件下保存30 min后用乙腈定容到5 mL,然后过滤。
1.4.1.2色谱条件
采用高效液相法测定生物胺,色谱条件:流动相为水和乙腈,采用梯度洗脱,洗脱程序见表1。流速均为0.8 mL/min,紫外检测波长为254 nm,进样量20 μL,柱温30 ℃。

表1 生物胺衍生样品含量测定的分离洗脱梯度Table 1 Mobile phase gradient program for separation of benzyl derivatives of biogenic amines
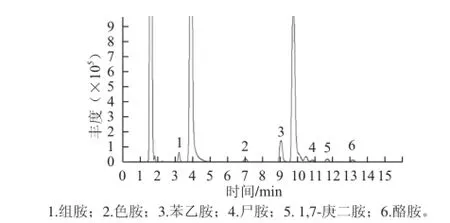
图 l 生物胺标准品衍生物色谱图Fig.1 Chromatogram of derivatives of biogenic amines standards
生物胺标准品衍生物图谱见图l,其出峰顺序:组胺3.00~3.30 min,色胺8.65~8.95 min,苯乙胺9.50~9.80 min,尸胺10.2~10.9 min,酪胺12.8~13.5 min。
1.4.1.3样品预处理
参照刘振锋[4]、刘辰麒[5]等方法进行样品处理,将干酪用研钵研磨均匀,称取5.0 g置于50 mL离心管中,加250 μL内标(1 000 μg/mL庚胺储备液),再加20 mL 0.4 mol/L高氯酸溶液分散,均质1 min,振荡提取5 min,静置5 min,然后采用5 000×g离心35 min;将上清液移入50 mL容量瓶中,用20 mL高氯酸溶液重复提取1 次,上清液合并至相应容量瓶中,用0.4 mol/L高氯酸溶液定容至刻度;取2 mL该溶液,按标准品的衍生方法处理。实验中对每个样品的处理均重复3 次。
1.4.2游离氨基酸含量的测定
委托国家粮食局成都粮油食品饲料质量监督检验测试中心,采用自动氨基酸分析仪测定,所测游离氨基酸包括天冬氨酸、苏氨酸、丝氨酸、谷氨酸、甘氨酸、丙氨酸、胱氨酸、缬氨酸、蛋氨酸、异亮氨酸、亮氨酸、酪氨酸、苯丙氨酸、赖氨酸、组氨酸、精氨酸和脯氨酸。
1.5数据分析
实验数据采用Excel处理,并进行方差分析。
2 结果与分析
2.1不同处理对促熟干酪中生物胺含量的影响
2.1.1不同处理对促熟干酪中组胺含量的影响

图2 不同处理发酵剂添加量对促熟干酪中组胺含量的影响Fig.2 Influence of the modified starter at different levels on histamine content of cheese during ripening
由图2可知,在干酪成熟过程中实验组组胺含量先上升后下降,而对照组的组胺含量不断升高。这可能是因为溶菌酶破壁后再经超声的机械效应和空化效应对细胞的破碎处理,在合适的破壁程度下促进了细胞内酶的释放,加速了蛋白质的降解。另外,干酪中残存微生物含量增加也使干酪中生物胺的含量增加[6-7]。添加不同量复合处理发酵剂对干酪中组胺含量的影响不同,这可能是因为复合处理发酵剂添加量不同释放的蛋白酶量不同。对照组和实验组对比,0~60 d实验组的组胺含量高于对照组,30 d时,实验组添加复合处理发酵剂为1%干酪组胺含量达到最高为249.97 mg/kg;而60~90 d时,实验组组胺含量均低于对照组。添加处理发酵剂可显著(P<0.05)增加成熟期间干酪中组胺含量,其中添加1%和2%处理发酵剂实验组差异不显著,但二者显著高于添加0.5%实验组的组胺含量。实验中组胺含量从0 d开始就比较高,可能与原料乳及原料乳中肠球菌数有关[8]。综上所述,复合处理发酵剂可以影响成熟期间促熟干酪中组胺的生成量,且成熟末期低于未添加复合处理发酵剂的干酪。
2.1.2不同处理对促熟干酪中色胺含量的影响

图3 不同处理发酵剂添加量对促熟干酪中色胺含量的影响Fig.3 Influence of the modified starter at different levels on tryptamine content of cheese during ripening
由图3可知,在0~90 d的成熟期间,添加复合处理发酵剂实验组色胺含量逐渐升高,对照干酪组色胺含量先上升后下降。其中复合处理发酵剂添加为2%的干酪在60~90 d呈持续上升趋势,而添加量为0.5%和1%的在60 d达到最高。这可能原因是添加的溶菌酶和超声复合处理的发酵剂越多,干酪中蛋白酶与微生物含量越多,生成色胺的量越多[9]。对照组和实验组对比,0~60 d时实验组色胺的含量低于对照组的含量,60~90 d时,实验组的色胺含量高于对照组,复合处理发酵剂添加为2%的干酪在90 d时色胺最大值为3.03 mg/kg。0~90 d成熟期间,添加1%和2%处理发酵剂实验组显著(P<0.05)增加了干酪中色胺的含量。综上分析,复合处理发酵剂可以影响成熟期间促熟干酪中色胺的生成量。
2.1.3不同处理对促熟干酪中苯乙胺含量的影响
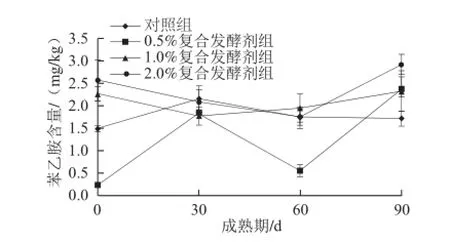
图4 不同处理发酵剂添加量对促熟干酪中苯乙胺含量的影响Fig.4 Influence of the modified starter at different levels on phenethylamine content of cheese during ripening
由图4可知,在成熟的30 d与60 d时实验组干酪与对照组苯乙胺的含量基本持平。在90 d时,添加复合处理发酵剂实验组的苯乙胺含量高于对照组。产生苯乙胺的微生物主要是肠球菌[10]和乳酸菌[11],可能与条件处理发酵剂增加了干酪中的产苯乙胺微生物的数量。其中,添加复合处理发酵剂为2%干酪中苯乙胺含量最高为2.90 mg/kg。0~90 d成熟期间添加处理发酵剂1%和2%显著(P<0.05)增加了促熟干酪中苯乙胺的含量。综上分析,复合处理发酵剂可以影响促熟干酪中苯乙胺的生成量,添加量不同影响效果不同。
2.1.4 不同处理对促熟干酪中尸胺含量的影响
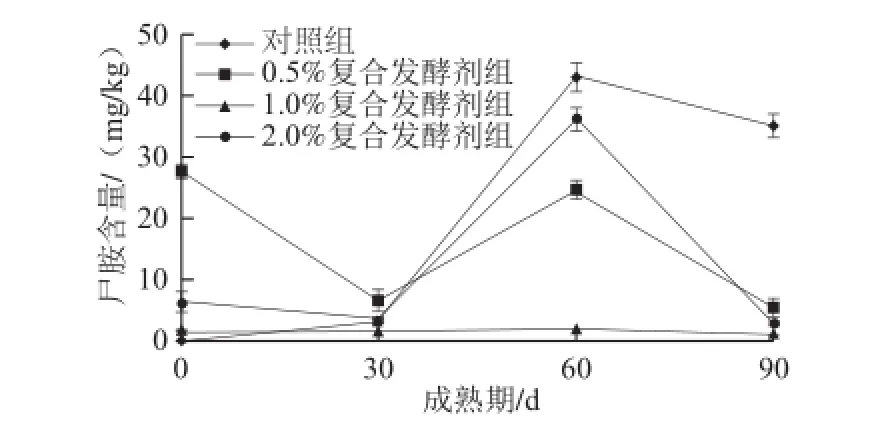
图5 不同处理发酵剂添加量对促熟干酪中尸胺含量的影响Fig.5 Influence of the modified starter at different levels on cadaverine content of cheese during ripening
由图5可知,对照组和添加复合处理发酵剂干酪中尸胺含量都是呈下降、升高、下降趋势。后期下降可能是因为此阶段微生物的生长大量的消耗了氨基酸的量[12],使得能用来产生生物胺的氨基酸的量减少。在30~90 d时,对照组干酪中尸胺含量高于添加复合处理发酵剂干酪中尸胺含量,这可能是因为在干酪成熟后期有部分肠杆菌出现,肠杆菌具有较强的脱羧酶活性,尤其是对于尸胺生成活性较强[13],而在实验组添加了处理发酵剂,对肠杆菌的部分抑制作用也抑制了尸胺的生成。添加处理发酵剂干酪中尸胺的含量显著(P<0.05)低于对照组,添加处理发酵剂1%的干酪在成熟期间尸胺含量没有明显(P>0.05)增加,可能与其受肠杆菌污染较少所致。由上可以看出,添加复合处理发酵剂影响了干酪中尸胺的含量,且在成熟末期促熟干酪低于未添加复合处理发酵剂的干酪。
2.1.5不同处理对促熟干酪中酪胺含量的影响
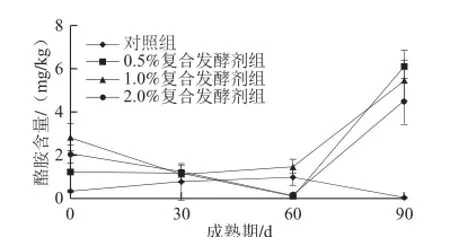
图6 不同处理发酵剂添加量对促熟干酪中酪胺含量的影响Fig.6 Influence of the modified starter at different levels on tyramine content of cheese during ripening
由图6可知,添加复合处理发酵剂干酪中酪胺呈先下降后上升趋势,而对照组干酪中酪胺含量呈先上升后下降趋势。与Komprda等[14]研究的不同,酪胺含量随着成熟期的延长而增加,与成熟期成正相关,可能是干酪中生物胺的含量极大的受干酪种类,成熟时间,制作工艺和微生物的影响[3]。成熟期间添加处理发酵剂的干酪显著(P<0.05)增加了干酪中酪胺的含量,在90 d时添加复合处理发酵剂干酪中酪胺含量高于对照组干酪中酪胺含量,添加0.5%复合处理发酵剂的干酪在90 d时酪胺含量最高为6.09 mg/kg。综上分析,复合处理发酵剂可以增加促熟干酪中酪胺的生成量。
2.2不同添加量的复合处理发酵剂对干酪成熟期间游离氨基酸含量的影响
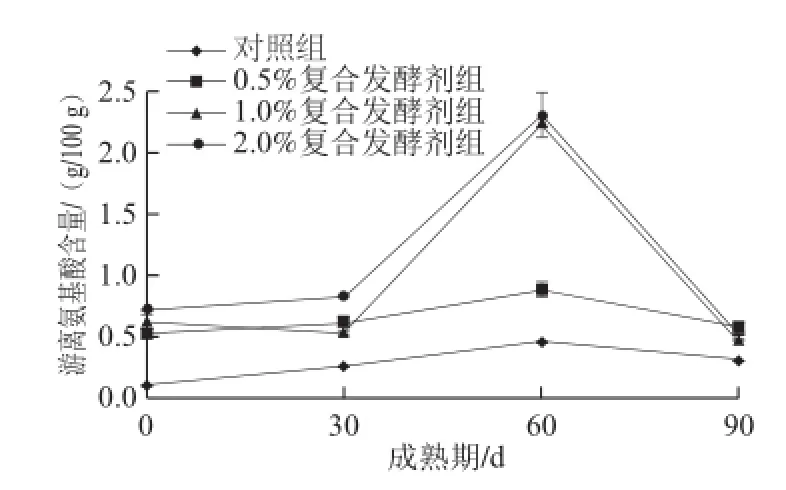
图7 不同处理发酵剂添加量对干酪中的游离氨基酸含量影响Fig.7 Influence of the modified starter at different levels on free amino acid content of cheese during ripening
由图7可知,添加复合处理发酵剂和对照组干酪中游离氨基酸含量都呈先上升后下降趋势,这与Gardini等[10]研究的趋势一致。 其中,干酪成熟的0~30 d游离氨基酸增加不明显,而在30~60 d期间增加较明显,之后下降。可能是因为在成熟前期主要是凝乳酶降解大分子酪蛋白为肽段的过程[15],而复合处理发酵剂增加了干酪中的细胞内酶的含量,其主要作用是水解中间型号的肽[16],因此在30~60 d氨基酸含量增加。而后期由于氨基酸进一步降解为小分子物质而使其含量降低。添加复合处理发酵剂干酪中游离氨基酸含量显著高于(P<0.05)对照组干酪中游离氨基酸含量,且复合添加剂添加量越多游离氨基酸含量也越高。综上分析,添加复合处理发酵剂的含量越多,游离氨基酸生成的量也就越多。
3 讨 论
3.1干酪中添加处理发酵剂对其生物胺含量影响
随着复合处理发酵剂含量增多,干酪中产生的生物胺总量也越多。这可能是复合处理发酵剂增加了干酪成熟过程中蛋白质的分解以及微生物残留不同所致[17-18]。干酪中添加的复合处理发酵剂越多,微生物释放的细胞内蛋白酶的含量就越多,蛋白质降解产生的游离氨基酸越多。蛋白质的降解提高了肽和氨基酸的浓度,为脱羧酶的微生物群提供了胺产生的前体物质[6],这也是导致生物胺含量增加的重要因素。实验中0 d样品中的生物胺和游离氨基酸有所不同,与处理发酵剂有关,因处理发酵剂是采用干粉发酵剂经过培养后,经过溶菌酶和超声波复合处理,该过程中会产生部分胺类物质和游离氨基酸。另外,在干酪制作过程中,不同的样品处理有所差别,在凝乳中添加处理发酵剂的过程中,除了增加干酪中发酵剂微生物及其酶的含量外,也增加了少数非发酵剂微生物的含量,这些微生物及其分泌酶的作用使得0 d样品中的生物胺和游离氨基酸含量不同。
3.2干酪成熟的时间不同产生生物胺的总量也不同
成熟时间也是影响干酪中生物胺含量的一个重要因素。在干酪成熟60 d时添加0.5%复合处理发酵剂产生生物胺的总量最多,为257.18 mg/kg,低于常规干酪生物胺含量[19-20],其他干酪在成熟30 d时生物胺含量最高,对照、0.5%和2%分别为51.57、127.13、213.11 mg/kg,低于半硬质干酪中生物胺含量[17]。在成熟90 d时,干酪中生物胺的总量降低,与氨基酸底物[12]及微生物胺氧化酶[3]有关。
4 结 论
通过测定0、30、60、90 d促熟干酪中生物胺含量的研究,表明干酪中添加复合处理发酵剂对不同种类生物胺含量的影响不同。添加复合处理发酵剂可增加干酪中生物胺的总量;随着复合处理发酵剂添加量的增加,产生生物胺的总量也逐渐上升,30 d或60 d时达最高。复合处理发酵剂对游离氨基酸的影响与生物胺总量相同。
[1] 顾瑞霞. 乳与乳制品工艺学[M]. 北京: 中国计量出版社, 2006: 220.
[2] LINARES D M, MARTI M C, LADERO V, et al. Biogenic amines in dairy products[J]. Critical Reviews in Food Science and Nutrition, 2011, 51(7): 691-703.
[3] MARTUSCELLI M, GARDINI F, TORRIANI S, et al. Production of biogenic amines during the ripening of Pecorino Abruzzese cheese[J]. International Dairy Journal, 2005, 15(6/9): 571-578.
[4] 刘振锋, 魏云潇, 张进杰, 等. 高效液相色谱法检测中国传统发酵豆腐制品中的生物胺[J]. 中国食品学报, 2010, 10(4): 253-259.
[5] 刘辰麒, 王锡昌, 丁卓平. 水产品中生物胺的测定方法[J]. 上海水产大学学报, 2007, 16(4): 357-361.
[6] LEUSCHNER R G K, KUIHARA R, HAMMES W P. Effect of enhanced proteolysis on formation of biogenic amines by lactobacilli during Gouda cheese ripening[J]. International Journal of Food Microbiology, 1998, 44(1/2): 15-20.
[7] 杨健, 吴祖芳. 食品中产组胺微生物及其控制的研究进展[J]. 食品工业科技, 2012, 33(3): 384-387.
[8] KALHOTKA L, MANGA I, PRICHYSTALOVA J, et al. Decarboxylase activity test of the genus Enterococcus isolated from goat milk and cheese[J]. Acta Veteriaria Brno, 2012, 81(2): 145-151.
[9] 李志军, 吴永宁, 薛长湖. 生物胺与食品安全[J]. 食品与发酵工业, 2004, 30(10): 84-91.
[10] GARDINI F, MARTUSCELLI M, CARUSO M C, et al. Effects of pH, temperature and NaCl concentration on the growth kinetics, proteolytic activity and biogenic amine production of Enterococcus faecalis[J]. International Journal of Food Microbiology, 2001, 64(1/2): 105-117.
[11] DELBES-PAUS C, POCHET S, HELINCK S, et al. Impact of gramnegative bacteria in interaction with a complex microbial consortium on biogenic amine content and sensory characteristics of an uncooked pressed cheese[J]. Food Microbiology, 2012, 30(1): 74-82.
[12] SERVAAS V. Proteolytie enzymes and their relation to cheese ripening and flavor[J]. Journal of Dairy Science, 1993, 76(1): 329-350.
[13] SCHIRONE M, TOFALO R, MAZZONE G, et al. Biogenic amine content and microbiological pro le of Pecorino di Farindola cheese[J]. Food Microbiology, 2011, 28(1): 128-136.
[14] KOMPRDA T, SME-LA D, NOVICKA K, et al. Content and distribution of biogenic amines in dutch-type gard cheese[J]. Food Chemistry, 2007, 102(1): 129-137.
[15] GOROSTIZA A, CICHOSCKI A J, VALDUGA A T, et al. Changes in soluble nitrogenous compounds, caseins and free amino acids during ripening of Artisanal Prato cheese; a Brazilian Semi-hard cows variety[J]. Food Chemistry, 2004, 85(3): 407-414.
[16] 谢爱英. 溶菌酶和超声处理发酵剂及其加速干酪成熟的研究[D]. 西安: 陕西师范大学, 2006.
[17] GARMIENE G, SALOMSKIENE J, STANKIENE J, et al. Changing of biogenic amine content in cheese during its manufacture[J]. Milchwissenschaft-milk Science, 2012, 67(3): 308-311.
[18] 张国农, 顾瑞峰. 干酪中的生物胺[J]. 中国乳品工业, 2005, 33(1): 38-42.
[19] SPIZZIRRI U G, RESTUCCIA D, CURCIO M, et al. Determination of biogenic amines in different cheese samples by LC with evaporative light scattering detector[J]. Journal of Food Composition and Analysis, 2013, 29(1): 43-51.
[20] INNOCENTE N, D’AGOSTIN P. Formation of biogenic amines in a typical semi-hard Italian cheese[J]. Journal of Food Protection, 2002, 65(6): 1498-1501.
Effect of Modified Starter on Biogenic Amines and Free Amino Acids during the Accelerated Ripening of Cheese
XIE Ai-ying1, CHEN Yi2, DANG Ya-li3,*, ZHOU Ling1
(1. Rongchang Campus, Southwest University, Chongqing 402460, China; 2. Chongqing Weishi Chemical Industry Co. Ltd., Chongqing 400060, China; 3. Institute of Health Food, Zhejiang Academy of Medical Sciences, Hangzhou 310013, China)
The starter culture used for producing cheese in this study was modified by sequential treatment with lysozyme and then ultrasonic irradiation after culture in the presence of skim milk, and the modified product was added at different levels to the cheese to accelerate the ripening process. By doing so, this study aimed t o examine the effect of the modified starter on the formation of free amino acids and biogenic amines including histamine, tyramine, phenylethylamine, tryptamine and cadaverine during the accelerated ripening of cheese. The contents of these compounds after 0, 30, 60 and 90 days of ripening were determined. Results showed that the contents of biogenic amine and free amino acids were higher in cheese ripened with the modified starter than in the control group during cheese ageing, indicating that the addition of the modified starter can result in higher contents of biogenic amines and free amino acids in a concentration-dependent manner.
cheese; biogenic amines; free amino acids
TS252.53
A
1002-6630(2014)15-0188-05
10.7506/spkx1002-6630-201415038
2013-07-16
中央高校基本科研业务费专项资金项目(XDJK2010C015);浙江省卫生厅一般计划研究项目(2011KYB002);
国家自然科学基金青年科学基金项目(31101344)
谢爱英(1973—),女,讲师,硕士,研究方向为畜产品加工。E-mail:xay086@126.com
*通信作者:党亚丽(1978—),女,副研究员,博士,研究方向为生物活性肽与保健食品开发。E-mail:dangyali1978@126.com
