光阻法检查冻干粉针剂不溶性微粒的影响因素分析
2014-03-08李明慧满春兰郭明娟夏肖丽吴彦丽
李明慧,满春兰,郭明娟,夏肖丽,吴彦丽,李 锐
(山东北大高科华泰制药有限公司,山东蓬莱265600)
·制剂研究·
光阻法检查冻干粉针剂不溶性微粒的影响因素分析
李明慧,满春兰,郭明娟,夏肖丽,吴彦丽,李 锐
(山东北大高科华泰制药有限公司,山东蓬莱265600)
目的探讨冻干粉针剂产品不溶性微粒在检测过程中的影响因素。方法通过不同体积、不同溶剂复溶冻干粉针剂,利用搅拌与否和不同的进样方式,测定不溶性微粒的数据。结果与结论采用不同的复溶溶剂、复溶溶剂的体积、进样方式及搅拌等均会影响不溶性微粒的检验数据,操作过程中需要注意这些因素对检测数据的影响。
光阻法;冻干粉针剂;不溶性微粒;检测;影响因素
注射剂中不溶性微粒是指药物在生产或应用中经过各种途径污染的微小颗粒杂质,其粒径在1~50μm之间,是肉眼不可见、易动性的非代谢性的有害粒子。大量的动物试验和人体解剖证明,不溶性微粒会产生一时难以发现的、潜在的严重危害,主要有:造成血管栓塞、诱发静脉炎、导致肉芽肿形成、引发肺动脉高压和输液反应[1],严重影响到病人的用药安全。
早在《中国药典》1985年版就用显微计数法进行注射液中不溶性微粒的检查,《中国药典》2000年版,不溶性微粒检查新增光阻法,《中国药典》2005年版针对小容量注射剂提出检查要求[2]。光阻法检查注射剂中不溶性微粒的原理:当液体中的微粒通过一窄小的检测区时,与液体流向垂直的入射光,由于被微粒阻挡而减弱,因此由传感器输出的信号降低,这种信号变化与微粒的截面积大小相关[3]。《中国药典》2010年版(二部)对冻干粉针剂的不溶性微粒有详细的规定:100 mL以下的静脉用注射液、静脉注射用无菌粉末及注射用浓溶液规定,每个容器中含10μm以上的微粒不得超过6 000个,含25μm以上的微粒不得超过600个[3]。在生产环节中,可见异物和不溶性微粒的产生有相同的途径,主要有:工艺用水、原辅材料、西林瓶胶塞、药液过滤系统、空气净化系统等[4,5],这些因素对产品的质量有至关重要的影响。此外,笔者通过长期的不溶性微粒项目的检测,发现检测过程对不溶性微粒的测定数据也有较大的影响。主要从样品的溶解和测定两个方面分析。
1 仪器与试药
1.1 仪器 单人净化工作台(苏州自动化仪器仪表研究所);GWF-5JA激光微粒分析仪(天津天河医疗仪器有限公司);一次性塑料注射器等。
1.2 试药 0.9%氯化钠注射液(批号:6B13092705),5%葡萄糖注射液(批号:2D13082701),乳酸钠林格注射液(批号:1C13092207),所有注射液均来自山东齐都药业有限公司;注射用门冬氨酸钾镁(规格:1 g∶1 g,批号:1304176、1304217、1310187);注射用克林霉素磷酸酯(规格:0.3 g,批号:1401156;规格:0.9 g,批号:1401176、1401187);注射用埃索美拉唑钠(规格:40 mg,批号:1301166);注射用泮托拉唑钠(规格:40mg,批号:1310148、1403247),以上所有制剂均来自山东北大高科华泰制药有限公司。微粒检查用水:取注射用水适量,使用前须经0.22 μm的水系滤膜过滤,置洁净的适宜容器中,搅拌,混匀,静置后测定,每10 mL中10μm以上的微粒应在10粒以下,25μm以上的微粒应在2粒以下[6]。
1.3 统计学处理 采用SPSS 17.0统计软件进行统计分析。检测数据以均值±标准差(±s)表示,表1、3、5采用F检验,表2、4采用t检验,P<0.05认为有显著性差异。
2 实验方法与结果
2.1 溶解过程
2.1.1 复溶溶剂 冻干粉针剂在检测不溶性微粒时,需要复溶,某些品种对溶剂的选择有严格的依赖性,通过对注射用埃索美拉唑钠在0.9%氯化钠注射液、5%葡萄糖注射液、乳酸钠林格注射液3种溶剂中复溶,按照不溶性微粒检查法操作,测定结果见表1。

表1 注射用埃索美拉唑钠不同溶剂复溶样品的微粒检测结果(n=5,微粒数:个/瓶)
2.1.2 复溶操作 冻干粉针剂复溶过程要根据药品本身的性质,选择适宜的复溶操作幅度[7]。注射用克林霉素磷酸酯、注射用泮托拉唑钠在自然溶解和强烈振摇复溶时,测定的结果差异显著,而注射用门冬氨酸钾镁则没有显著区别,测定结果见表2。
表2 不同复溶操作的样品检测结果(n=5,±s,微粒数:个/瓶)
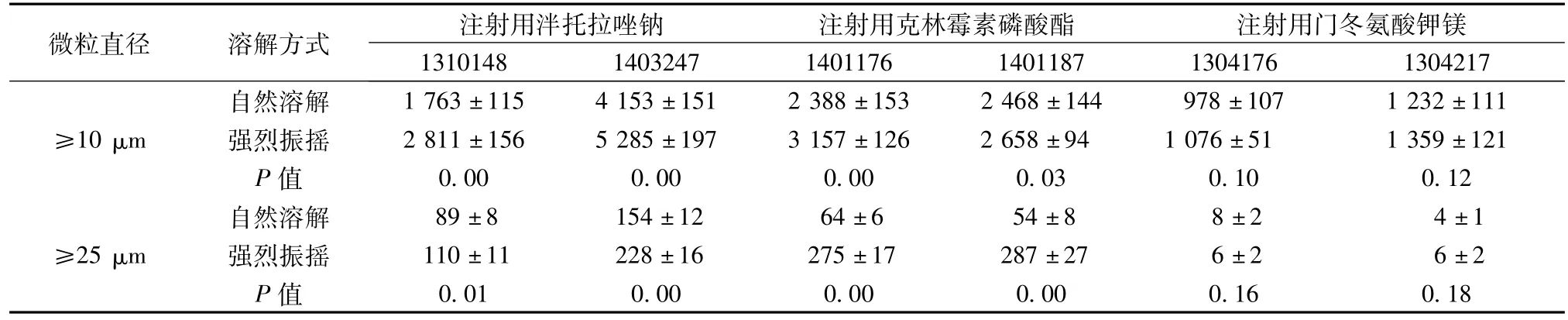
表2 不同复溶操作的样品检测结果(n=5,±s,微粒数:个/瓶)
微粒直径 溶解方式1 232±111≥10μm 强烈振摇 2 811±156 5 285±197 3 157±126 2 658±94 1 076±51 1 359±121 P值 0.00 0.00 0.00 0.03 0.10 0.12自然溶解 89±8 154±12 64±6 54±8 8±2 4±1≥25μm 强烈振摇 110±11 228±16 275±17 287±27 6±2 6±2 P值217自然溶解 1 763±115 4 153±151 2 388±153 2 468±144 978±107注射用泮托拉唑钠 注射用克林霉素磷酸酯 注射用门冬氨酸钾镁1310148 1403247 1401176 1401187 1304176 1304 0.01 0.00 0.00 0.00 0.16 0.18
2.1.3 复溶体积 某些品种,如:注射用埃索美拉唑钠、注射用克林霉素磷酸酯、注射用门冬氨酸钾镁等稀释至不同的体积时,微粒检测数据有显著的差异,测定结果见表3。
表3 复溶至不同体积的样品检测结果(n=5,±s,微粒数:个/瓶)

表3 复溶至不同体积的样品检测结果(n=5,±s,微粒数:个/瓶)
注:aP>0.05,即两组比较没有显著性差异
品种 批号 微粒直径 溶解体积(mL)5 10 15 20 50 P值注射用埃 ≥10μ索美拉唑钠注射用门冬氨酸钾镁1301166 1310187注射用克林1401156霉素磷酸酯0.00 1401176 m 214±21 / / / 755±55 0.00≥25μm 26±4 / / / 165±15 0.00≥10μm / 1 333±125 974±95a 1 006±95a / 0.00≥25μm / 40±6 6±2a 10±2a / 0.00≥10μm 2 442±120 1247±98a1 362±100a / / 0.00≥25μm 69±8 29±5a 36±6a / / 0.00≥10μm / 3 154±108 2 388±153a2 248±156a / 0.00≥25μm / 116±11 64±6a 57±8a/
2 测定过程
2.2.1 进样方法 药典规定:针对静脉注射用冻干粉针剂检查法有两种进样方法可供选择:①单支进样:取3~5瓶样品,每瓶样品用定量的微粒检查用水复溶后直接进样测定;②合并溶液进样:取3~5瓶样品,用定量微粒检查用水复溶后合并入一个容器中,混合搅拌后进样测定。采用方法①,第一瓶的检测数据弃去,后续测定结果取平均值,作为样品的检测结果,此法可以体现出供试品每瓶之间的差异,但是样品不能全部被吸入,否则容易在管路中产生气泡。虽然,最后的计算结果考虑体积的折算,但是不能完全准确地体现样品的真实情况。针对水溶性较差的样品,与管路的水相混时,可能会在局部析出沉淀,不仅使检测结果偏高,甚至造成管路堵塞。采用方法②,实际操作时会因为操作人员的手法不同增加污染几率,但是此法相比方法①能够保证溶液的均一性,更真实地反映整批产品的微粒情况[8]。只要在实验操作中注意操作技巧,此法在进行冻干粉针剂产品检查时不失为比较优越的方法,测定结果见表4。
表4 不同进样方法的样品检测结果(n=5,±s,微粒数:个/瓶)

表4 不同进样方法的样品检测结果(n=5,±s,微粒数:个/瓶)
微粒直径 溶解方式18±84≥10μm 合并进样 1 763±115 4 153±151 2 388±153 2 468±144 978±107 1 232±111 P值 0.00 0.00 0.00 0.00 0.00 0.00单支进样 21±4 70±10 46±6 29±6 20±4 36±7≥25μm 合并进样 89±8 154±13 64±6 54±8 8±2 4±1 P值217单支进样 1 108±127 1 468±151 1 329±122 2 021±186 640±79 7注射用泮托拉唑钠 注射用克林霉素磷酸酯 注射用门冬氨酸钾镁1310148 1403247 1401176 1401187 1304176 1304 0.00 0.00 0.00 0.00 0.00 0.00
2.2.2 搅拌的重要性 搅拌能够保证采集样品的均一,某些品种微粒检查数据对搅拌与否没有太大的依赖性,但是诸如注射用门冬氨酸钾镁因为其溶解度的问题,如果在实验操作时不开动搅拌模式,同一容器上层的检测数据和下层的检测数据会有很大的差别,检测结果见表5。开启搅拌要选择合适的转速,以溶液不产生气泡为宜,常规选择100 rpm左右的转速[9]。
表5 注射用门冬氨酸钾镁搅拌与否的检测结果(n=5,±s,微粒数:个/瓶)

表5 注射用门冬氨酸钾镁搅拌与否的检测结果(n=5,±s,微粒数:个/瓶)
注:*P>0.05,即两组比较没有显著性差异
批号 微粒直径 上层溶液 中层溶液 下层溶液 最底层溶液 P值1304176(未搅拌) ≥10μm 21±6 18±6 24±9 28±6 0.15 900±28 1 635±48 4 218±68 8 622±77 0.00≥25μm 11±1a* 15±2* 104±9 213±13 0.00 1304176(搅拌) ≥10μm 1 607±122 1 537±108 1 665±133 1 537±120 0.31≥25μm 21±8 16±5 27±6 18±6 0.07 1310187(未搅拌) ≥10μm 862±42 1 520±58 2 878±77 4 408±91 0.00≥25μm 10±2 21±2*26±2* 280±13 0.00 1310187(搅拌) ≥10μm 1 439±105 1 392±82 1 408±91 1 507±90 0.25≥25μm
3 结论
冻干粉针剂产品不溶性微粒检查结果除了与样品本身所使用的原辅料、包装材料、工艺用水、生产环境系统等因素相关,实验室的操作在相当程度上也影响检测结果。结合工作经验,总结冻干粉针剂不溶性微粒检测过程中的影响因素:
3.1 同一产品与不同溶剂配伍时,不溶性微粒检测数据会有很大的差异,这就要求在制定质量标准时,尽量选择与实际用药配伍一致的溶剂作为实验项目的检测溶剂[10],复溶体积要根据样品的性质和临床使用途径来选择,最大限度地模拟药品进入人体的状态,准确有效地监测用药过程的不溶性微粒的数据变化。
3.2 不同样品在进行冻干粉针剂不溶性微粒检测时,操作幅度的强烈与否对不溶性微粒的影响不一致,但是为了检测结果的准确性,复溶操作时要轻缓,沿容器壁加入复溶溶剂,尽量减少人为因素对不溶性微粒的影响。
3.3 针对黏度过高和易析晶的产品,选择合适的浓度进行检测相当重要,否则极易导致检测数据的准确度不高和造成仪器故障[11]。
3.4 在合并溶液进样法中选择适宜搅拌速度能够达到样品均一、稳定,准确反映出样品的真实情况。
[1]王冰,张梅英.防范静脉输液中不溶性微粒危害的研究进展[J].上海护理,2009,9(1):63-66.
[2]付艳.注射液中不溶性微粒检查方法[J].中国粉体技术,2008,14(专辑):238-239.
[3]国家药典委员会.中华人民共和国药典2010年版(二部)[S].北京:中国医药科技出版社,2010:附录71-73.
[4]余慕芳.无菌粉针剂生产中不溶性微粒的控制[J].华北煤炭医学院学报,2004,6(6):724-725.
[5]付丽杰,杨丹凤,刘桢.冻干粉针剂产品可见异物的影响因素及其控制[J].中国药事,2011,25(3):292-294. [6]中国药品生物制品检定所,中国药品检验总所.中国药品检验标准操作规范(2010年版)[M].北京:中国医药科技出版社,2010:249-253.
[7]陈瑞芳.不同条件下几种抗菌药物和中药注射粉针不溶性微粒的实验研究[D].长沙:中南大学,2013.
[8]王晖,徐腾.小容量注射液不溶性微粒检查取样方法的考察[J].解放军药学学报,2009,25(4):376.
[9]林玲,尹玮璐.抗生素类注射剂的不溶性微粒质量考察[J].广东药学院学报,2010,26(1):58-60.
[10]侯鹏高,吕长淮.静脉输液不溶性微粒污染途径及控制方法研究进展[J].医学信息(中旬刊),2011,24(3):1236-1237.
[11]吕长淮,吴玮,胡丹.光阻法检查注射液中不溶性微粒影响因素分析[J].中国医药导报,2010,7(26):14-15.
Influencing factors of using light blockage inspection to measure insoluble particles of freeze dried powder for injection
LIMing-hui,MAN Chun-lan,GUO Ming-juan,XIA Xiao-li,WU Yan-li,LIRui
(Shandong PKU High-tech Huatai Pharmaceutical Co.,Ltd.,Penglai265600,China)
ObjectiveTo discuss the influencing factors of using light blockage inspection tomeasure insoluble particles of freeze dried powder for injection.MethodsUsing different volume and different solvent to dissolve freeze dried powder for injection and using stirring or not and different injectionmode tomeasure the quantity of insoluble particles.ResultsandConclusiondifferent kinds of solvent,different volume of solvent,injectionmode and stirring or notwere all influence the quantity of insoluble particles.So we should pay attention to the influencing factors to test results in operation process.
Light blockagemethod;Freeze dried powder for injection;Insoluble particles;Inspection;Influencing factors
R927.11
A
2095-5375(2014)09-0525-004
李明慧,女,研究方向:药物分析,E-mail:1040310436@qq.com
