纤维素降解真菌的分离鉴定及特性研究
2014-03-07冉杰
冉杰
(中油辽河油田分公司冷家油田开发公司,辽宁 盘锦 124109)
随着化石燃料由短缺变枯竭,能源成为人类面临的共同问题。寻找新的能量来源关系到经济的可持续发展乃至人类的生存问题。纤维素与化石燃料不同,它是一种可再生的资源。地球上每年光合作用可产生大约100亿t的植物干物质,其中一半以上是纤维素和半纤维素[1],而在我国约有一半以上的农作物秸秆在田间地头被白白烧掉[2]。如果能有效地利用生物转化技术将这些纤维素转化成糖类,再发酵产生燃料乙醇、生物氢等能源物质,不仅可以变废为宝,而且还可以避免由于化石燃料燃烧所带来的环境污染,更重要的是可以缓解或解决石化能源短缺乃至枯竭所带来世界性能源危机[3]。
以淀粉和糖类物质为底物,通过微生物发酵产生燃料乙醇的技术已经工业化,国内已经有4家年产30万t以上的燃料乙醇企业。生物质资源化主要集中于秸杆(纤维素)等生物质的降解和糖化研究。对于秸杆的糖化,国内外研究仍处于实验阶段,之所以无法大规模化生产,主要因为缺乏高效糖化菌株。基于此,高效糖化菌株的筛选及生理特性的研究已经成为生物质能源化过程的焦点问题。
为此,笔者通过筛选、检测、鉴定等研究获得1株能够以纤维素为唯一碳源、产生还原糖的高活性真菌菌株,并对其发酵特性等进行了进一步探讨,为秸杆等天然纤维素的利用创造了条件。
1 材料与方法
1.1 样品
用于分离纤维素降解真菌的样品为黄牛的粪便,采自山东省即墨市大村。即墨是全国最大的秸秆养牛基地,私人散养黄牛食秸秆量较大,其粪便中更可能分离出来可以降解纤维素的高效菌株。将黄牛粪便装入自封袋中,运到实验室后,立即进行菌株的分离。
1.2 培养基
1.2.1 初筛滤纸条培养基
直径16mm,长160mm试管中装无机盐培养基(w/v)[4]:K2HPO40.20%,KH2PO40.10%,(NH4)2SO40.1%,MgSO4·7H2O 0.05%,酵母膏0.01%,pH值自然,再放入70mm×10mm的滤纸条一张,使其紧靠在试管内壁底部,上端露出液面10 mm左右。
1.2.2 固体筛选培养基
羧甲基纤维素钠(CMC-Na)15.0 g,NH4NO31.0 g,MgSO4·7H2O 0.5 g,KH2PO41.0 g,琼脂18 g,加去离子水至总体积1 000ml,pH值自然。
1.2.3 刚果红纤维素培养基
采用1.2.2培养基,用0.10%(w/v)刚果红溶液浸染,半小时后,菌群周围若出现透明圈,证明该菌有降解纤维素的功能。
1.2.4 纤维素降解液体培养基
采用1.2.2培养基,不加琼脂,分别用滤纸、秸秆、脱酯棉代替CMC-Na,以筛选最适碳源底物。
1.2.5 查氏培养基
NaNO32 g;K2HPO41 g;KCl 0.5 g;MgSO40.5 g;FeSO40.01 g;蔗糖30 g;固体培养基加琼脂18 g;加去离子水至总体积1 000 ml;pH自然。
1.3 分离方法
将采集的样品用无菌水按1:10充分溶解稀释后,吸取上清液加入滤纸条初筛培养基中,于30℃静置培养,定期目测滤纸条溃烂情况,选取滤纸溃烂显著的样品进行纤维素降解菌株的筛选。吸取滤纸溃烂显著的样品10~100μl涂布于固体筛选培养基,30℃倒置培养,观察是否有菌株出现,对生长的菌株通过点种的方法接种于刚果红纤维素培养基,于30℃倒置培养2 d,检测是否出现透明水解圈,选择透明圈直径较大的菌落进行后续实验。
1.4 降解特性
采用纤维素降解培养基,按0.1%接种受试菌株,于30℃、200 rpm条件下培养3 d,分别采用称重和3,5-二硝基水杨酸(DNS)还原糖显色法[5]检测菌株对不同碳源的降解能力,以及影响纤维素降解的pH条件。
1.5 菌株的鉴定
1.5.1 形态鉴定
接种待鉴定菌株于查氏培养基,30℃倒置培养2 d,于无菌条件下刮一环菌苔,置于载玻片上,用1%的刃天青染色后,显微镜照,将形态与真菌分类鉴定手册进行比较,初步确定其分类地位。
1.5.2 18S rRNA基因鉴定
按文献[5]报道,将液体查氏培养2 d的菌株,采用氯化苄法提取总DNA,采用真菌18S rRNA基因通用引物扩增18S rRNA基因,克隆到pMD18-T载体中后,进行测序。通过GenBank中Blast程序,对所测序列进行比对、分类。
2 实验结果与讨论
2.1 菌株的分离鉴定及特征
采用初筛滤纸条培养基检测培养物中是否存在纤维素降解微生物,发现其中2个试管内浸入培养液的滤纸降解明显,表明该样品中可能存在纤维素降解菌。将这2个试管培养物通过固体平板分离,出现2株菌苔完全不同的纤维素降解菌,分别命名为CD-Q1和CD-Q2。CD-Q1生长初期菌丝较白,菌丝体稠密不易扩散,2 d后菌苔顶部出现黄绿色孢子粉,不分泌色素。CD-Q2的菌丝呈现纯白色,在平板内快速蔓延至整个平板,菌丝较细,生长2 d后也无变化,2株菌均表现出典型的真菌特征,故初步判断2株菌为纤维素降解真菌。
为检测2株真菌对纤维素的降解能力,采用刚果红纤维素培养基培养上述2菌2 d后,采用0.10%刚果红检测纤维素降解圈。发现CD-Q1能够形成非常明显的纤维素降解透明圈,透明圈直径/菌落直径显著高于CD-Q2。故此,研究将继续以CD-Q1为对象进行深入分析。
取CD-Q1接种于查氏液体培养基中,30℃,200 rpm振荡培养后,发现菌体相互缠绕成球状,极难打散,直径2~5 mm,色泽较白,可沉淀于瓶底(见图1)。纤维素降解真菌CD-Q1的这种特性在实际应用中是极为有益的,这样发酵过程中更容易将糖化液分离出来,而不需要复杂的工艺手段,同时对保持生物量,维持系统稳定也具有重要意义。

图1 真菌CD-Q 1在液体发酵过程中形成的球体
取在查氏平板培养基生长2 d的CD-Q1于显微镜下进行观察,结果如图2。发现菌丝丛生,无隔膜,有明显的头状孢子囊及孔子梗,通过与分类手册比较,与根霉属真菌最为相似,故进一步判断该真菌为接合菌亚门、接合菌纲、毛霉目、毛霉科中的根霉属(Rhizopus)。为确定该真菌的分类地位,又对该菌进行了18S rRNA基因分类。
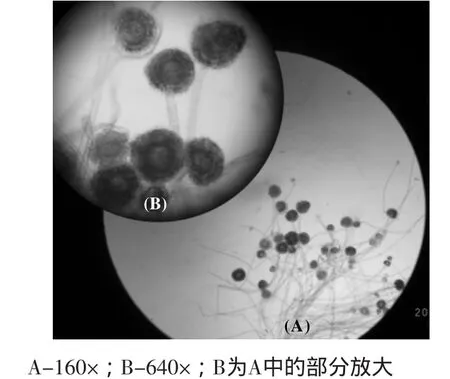
图2 真菌CD-Q 1的显微照片
DNA提取和PCR扩增表明已得到长度约23 kb的总DNA和1.8 kb的18S rRNA基因。基因序列比对分析表明,该菌的18S rRNA基因同匍匐根霉最相似,相似度为99%。以上分析表明,获得的纤维降解真菌为匍匐根霉[6]。
2.2 最佳降解碳源的选择
采用烘干称重的方法检测真菌CD-Q1对滤纸、秸秆(采自五子顶)和脱脂棉的利用能力,每组设置3个平行实验,在震荡培养8 d后,滤纸和秸秆出现较明显的腐蚀降解现象,干物质失重结果见图3。脱酯棉降解组中出现负值的原因可能是菌体自身重量增加,过滤无法将其去除。秸秆降解组中1个平行样未获得数据。实验结果表明,该真菌对脱脂棉的降解效率不佳,对滤纸的降解效率居中,但较稳定;对秸秆的降解效率最高。但由于秸秆成分复杂,失重现象极有可能是部分物质溶解在培养液中所致,故此,对该实验的研究还应以还原糖产生数量为主要参考依据,还需深入分析。以上分析表明,该菌能够以滤纸、秸秆和脱酯棉为唯一碳源生长,8 d内可将26.5%的秸秆降解,可将7.5%的滤纸糖化。
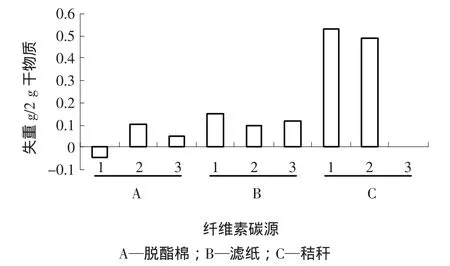
图3 真菌CD-Q 1对不同碳源的利用
2.3 最佳降解pH条件
以葡萄糖浓度-吸光度标准曲为基准,对不同pH条件下真菌CD-Q1对滤纸的降解及还原糖(以葡萄糖计)的产生进行了分析,结果见图4。以滤纸为唯一碳源,发酵试验表明,pH=5时滤纸失重及还原糖产生量最高,45 h内可将3%滤纸降解,生成0.845 mg/ml的还原糖(以葡萄糖计)。分析原因,在酸性条件下,滤纸可以被更充分地溶解成微纤颗粒,从而更容易被利用,另外真菌本身更适于在低pH条件下生存。该研究表明,如果将秸秆在糖化发酵前进行酸解,将对发酵更有利,纤维素利用率会更高。
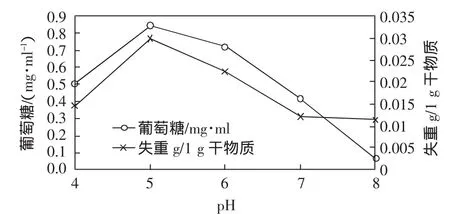
图4 不同pH条件下真菌CD-Q1对滤纸的降解及还原糖(以葡萄糖计)的产生
3 结论
经过实验分离到一株纤维素降解真菌CDQ1,通过形态及分子生物学鉴定该真菌为匍匐根霉。该菌能够以滤纸、秸秆和脱酯棉为唯一碳源生长,8 d内可将26.5%的秸秆降解,可将7.5%的滤纸糖化。当以滤纸为唯一碳源时,通过发酵试验表明,pH=5的条件下,滤纸失重及还原糖产生量最高,45 h内可将3%滤纸降解,生成0.845 mg/ml的还原糖(以葡萄糖计)。该研究为纤维素糖化提供了良好的出发菌株,为纤维素酶的获得提供了菌源。
[1]LESCHINE SB.Cellulose degradation in anaerobic environments [J].Annu Rev Microbiol,1995,49:399-426.
[2]ROSANNE M.Measurement of saccharification by cellulose[J].Enz-yme Microb Technol,1985,7:586-587.
[3]黎钢,孙晓凤,杨芳,等.秸秆生物质转化为燃料化学品的工艺技术进展[J].河北工业大学学报,2013,42(1):45-54.
[4]叶姜瑜.一种纤维素分解菌鉴别培养基[J].微生物学通报,1997,24(4):251-252.
[5]郑佐兴,段明星,徐文联,等.高活性纤维素酶菌株的筛选及其产酶条件的研究[J].微生物学杂志,1996,16(1):35-38.
[6]张银波,王汉中,胡小加,等.葡枝根霉(Rhizopus stolonifer)YF6脂肪酶基因的克隆及其序列分析[J].应用与环境生物学报,2007,13(6):876-880.
