气升式反应器中高山被孢霉发酵生产花生四烯酸过程的动态温度控制研究
2014-03-07高敏杰郑志永詹晓北
高敏杰,王 成,郑志永,朱 莉,詹晓北,*
(1.江南大学生物工程学院糖化学与生物技术教育部重点实验室,江苏无锡 214122;2.江南大学工业生物技术教育部重点实验室,江苏无锡 214122;3.江苏瑞光生物科技有限公司,江苏无锡 214125)
气升式反应器中高山被孢霉发酵生产花生四烯酸过程的动态温度控制研究
高敏杰1,2,王 成1,2,郑志永1,2,朱 莉3,詹晓北1,2,*
(1.江南大学生物工程学院糖化学与生物技术教育部重点实验室,江苏无锡 214122;2.江南大学工业生物技术教育部重点实验室,江苏无锡 214122;3.江苏瑞光生物科技有限公司,江苏无锡 214125)
在利用高山被孢霉发酵生产花生四烯酸(Arachidonic Acid,ARA)过程中,考察了不同规模和培养环境下,单一以及动态温度控制对菌体生长和ARA合成的影响。结果表明:相对于机械搅拌罐,利用气升式反应器发酵生产ARA具有明显优势。同时,较高温度(25℃)有利于高山被孢霉菌体生长,而较低温度(16℃)有利于ARA合成。在此基础上进行动态控温发酵,即起始发酵温度25℃,72h后以每12h下降1.5℃至16℃,然后保持16℃至发酵结束。采用此控制策略,ARA产量达到4.7g/L,与单一温度(25℃)控制相比提高了38.2%。
高山被孢霉,花生四烯酸,机械搅拌罐,气升式反应器,发酵温度
花生四烯酸(Arachidonic Acid,ARA)是一种二十 碳 多 不 饱 和 脂 肪 酸(Polyunsaturated Fatty Acids,PUFAs),在人体中具有维持机体细胞膜结构与功能的重要作用[1]。ARA也是前列腺素、血栓素等重要活性物质的前体物质[2]。在医药、食品和农业等行业中,ARA还是一种应用广泛的营养强化剂,被誉为“21世纪功能性食品主角”[3]。目前,ARA主要从动物组织(如肝脏、肾上腺和蛋黄等)中获取,但动物组织中ARA含量很低,并且原材料来源有限,因此ARA的生产成本一直居高不下[4]。
微生物发酵法则为生产花生四烯酸开辟了新途径,它具有不受原材料及气候限制、生产周期较短、发酵工艺简单、生产成本较低以及花生四烯酸含量高 等 特 点[5]。 因 此 ,采 用 微 生 物 发 酵 法 生 产 ARA 已是当前研究的热点。目前,主要利用高山被孢霉(Mortierella alpina)进行ARA发酵生产,ARA产量与菌体生物量、总油脂含量和油脂中ARA的含量等密切相关,而它们主要都受外界环境如培养基的组成、反应器结构和发酵工艺等因素的影响[6-7]。ARA的发酵生产一般在机械搅拌罐中进行,产量已达到较高水平。但对一些剪切敏感型霉菌的培养,气升式反应器具有剪切应力更温和、罐体结构较简单、能量耗散更均匀等优点,可以有效避免菌丝体易受损伤和菌体形态难以控制等问题[8]。在产油微生物菌体生长和油脂合成过程中,温度起着重要的作用,M.alpina的最适生长温度在15~25℃,而较低的温度通常有利于长链脂肪酸的生产[9]。因此,对于ARA的发酵生产过程,最适的细胞生长温度和产物生产温度可能会有比较大的差异。
本研究首次进行了ARA在气升式反应器中的发酵生产,同时考察了重要操作参数温度变化对M.alpina的生长及ARA合成的影响。在此基础上,提出一种动态温度控制策略,以期获得高生物量、油脂含量和ARA产量。
1 材料与方法
1.1 材料与仪器
高山被孢霉(Mortierella alpina)CFCC 88447 本实 验 室 保 藏 ;葡 萄 糖 、豆 粕 、NaNO3、MgSO4·7H2O、KH2PO4、三氯甲烷、甲醇、氢氧化钠、正己烷、三氟化硼、无水硫酸钠等 均为国产分析纯;酵母粉 Oxoid Ltd;CO2气体、N2气体、H2气体 无锡新南化学气体有限公司。
722分光光度计 上海精密科学仪器;DHG-9145A干燥箱 上海一恒科学仪器公司;PXY-DHS-35X40电热恒温培养箱 上海跃进医疗器械厂;7820A气相色谱仪 Agilent科技有限公司;1200L气相色谱串联质谱联用仪 美国瓦里安公司;LC-20A液相色谱仪 日本岛津公司;Bioflow 120机械搅拌发酵罐 美国New Brunswich Scientific公司;气升式反应器 无锡市海信化机设备有限公司。
1.2 培养基
斜面培养基(g/L):马铃薯200,葡萄糖20,琼脂20,pH自然。
种子培养基(g/L):葡萄糖30,豆粕粉10,酵母膏10,KH2PO43,NaNO33,MgSO4·7H2O 0.5,pH6.0。
发酵培养基(g/L):初始葡萄糖50,豆粕粉10,KH2PO43,NaNO33,MgSO4·7H2O 0.5,pH6.0。
1.3 实验方法
1.3.1 种子培养 平板上挑取单菌落到种子培养基中,25℃,110r/min,培养48h。
1.3.2 摇瓶发酵 接种量10%(v),110r/min,温度大小见结果与讨论一节,初始pH6.0,发酵7d。
1.3.3 分批发酵(机械搅拌罐) 实验采用7L机械搅拌罐(BioFlo 115,New Brunswick Scientific Co.,NJ,USA)进行分批发酵7d,接种量10%(v),装液系数为0.6,搅拌转速180r/min,温度25℃,使用2.0mol/L NaOH控制发酵液pH为6.0。
1.3.4 恒速补料发酵(气升式发酵罐) 实验采用30L气升发酵罐进行恒速补料分批发酵7d。接种量10%(v),装液系数为0.6,通气量1.0L/L/min,pH控制在6.0,发酵开始后恒速(6.12mL/h)流加补料液(700g/L葡萄糖)直至发酵结束。
1.3.5 分析方法 生物量测定:准确量取50mL发酵液进行真空过滤(直径7cm中速定量滤纸),用蒸馏水冲洗至流出液无色,将菌体置于平皿中,105℃下烘干至恒重,称菌体干重。生物量计算公式:生物量(g/L)=菌体干重(g)/发酵液体积(L)。
1.3.5.1 菌球直径的测定 发酵结束后,取2mL摇匀后的发酵液倒入培养皿中,加入20mL去离子水稀释后从中随机选取30个菌球,以游标卡尺为参照逐个测定菌球直径,计算平均值和标准差。
1.3.5.2 葡萄糖含量测定 DNS法测定发酵液中残留的葡萄糖含量[10]。
1.3.5.3 总油脂含量测定 精确称取干燥后的菌体0.5g,置于研钵中充分研磨至粉状,转移到7mL离心管中,加入3mL CHCl3-MeOH溶液(v/v=1∶2),剧烈振荡抽提1min,再加入1mL CHCl3溶液,再次剧烈振荡1min,最后加入1mL去离子水,振荡萃取1min,静置30min后溶液分层,将下层有机相全部取出至预先称重的5mL离心管中,水浴(80℃,4h)将有机相蒸干,干燥后再次称重离心管重量,减去空离心管的重量即为总油脂的重量[11]。
脂肪酸含量测定:精确称取总油脂0.1g,加入2mL 0.5mol/L的NaOH-MeOH溶液,60℃水浴加热至油 脂 完 全 溶 解 ,冷 却 后 加 入 2mL 25%(v/v)的 BF3-MeOH溶液,60℃水浴酯化20min,再次冷却后加入2mL正己烷并振荡混匀,最后加入2mL NaCl饱和溶液并振荡,静置30min后取上层有机相于一只干燥试管中,并加入少量无水硫酸钠以去除微量水分,供GC/MS分析使用[12]。
GC/MS分析采用美国瓦里安公司气相色谱串联质谱联用仪1200L GC/MS;色谱条件:色谱柱为DB-225,30m×0.25mm×0.15μm毛细管柱;载气,He气;流量,1mL/min,不分流进样;程序升温条件为:初始温度180℃,维持2min,以5℃/min速率升温至230℃,维持12min;质谱条件:接口温度,250℃;离子源温度,200℃;离子化方式,EI;电子能量,70eV;检测电压,350V;发射电流,200μA。
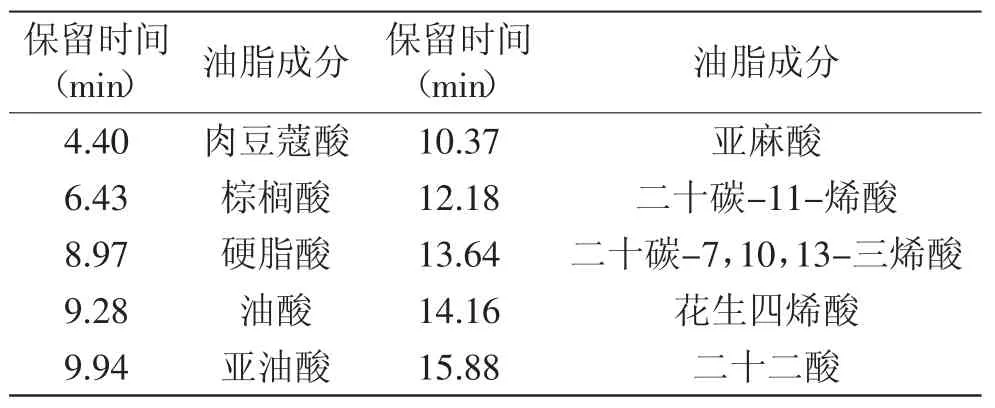
表1 高山被孢霉菌体中油脂组分分析Table 1 Components of lipids produced by M.alpina
2 结果与讨论
2.1 摇瓶条件下温度对高山被孢霉菌体生长、总油脂和ARA合成的影响
温度对产油微生物菌体生长和油脂合成影响很大,特别是低温条件对促进PUFAs合成具有重要意义。高山被孢霉菌体的生长和目标产物ARA的生物合成过程均是在一系列酶的催化作用下进行的,只有在最适温度下酶的活性才会最高。对高山被孢霉来说,最适温度是指既有利于菌体生长又有利于目标产物ARA合成的温度,但有文献报道高山被孢霉最适生长温度和PUFAs合成的最适温度往往不一致,最适生长温度往往高于PUFAs合成的最适温度[13]。
为了考察温度对本株高山被孢霉菌体生长和ARA合成影响,在摇瓶水平对发酵温度进行了研究。分别将三角瓶置于13、16、19、22、25、28℃六种不同温度下培养7d,每个温度条件做了3个平行实验。由图1可以看出,较高温度(25~28℃)有利于菌体生长,其中菌体生物量在25℃时达到最高,为35.8g/L。当温度由25℃逐渐降低至13℃时,菌体生长明显受到抑制,菌体生物量只有19.2g/L。但是从表2可以看出,在较低温度(13~19℃)下,PUFAs在总油脂中所占比例明显较高,说明低温对PUFAs积累具有促进作用,16℃时比例达到最高,为37.2%,而25℃时油脂中ARA比例比16℃时低了19.2%,可见较低发酵温度对目标产物ARA的积累是有利的。
分析原因,可能是低温条件会促使菌体合成更多的PUFAs,因为PUFAs可以更好的保持低温环境下菌体细胞膜的流动性,维持细胞正常的生理功能[14],是 菌 体 适 应 不 利 外 界 环 境 的 一 种 自 我 保 护 手 段[15]。另外溶氧在ARA合成途径中具有重要作用,而较低的发酵温度也有利于增加发酵液中氧的溶解度,使细胞内形成大量分子氧,一定程度上提高了脂肪酸脱饱和酶活性,对ARA的合成同样具有促进作用[16-17]。

图1 摇瓶发酵温度对ARA合成影响Fig.1 Effect of temperature on ARA biosynthesis in shaking-flask cultivation
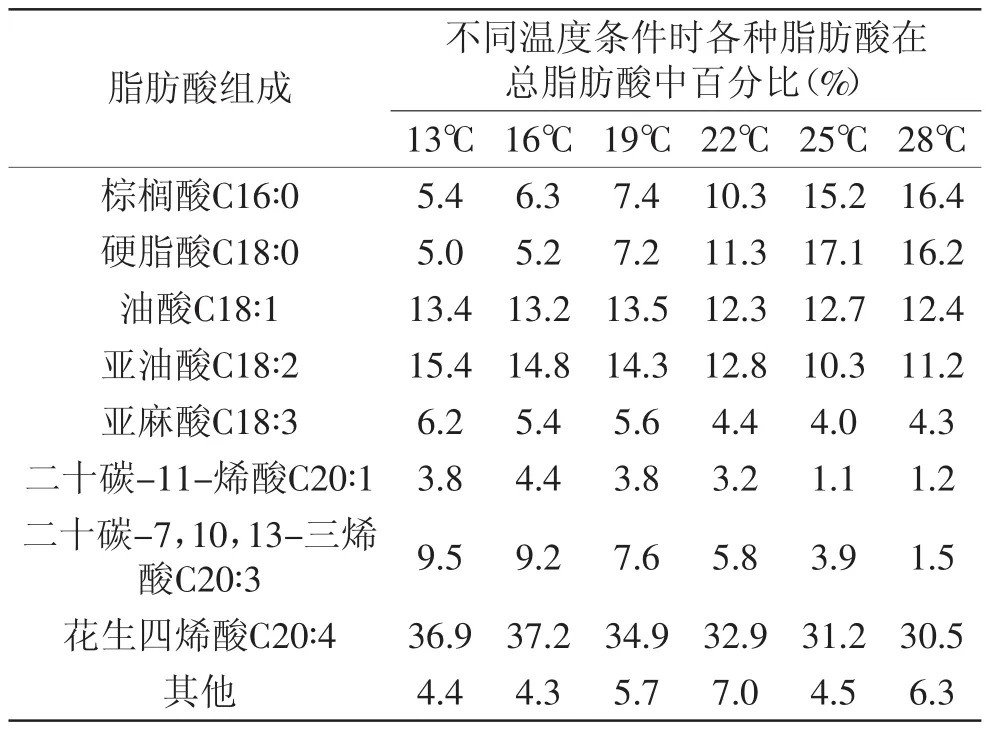
表2 不同温度摇瓶发酵时脂肪酸组分分析Table 2 Fatty acid composition analysis under various temperatures by M.alpina
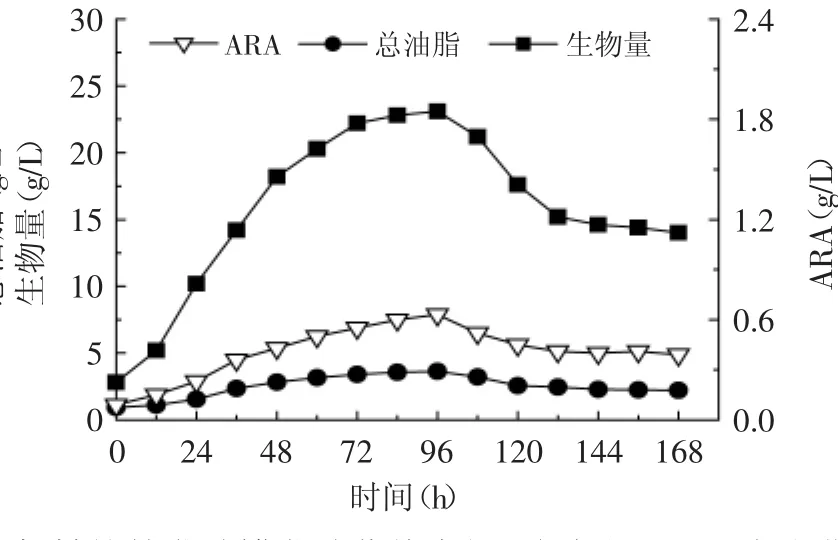
图2 机械搅拌发酵罐发酵菌体生长、总油脂和ARA合成曲线Fig.2 Time course of cell growth lipid and ARA accumulation in mechanical string fermentation

图3 摇瓶发酵和机械搅拌罐发酵时菌体形态Fig.3 Effect of two fermentation methods on morphology of M.Alpine
2.2 机械搅拌罐发酵生产ARA情况
为扩大高山被孢霉发酵生产ARA规模,在7L机械搅拌发酵罐水平进行放大研究。从图2菌体生长和产物合成曲线可以看出,在0~96h发酵阶段菌体生长良好,但发酵至96h后菌体生物量、总油脂和ARA产量都出现迅速下降,发酵过程ARA最高产量只有0.6g/L。比较摇瓶发酵和机械搅拌罐发酵时菌体形态可以发现,两种发酵条件下菌体形态差异很大,摇瓶发酵时菌体主要呈球状(图3a),而机械搅拌罐内的菌体呈羽状(图3b),同时在显微镜下也可以发现摇瓶内的菌丝平均长度大于机械搅拌罐内的菌丝平均长度。这说明在机械搅拌罐内,桨叶搅拌产生的剪切力造成高山被孢霉菌丝断裂,菌丝不易互相缠绕形成最适菌球形态,不利于油脂和ARA合成。另一方面,断裂的羽状菌丝体会分散在发酵液中,使发酵液变得更为黏稠,发酵过程中氧传质阻力增加,不利于菌体的氧摄取[18]。随着发酵进行大量羽状的菌丝易在发酵罐挡板和搅拌桨上聚集和结块,形成大型的菌团,过厚的菌团同样会阻止氧气的传递,导致菌团内部的菌丝因缺氧而过早衰老和死亡。虽然相关文献报道中都利用机械搅拌罐成功发酵生产ARA,但机械搅拌罐并不适用于本菌株[19]。分析原因,一方面可能因不同高山被孢霉菌株产ARA的能力不同,另一重要原因可能是本菌株对剪切力更加敏感,机械搅拌时难以维持良好的菌球形态,最终导致发酵的失败,因此接下来尝试使用剪切力温和的气升式反应器发酵生产ARA。
2.3 气升式反应器中不同温度对细胞生长和ARA合成的影响
在30L气升式反应器上分别对25℃和16℃发酵时高山被孢霉菌体生长和ARA合成情况进行研究。观察整个发酵过程,高山被孢霉菌体保持良好形态,大部分菌体保持球状形态且没有出现明显菌块,解决了机械搅拌罐发酵时菌丝断裂和发酵液粘度不断增加的问题。从表3可以看出,25℃条件下总油脂积累与生物量有很大关联,发酵结束时生物量和ARA产量分别为34.6g/L和3.4g/L。虽然16℃条件下菌体生长较慢,最终生物量仅为23.5g/L,但低温条件下ARA占总油脂的比例提高到了31%,ARA的产量达到3.2g/L。同时对25℃和16℃发酵条件下菌体比生长速率和ARA比合成速率分析发现,25℃时菌体最大比生长速率和最大比合成速率,分别明显高于16℃的最大比生长速率和最大比合成速率(图4)。发酵0~ 72h之间,25℃对应的菌体比生长速率明显高于16℃,说明较高温度确实有利于菌体的生长;发酵至72h后,16℃对应的ARA比合成速率已经明显高于25℃的比合成速率,并且维持较长时间,说明适当降低发酵温度对发酵后期ARA的积累具有明显促进作用。
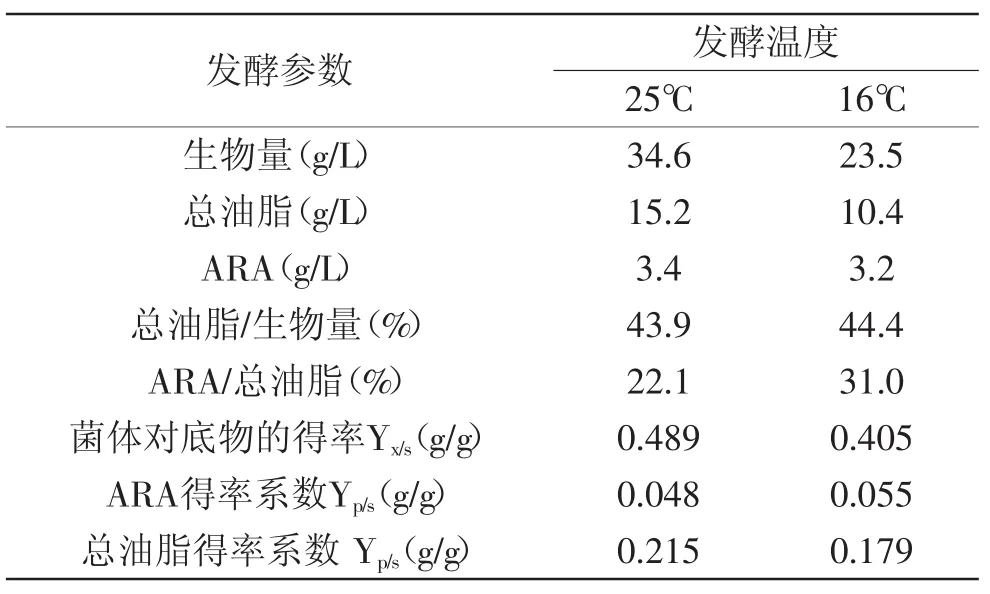
表3 25℃和16℃气升式反应器发酵时菌体生长和ARA合成情况Table 3 Cell growth and ARA biosynthesis in airlift reactor cultures with 25℃ and 16℃
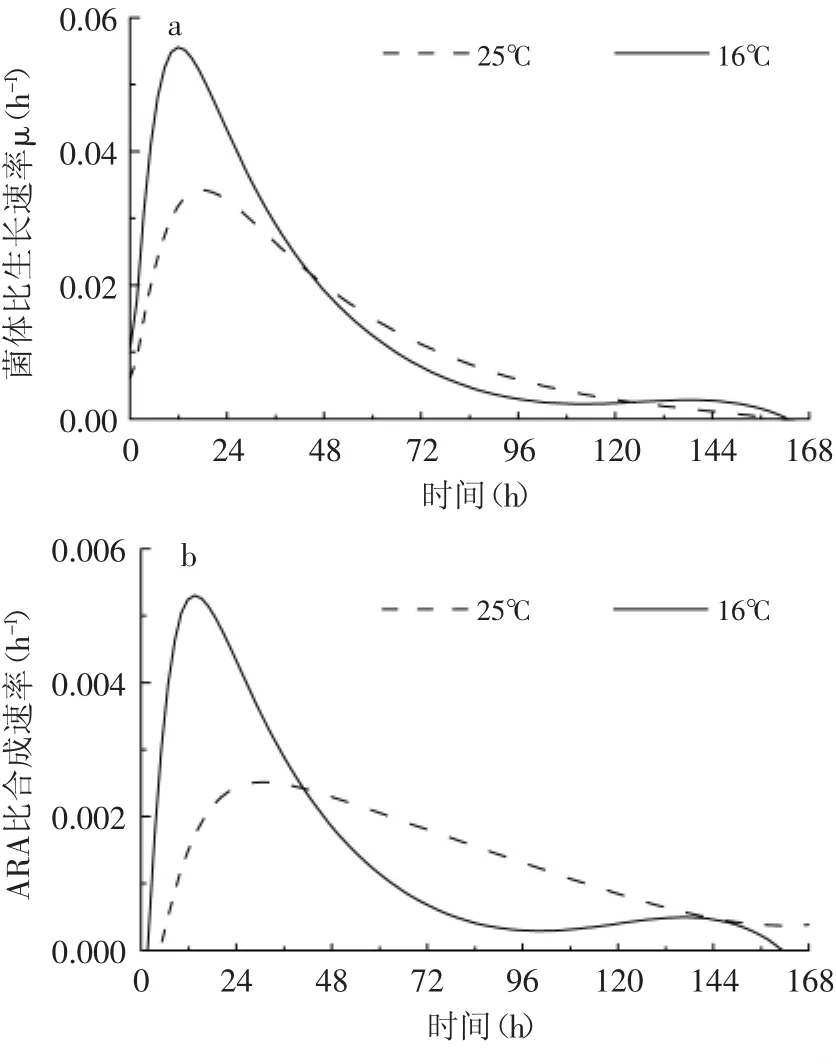
图4 气升式反应器发酵时温度对菌体比生长速率和ARA比合成速率的影响Fig.4 Effect of temperature on cell specific growth rate and ARA specific formation rate in airlift reactor
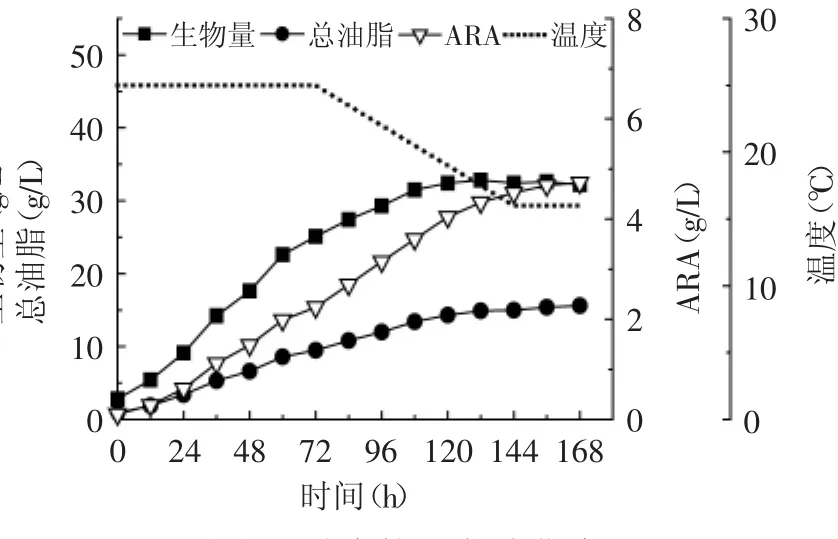
图5 动态控温发酵曲线Fig.5 The dynamic temperature-control fermentation curve
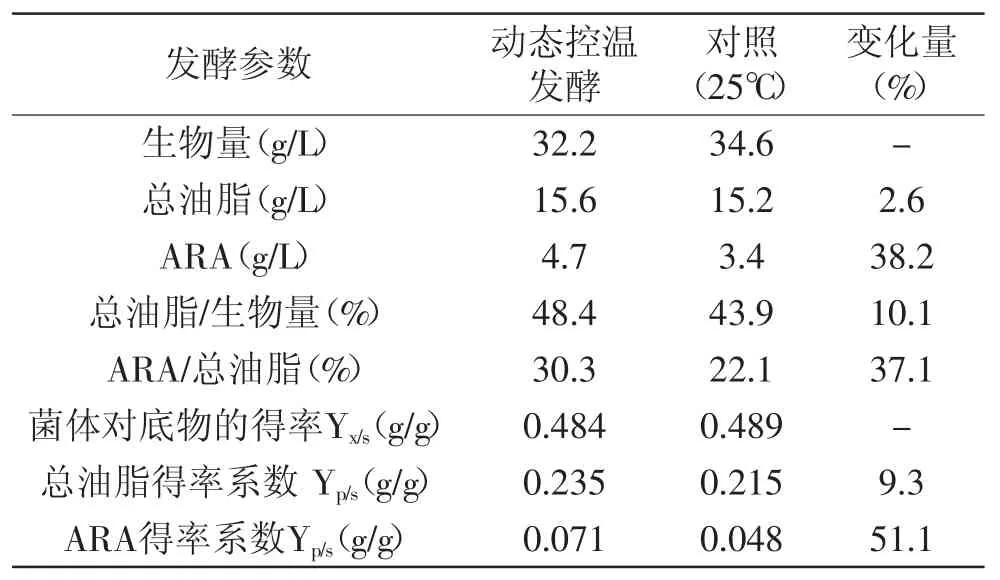
表4 动态控温发酵对ARA合成影响数据汇总Table 4 Summary of dynamic temperature-control on ARA biosynthesis by M.alpina
2.4 气升式反应器中动态控温策略提高ARA产量
通过以上对温度的研究发现,适合高山被孢霉菌体生长的最适温度与ARA合成最适温度并不一致,较高温度(25℃)更有利于菌体的生长,而较低温度(16℃)时,ARA在总油脂中的比例更高。目标产物ARA的最终产量主要由菌体生物量和菌体总油脂中ARA比例决定。发酵温度分阶段控制是一种经典的过程优化方式,可以在获得较高菌体生物量同时尽可能提高总油脂中ARA比例,最终提高ARA产量[20]。而采用线性下降的温度变化方式主要考虑细胞对温度变化的适应过程,避免突然的阶梯式温度变化对细胞生长和产物合成的不利影响。进行动态控温发酵实验的发酵条件为:0~72h阶段菌体生长代谢旺盛,对环境温度的变化比较敏感,保持此阶段温度为25℃有利于菌体生长,可以获得更高生物量,同时一定程度上缩短发酵周期。72h后菌体生长速率逐渐放缓,进入稳定期,选择72h做为变温的起点,以每12h下降1.5℃速率逐渐将温度降至16℃,然后维持16℃至发酵结束,结果如图5所示。发酵开始后菌体干重迅速增加,发酵至72h菌体生物量已经达到一定水平(26.5g/L),72h后随着温度逐渐降低,ARA的合成速率不断提高。最终生物量和ARA产量分别达到32.2g/L和4.7g/L。与非变温(25℃)发酵相比,生物量和总油脂基本达到相同的水平,但油脂中ARA百分比有了明显增加,由22.1%提高至30.3%(表4)。因此利用动态控温发酵提高ARA产量是可行的,整体发酵性能提升明显。
3 结论
主要考察了不同规模和培养环境下,重要操作参数温度对M.alpina菌体生长及ARA合成的影响。研究发现对于本实验菌株,采用气升式反应器发酵生产ARA具有更大优势,可以解决机械搅拌罐发酵时菌丝断裂、发酵中后期菌体结块和ARA产量过低等问题。同时,M.alpina菌体生长与目的产物ARA合成的发酵最适温度并不相同,较高温度(25℃)有利于菌体生长,较低温度对PUFAs积累具有促进作用,16℃时油脂中ARA比例最高。由此提出一种动态控温发酵策略,采用此策略,ARA最高浓度达到4.7g/L,与单一温度(25℃)控制相比产量提高了38.2%。当然,在利用气升式反应器发酵生产ARA过程中还有其他重要参数与ARA产量的提高密切相关,需要更深入的研究和分析。
[1]Higashiyama K,Fujikawa S,Park E Y,et al.Production of arachidonic acid by Mortierella fungi[J].Biotechnology and Bioprocess Engineering,2002,7(5):252-262.
[2]Metz J G,Roessler P,Facciotti D,et al.Production of polyunsaturated fatty acids by polyketide synthases in both prokaryotes and eukaryotes[J].Science,2001,293:290-293.
[3] 袁成凌,汪志明. 新型营养强化剂-花生四 烯酸[J]. 中国食品添加剂,2001(4):27-30.
[4]常淑梅,彭超,纪晓俊,等.花生四烯酸高产菌株选育研究进展[J]. 食品与发酵工业,2010,36(2):158-162.
[5]Sakuradani E,Abe T,Iguchi K,et al.A novel fungal ω3-desaturase with wide substrate specificity from arachidonic acidproducing Mortierella alpina 1S-4[J].Applied Microbiology and Biotechnology,2005,66(6):648-654.
[6]丛蕾蕾,彭超,纪晓俊,等.高山被孢霉产花生四烯酸及其遗传改造的研究进展[J]. 生物工程学报,2010,26(9):1232-1238.
[7]金明杰,黄和,肖爱华,等.利用乙醇胁迫作用提高花生四烯酸产量[J]. 食品与发酵工业,2007,33(11):52-54.
[8] 金仁村,郑平. 改进型气升式反应器能耗的研究[J]. 生物工程学报,2005,21(5):820-825.
[9]Tocher D R, Sargent J R.Effect of temperature on the incorporation into phospholipid classes and metabolismvia desaturation and elongation of n-3 and n-6 polyunsaturated fatty acids in fish cells in culture[J].Lipids,1990,25(8):435-442.
[10]MillerG L.Use ofdinitrosalicylic acid reagentfor determination of reducing sugar[J].Analytical Chemistry,1959,31(3):426-428.
[11]Bligh E G,Dyer W J.A rapid method of total lipid extraction and purification[J].Canadian JournalofBiochemistry and Physiology,1959,37(8):911-917.
[12]董宏祯,许晨,许建中,等.微生物油脂中花生四烯酸的甲酯化工艺[J]. 食品科学,2011,32(24):69-72.
[13]Peng C,Huang H,Ji X,et al.A temperature-shift strategy for efficient arachidonic acid fermentation by Mortierella alpine in batch culture[J].Biochemical Engineering Journal,2010,53(1):92-96.
[14] Šajbidor J.Effect of some environmental factors on the content and composition of microbial membrane lipids[J].Critical Reviews in Biotechnology,1997,17(2):87-103.
[15]Carratù L,Franceschelli S,Pardini C L,et al.Membrane lipid perturbation modifies the set point of the temperature of heat shock response in yeast[J].Proceedings of the National Academy of Sciences,1996,93(9):3870-3875.
[16]Korbecki J,Baranowska-Bosiacka I,Gutowska I,et al.The effect of reactive oxygen species on the synthesis of prostanoids from arachidonic acid[J].Journal of Physiology and Pharmacology,2013,64(4):409-421.
[17]肖瀛,李柏林,欧杰,等.深黄被孢霉在不同培养条件下合成GLA和代谢副产物脂肪酸的分析[J]. 食品科学,2007,28(3):241-246.
[18]PARK E Y , Koizumi K , Higashiyama K.Analysis of morphological relationship between micro-and macromorphology of Mortierella species using a flow-through chamber coupled with image analysis[J].Journal of Eukaryotic Microbiology,2006,53(3):199-203.
[19]Hwang B H,Kim J W,Park C Y,et al.High-level production of arachidonic acid by fed-batch culture of Mortierella alpina using NH4OH as a nitrogen source and pH control[J].Biotechnology Letters,2005,27(10):731-735.
[20]Phisalaphong M , Srirattana N , Tanthapanichakoon W. Mathematical modeling to investigate temperature effect on kinetic parameters of ethanol fermentation[J].Biochemical Engineering Journal,2006,28(1):36-43.
Study on improved arachidonic acid production by Mortierella alpina with dynamic temperature-control in airlift bioreactor
GAO Min-jie1,2,WANG Cheng1,2,ZHENG Zhi-yong1,2,ZHU Li3,ZHAN Xiao-bei1,2,*
(1.Key Laboratory of Carbohydrate Chemistry and Biotechnology of Ministry of Education,School of Biotechnology,Jiangnan University,Wuxi 214122,China;2.Key Laboratory of Industrial Biotechnology of Ministry of Education,Jiangnan University,Wuxi 214122,China;3.Jiangsu Rayguang Biotechnology Co.,Ltd.,Wuxi 214125,China)
Constant and dynamic temperature-control was inverstigated for efficient arachidonic acid (ARA)production by Mortierella alpine in different fermentation scales and environments.The results showed that airlift bioreactor was more suitable for ARA production process compared with mechanical stirring fermentor. Meanwhile,cell growth rate showed to be optimum at 25℃ ,while ARA ratio in lipid showed to be maximal at 16℃ .As a result,a dynamic temperature-control strategy,in which the culture temperature was controlled at 25℃ at the first 72h and linearly decreased 1.5℃ for every 12h till 16℃ ,then kept at 16℃ for the rest of the fermentation,was developed in the airlift bioreactor.With this control strategy,the ARA production level reached 4.7g/L which was increased 38.2%compared with the level of constant temperature(25℃) control strategy.
Mortierella alpina ; arachidonic acid ; mechanical stirring fermentor ; airlift reactor ; fermentation temperature
Q815
A
1002-0306(2014)22-0179-05
10.13386/j.issn1002-0306.2014.22.031
2014-07-16
高敏杰(1980-),男,副教授,研究方向:生化过程优化与控制。
* 通讯作者:詹晓北(1962-),男,教授,研究方向:生化工程与反应器。
“十二五”国家科技支撑计划子课题(2011BAD23B04);国家高技术研究发展计划子课题(2012AA021505)。
