假微型海链藻的培养条件研究
2014-03-07宁楠楠周成旭
宁楠楠, 张 弋, 周成旭, 蒋 莹, 陈 宇
(宁波大学 海洋学院, 浙江 宁波 315211)
假微型海链藻的培养条件研究
宁楠楠, 张 弋, 周成旭, 蒋 莹, 陈 宇
(宁波大学 海洋学院, 浙江 宁波 315211)
假微型海链藻(Thalassiosira pseudonana)被广泛应用于基础研究、水产养殖以及生物质能开发。本文对浙江沿岸海区分离的一株富含中性脂的假微型海链藻人工培养条件进行了研究, 分别就光温盐、氮磷以及摇瓶强度对细胞增殖的影响进行了分析, 以期为该藻的大量培养提供参考。结果显示: (1) 该藻盐度适应范围广, 培养在盐度为10~45海水中, 细胞增殖率没有显著差异, 易于培养。温度是改变该藻细胞增殖速率的主要因子, 22~25℃之间的温差即显著改变增殖速率, 光照与温度的协同作用也发生改变: 25℃下, 增殖速率随光照增加而增加, 22℃下, 光强差异的作用则消失。两个温度下,较低光照(2000 lx)利于该微藻的稳定增殖。(2) 一次培养过程中, 该藻对氮的吸收比对磷的吸收迅速,指数生长期对氮吸收显著增加; 缺氮强烈抑制细胞分裂和光合潜能(Fv/Fm)。当氮源充足磷限制胁迫时,该藻仍有细胞分裂, 并在增殖期能维持与对照组一样的光合潜能。(3) 适度摇瓶强度比完全静置能促进对该藻的培养效率, 但过度摇瓶不利于该藻细胞分裂。
假微型海链藻(Thalassiosira pseudonana); 培养条件; 细胞增殖
以利用微藻生物质为目标的生物技术产业中,大量培养一直是一个技术瓶颈。无论是开放式大池养殖还是光生物反应器培养, 获取不同微藻的增殖最佳条件是大量培养的基础[1-2]。对自养微藻进行人工培养时, 首要关注的是营养盐以及光照、温度、盐度等关键条件。同时, 摇瓶或充气等条件是其中的一项重要工艺, 不同培养物对摇瓶或充气等条件的需求或剪切力的耐受能力也各不相同。
假微型海链藻(Thalassiosira pseudonana)是中心硅藻纲的一种光合自养硅藻。作为模式生物, 是第一个被用来进行全基因组测序的真核浮游硅藻[3], 之后被广泛应用于代谢、遗传、毒理、生态以及能源微藻筛选等众多领域的研究[4-7]。该藻还是水产养殖育苗中的一种饵料微藻[8-9]。王金娜等在进行能源微藻筛查时, 获得了一株分离自浙江沿海的富含中性脂的假微型海链藻, 具有进行生物柴油开发利用的潜力[10]。
本研究从培养自养微藻相关的几个关键因子着手, 分析了光、温、盐、氮、磷以及摇瓶强度等条件对该藻株细胞增殖的影响, 为生产实践中对该藻的大量培养与应用提供参考。
1 材料与方法
实验藻种: 假微型海链藻(T. pseudonana, NMBguh005)为宁波大学海洋学院微藻种质库提供。
1.1 盐度对假微型海链藻增殖的影响
对盐度28的象山港天然海水进行调节, 加入海水精(上海保嘉生化技术有限公司)制备较高盐度海水, 加入蒸馏水制备较低盐度海水。实验盐度梯度为: 10、15、25、35、45。各组 3平行。调节 pH8。实验于 250 mL三角瓶中, 实验水体体积 125 mL, NMB3#[11]培养基(除特殊说明外, 本研究均以此营养盐配方)。初始细胞密度为4.7×105个/mL。置于光照 3000 lx(D∶L=12∶12), 温度 22℃的光照培养箱(GXZ型智能光照培养箱, 宁波江南仪器厂)中培养。隔天取样, 用 CASY快速细胞活力分析仪(CASY Model TT, 德国)检测细胞密度。
1.2 光照强度和温度对假微型海链藻增殖的影响
GXZ型智能光照培养箱设置光温培养条件为:
预实验中, 该藻细胞增殖的最适温度为 22~25℃,本实验分析温度与光照协同对藻细胞增殖的作用。
实验设置: 温度: 高(H): 25℃、低(L): 22℃。光照强度: 高(G): 10 000 lx; 中(Z): 6 000 lx; 低(L): 2 000 lx。L∶D=12∶12。光温组合: HG、HZ、HD、LG、LZ、LD。实验于250 mL三角瓶中, 实验水体体积200 mL, 初始细胞密度2.6×105个/mL。各3组平行。每天检测细胞密度。
1.3 氮、磷元素对假微型海链藻细胞增殖的影响
1.3.1 一次培养过程中的细胞增殖及氮磷消耗
接种预培养至指数期的藻液100 mL于300 mL新鲜培养液, 置于500 mL三角瓶中, 3平行。自接种日开始, 每日取5 mL藻液经0.45 µm醋酸纤维滤膜过滤得滤液, 冷冻保存备测氮磷营养盐。隔日记录细胞密度变化, 跟踪生长周期。培养条件为22℃, 2 000 lx (D∶L=12∶12)。微藻培养结束后, 解冻滤液, 于营养盐自动分析仪(Smart Chem method 100E-2)上检测样品的氮磷含量。
1.3.2 缺氮缺磷对细胞增殖及光合荧光参数的影响
将预培养至指数生长期的微藻离心浓缩后, 重悬浮于缺氮、磷的人工海水[12]中进行营养盐饥饿培养3 d。基于NMB3#培养液配方, 分别制备缺磷(-P)或缺氮(-N)或 N/P=16∶1(磷的终浓度为 100 µmol/L)的人工海水培养液。实验于250 mL三角瓶中, 实验水体体积200 mL, 初始接种细胞密度为3.7×105个/mL。
光照强度3 000 lx(D∶L=12∶12 ), 温度22℃,盐度30, 各组3平行。隔天定时取样检测细胞密度,并检测光合荧光参数Fv/Fm(Water-PAM, Germany)。
上述实验均静置培养, 每天上下午分别定时手动摇动1次。
1.4 摇瓶强度对假微型海链藻细胞增殖的影响
以新鲜培养液接种指数期微藻于500 mL三角瓶中, 实验水体体积300 mL, 初始细胞密度为1.5×105个/mL。利用水平摇床(WD-9405B, 北京六一仪器厂)不同转速, 设置持续的“快速”(~130r/min)、“慢速”(~60r/min)、“完全静置”3种状态。各3组平行。置于光照5000 lx(D∶L=12∶12)、温度25℃的培养室中进行培养。每天检测微藻密度。
1.5 数据分析
增殖速率计算:μ=(lnNt2–lnNt1)/(t2–t1), 其中Nt1,Nt2分别为时刻t1,t2的藻细胞密度,μ为比生长速率(d-1)。
数据结果取平均值, 偏差为标准偏差, 显著性分析结果为单因素差异显著性分析。
2 结果
2.1 盐度对假微型海链藻细胞增殖的影响
图 1为不同盐度条件下假微型海链藻指数生长期的生长速率。可以看出, 该藻属广盐性, 虽然低盐(10~15)条件下细胞增殖率较高盐(45)略低(0.3 d-1~ 0.5 d-1), 但单因素显著性差异分析显示, 各盐度组之间没有显著性差异。结果显示, 该株近岸海域中分离的假微型海链藻具有广盐性适应特征, 利于该藻的大规模培养。

图1 不同盐度条件下假微型海链藻细胞增殖速率Fig. 1 The growth rate of T. pseudonana under conditions of different salinities
2.2 光照和温度条件对假微型海链藻增殖的影响
分析光温组合条件对假微型海链藻的影响发现,适宜温度范围内, 3℃的差异可明显造成该藻细胞增殖显著变化, 其差异还与光照强度相关(图 2)。25℃下, 培养初期快速增殖, 且增殖速率随光强增加而明显增加(图3, 4 d增长率)。但高光照下, 达最大生物量后, 细胞数量迅速下降。22℃下, 初期增长速率明显较低, 但细胞稳定增殖, 且高密度时可维持稳定。该温度下, 光强差异对细胞增殖的影响则不显著(图3)。
2.3 氮、磷元素对假微型海链藻细胞增殖的影响
在此一次培养中, 假微型海链藻密度稳定增加,第7天进入平台期, 第2~6天为快速增殖时期。图4中可以看出, 氮磷从起始的最高浓度降至不可检出,其消耗时间与该藻的快速增殖期一致。而且, 每日吸收的氮磷比值在细胞快速增殖的第3~5天明显增大,说明快速增殖时期该藻增加了对氮的吸收, 使吸收的氮磷比增加。
氮磷胁迫实验结果(图5)显示, 缺氮强烈抑制细胞分裂, 且抑制光合作用, 光合荧光参数Fv/Fm显著降低; 缺磷介质中, 仍有细胞增殖, 且在实验第7天进入平台期, 并可维持平台期的密度。其Fv/Fm在培养初期与对照组没有差别, 但进入平台期后, 较对照组显著下降, 光合作用受到影响与细胞分裂停止同期发生。
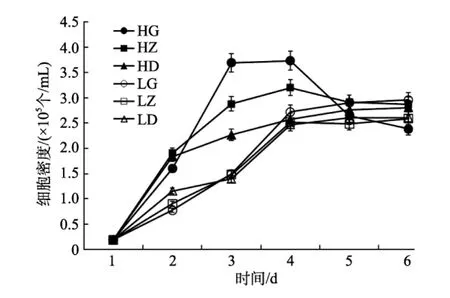
图2 不同光照和温度组合条件下假微型海链藻细胞密度的变化Fig. 2 The population growth of T. pseudonana under synergistic effects of temperature and light

图4 假微型海链藻一次培养中不同时期的氮磷消耗特征Fig. 4 The characteristics of the consumption of nitrogen and phosphorus during the growth phase in a batch culture of T. pseudonana

图5 氮、磷胁迫对假微型海链藻细胞增殖和光合荧光参数(Fv/Fm)的影响Fig. 5 The effects of nitrogen or phosphorus starvation on the growth and chlorophyll fluorescence parameter(Fv/Fm) of T. pseudonana
2.4 摇瓶在培养中的作用
不同摇瓶强度对假微型海链藻的影响如图6所示。“慢速”(~60r/min)摇瓶最利于细胞快速增殖, 接种2 d后细胞增殖率达1 d-1; 完全静置培养不利于该藻细胞增殖, 5 d中增殖最少。该藻不适宜强烈摇瓶(~130 r/min), 细胞增殖率不高, 并且微藻出现聚团。
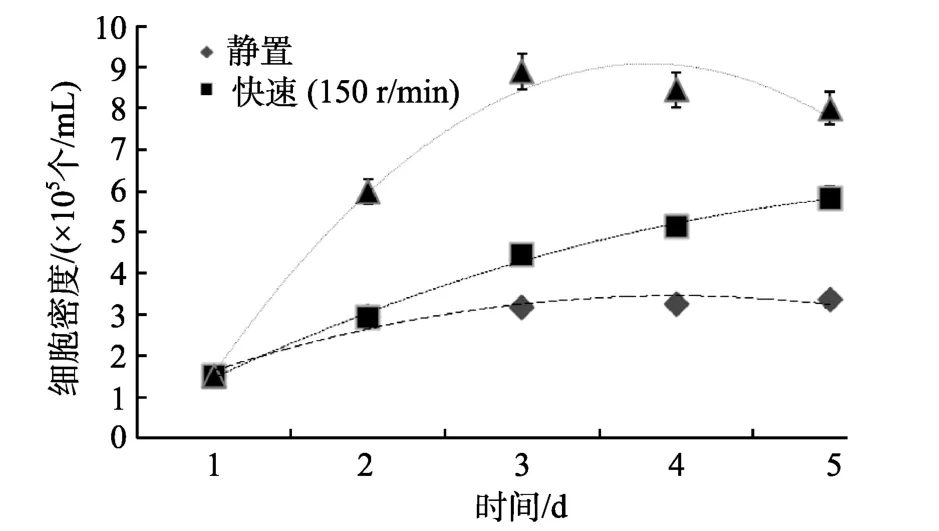
图6 摇瓶强度对假微型海链藻细胞增殖的影响Fig. 6 The effect of shaking on the growth of T. pseudonana
3 讨论
培养海洋微藻最重要的条件因子是光照、温度、盐度以及营养盐。假微型海链藻是广分布型, 沿海和大洋均有分布[13]。其生物发生可能是由淡水小环藻演化而来[14]。从本研究结果来看, 该藻适宜盐度的范围广, 细胞增殖速率在盐度10~45中没有显著差异,易于各盐度中培养。该藻对温度变化敏感, 适温范围内, 3℃温差显著改变细胞增殖率。光照强度的作用差异也因3℃温差而不同: 较高温度下, 光照越强细胞分裂越快; 较低温度下增殖速率则不因光强而变化, 显示了光温的协同作用。Halac等[15]的研究表明,在光辐射增强的情况下, 培养温度升高有利于保护假微型海链藻光合作用中心, 提高微藻抵抗辐射损伤的能力, 也说明了光辐射与温度的协同影响。Brand等[13]的研究表明, 假微型海链藻细胞增殖率与温度正相关, 且沿海品系和大洋品系细胞分裂速率随温度变化效应是相同的。早期关于假微型海链藻的培养条件研究也表明, 假微型海链藻生长率首先与温度密切相关, 但同时受光照强度以及光周期调节[8]。细胞生活史中, 该藻可进入休眠期, 此过程中,光合作用以及构成细胞膜结构用的极性脂累积, 为其在环境条件适宜时提供了物质基础[4], 形成了假微型海链藻分布广、生长率高的特征。这些特点使该藻易于人工培养。需要重点关注的是, 精确的光温优化组合以及添加营养盐的时机, 是获得快速高生物量增殖的关键, 尤其在光生物反应器设计和应用中, 需要将光、温同时考虑。
本研究结果显示, 该藻对氮的吸收速率高, 氮胁迫强烈抑制细胞分裂和光合作用。细胞对磷的吸收速率相对缓慢, 且细胞能耐受外界的磷胁迫。康燕玉等[16]研究表明, 假微型海链藻最佳生长的 N/P = 16。本研究中, 快速初期增殖后密度的迅速下降, 可能是因无机氮源被快速增殖消耗后形成的氮胁迫造成。因此, 还需要进一步分析不同光温条件下的营养盐吸收特征, 从而为高效的连续培养工艺提供参数。磷限制条件下, 假微型海链藻可进行多种代谢调节以抵抗磷胁迫, 例如增加磷的转运、生成多磷酸盐以及碱性磷酸酶的活性表达以利用有机磷等[17], 这些能力可能使该藻在磷限制的情况下也能进行细胞分裂实现增殖。
自然环境中, 微藻不同, 对扰动的需求和耐受能力不同, 其适应特征对人工培养微藻的工艺具有指导意义[18]。本研究结果显示, 完全静置培养不利于该藻的细胞增殖, 但是过度摇瓶也会干扰细胞分裂。尤其在设计该藻的光生物反应器培养参数时, 实际的摇动强度还需要综合多种培养条件进行分析。
[1] Mutanda T, Ramesh D, Karthikeyan S, et al. Bioprospecting for hyper-lipid producing microalgal strains for sustainable biofuel production[J].Bioresource Technology, 2011, 102(1): 57-70.
[2] Griffiths M J, Harrison S T L.Lipid productivity as a key characteristic for choosing algal species for biodiesel production[J].Journal of Applied Phycology, 2009, 21(5): 493-507.
[3] Armbrust E, Berges J, Bowler C, et al. The genome of the diatomThalassiosira pseudonana: ecology, evolution, and metabolism[J]. Science, 2004, 306 (5693): 79-86.
[4] Zhukova N V.Changes in the lipid composition ofThalassiosira pseudonanaduring its life cycle[J]. Russian Jou rnal of Plant Physiology, 2004, 51(5): 702-707.
[5] Chauton M S, Størseth T R, Johnsen G.High-resolution magic angle spinning 1H NMR analysis of whole cells ofTalassiosira pseudonana(Bacillariophyceae): Broad range analysis of metabolic composition and nutritional value[J]. Journal of Applied Phycology, 2003, 15(6): 533-542.
[6] Yu E T, Zendejas F J, Lane P D, et al. Triacylglycerol accumulation and profiling in the model diatomsThalassiosira pseudonanaandPhaeodactylum tricornutum(Baccilariophyceae) during starvation [J]. Journal of Applied Phycology, 2009, 21: 669-681.
[7] Picardo M C, Medeiros J L , Monteiro J G M, et al. A methodology for screening of microalgae as a decision making tool for energy and green chemical process applications [J]. Clean Techn Environ Policy, 2013, 15: 275-291.
[8] Ferguson R L, Collier A, Meeter D A.Growth response ofThalassiosira pseudonanahasle and heimdal clone 3H to illumination, temperature and nitrogen source[J]. Chesapeake Science, 1976, 17(3): 148-158.
[9] Nelson D M, D'Elia C F, Guillard R R L.Growth and competition of the marine diatomsPhaeodaclum tricomutumandThalassiosira pseudonana.II. Light limitation[J].Marine Biology, 1979, 50(4): 313-318.
[10] 王金娜, 严小军, 周成旭, 等. 产油微藻的筛选及中性脂动态积累过程的检测[J]. 生物物理报, 2010, 26(6): 472-480.
[11] 周成旭, 马斌, 汪飞雄, 等. 海洋原甲藻与三角褐指藻混合培养条件下的种群生长与氮磷营养盐变化[J].海洋科学, 2006, 30(12): 58-61.
[12] 焦念志. 海洋微型生物生态学[M]. 北京: 科学出版社, 2006.
[13] Brand L E, Murphy L S, Guillard R R L, et al.Genetic variability and differentiation in the temperature niche component of the diatomThalassiosira pseudonana[J]. Marine Biology, 1981, 62: 103-110.
[14] Alverson A J, Beszteri B, Julius M L, et al.The model marine diatomThalassiosira pseudonanalikely descended from a freshwater ancestor in the genusCyclotella[J]. BMC Evolutionary Biology, 2011, 11: 125.
[15] Halac S R, Villafane V E, Helbling E W. Temperature benefits the photosynthetic performance of the diatomsChaetoceros gracilisandThalassiosira weissflogiiwhen exposed to UVR [J]. Journal of Photochemistry and Photobiology B: Biology, 2010, 101:196-205.
[16] 康燕玉, 梁君荣, 高亚辉, 等. 氮、磷比对两种赤潮藻生长特性的影响及藻间竞争作用[J].海洋学报, 2006, 28(5): 117-122.
[17] Dyhrman S T, Jenkins B D, Rynearson T A, et al.The transcriptome and proteome of the diatomThalassiosira pseudonanareveal a diverse phosphorus stress response[J]. PLoS ONE, 2012, 7(3): e33768.
[18] Zhao B T, Zhang Y X, Xiong K B, et al. Effect of cultivation mode on microalgal growth and CO2fixation[J]. Chemical Engineering Research and Design, 2011, 8(9): 1758-1762.
(本文编辑: 梁德海)
The study of the culture conditions ofThalassiosira pseudonana
NING Nan-nan, ZHANG Yi, ZHOU Cheng-xu, JIANG Ying, CHEN Yu
(Marine institute of Ningbo University, Ningbo 315211, China)
May, 31, 2013
Thalassiosira pseudonana; culture conditions;cell division
Thalassiosira pseudonanais an important microalgal species in the basic research as model organism, and widely applied in the development as aquaculture feed and biofuel. In the present study, the culture conditions for one strain of oil-richT. pseudonanaisolated from Zhejiang coastal area was analyzed. The cultivation factors included temperature, light intensity, salinity, nitrogen, phosphate, and shaking. The results indicated that: (1) there was no significant difference in growth rate when the strain ofT. pseudonanawas cultured in medium with different salinity ranging from 10‰ to 45‰. However, the species is sensitive to temperature. Even with minor temperature changes between 22 ℃ and 25℃, the growth rate varied significantly. High light intensity (10000lx) together with higher temperature (25℃) could stimulate rapid population growth. At 22℃, growth rate was not affected by the light intensity; (2) this species could absorb nitrogen more rapidly than phosphate, especially in the exponential growth phase. Lack of nitrogen inhibited the cell division and photosynthesis capacity (Fv/Fm). However, such phenomena did not exhibit very obviously for the lack of phosphate; (3) the perturbation, at moderate extent, was better than suspending culture.
S968.4
A
1000-3096(2014)01-0052-05
10.11759/hykx20130129007
2013-05-31;
2013-07-09
海洋可再生能源专项资金项目(GHME2001SW02); 国家公益性行业(海洋)科研专项经费项目(201105009); 浙江省大学生科技创新项目(2011R405028)
宁楠楠(1992-), 女, 浙江衢州人, 本科生, 研究方向为海洋生物学, E-mail:nnn1551@163.com; 周成旭, 通信作者, 副研究员, 主要从事海洋微藻基础研究与应用研究, E-mail: zhouchengxu@nbu.edu.cn
