中国明对虾精氨酸激酶与白斑综合征病毒结构蛋白 VP31的作用初探
2014-03-07刘升平
刘 超, 赵 培, 梁 艳, 高 强, 刘升平 黄 倢
(1. 青岛农业大学 动物科技学院, 山东 青岛 266000; 2. 中国水产科学院 黄海水产研究所, 山东 青岛 266071)
中国明对虾精氨酸激酶与白斑综合征病毒结构蛋白 VP31的作用初探
刘 超1,2, 赵 培2, 梁 艳2, 高 强2, 刘升平1, 黄 倢2
(1. 青岛农业大学 动物科技学院, 山东 青岛 266000; 2. 中国水产科学院 黄海水产研究所, 山东 青岛 266071)
白斑综合征病毒(white spot syndrome virus, WSSV)是危害对虾的主要病原, 给全球水产养殖业带来了巨大经济损失。为研究阻断WSSV的途径, 前期研究WSSV与宿主相结合的受体蛋白发现, 白斑综合征病毒囊膜蛋白VP31可以与中国明对虾(Fenneropenaeus chinensis)精氨酸激酶(FcAK)发生结合作用。精氨酸激酶(AK)通过调节无脊椎动物体内磷酸精氨酸与三磷酸腺苷(ATP)之间平衡在能量代谢、储存和利用方面具有重要作用。作者通过重组表达的rFcAK与rVP31的far-Western blotting分析, 证实两者有结合作用, 此外, rFcAK还与WSSV的VP19、VP28等6种结构蛋白有结合作用。双向电泳分析观察到, rFcAK与rVP31的磷酸化反应后, rVP31部分发生pI降低现象, 提示rVP31可能发生了磷酸化。生物信息学分析表明VP31存在21个精氨酸残基, FcAK具有12个精氨酸结合位点, 这可能为VP31和FcAK的结合活性提供了靶位。为进一步研究WSSV与宿主结合机理及阻断感染的机制提供思路。
精氨酸激酶(AK); 白斑综合征病毒(WSSV); 中国明对虾(Fenneropenaeus chinensis); 结合
对虾白斑综合征病毒(white spot syndrome virus, WSSV)是导致1992年以来对虾爆发性死亡的主要病原, 至今仍给中国对虾养殖业带来重大经济损失[1-6]。通过寻找 WSSV与宿主相结合的受体蛋白, 可以研究阻断WSSV的途径[7-8]。
精氨酸激酶(AK)是一种主要存在于无脊椎动物体内的磷酸原激酶, 可以催化三磷酸腺苷(ATP)与精氨酸之间磷酸基团的可逆性交换, 生成二磷酸腺苷(ADP)和磷酸精氨酸, 在调节无脊椎动物体内磷酸精氨酸与ATP之间的能量平衡、代谢、储存和利用具有重要作用[9-11]。目前对 AK的研究主要集中在进化[12-13]、结构研究[14]、活性[15-23]、结合位点[24]及调节[25]等方面。AK 在与机体病原识别和免疫反应[26-31]等多种重要生理过程中所起的作用也日益引起重视。
本实验室在前期研究中重组表达了WSSV VP31蛋白, 通过Pull-down找到与VP31有相互作用的中国明对虾的 AK蛋白(FcAK), 用 ELISA验证了WSSV VP31与FcAK的结合活性(另文报道)。在此基础上, 作者探索了FcAK与WSSV囊膜蛋白VP31的作用方式, 为揭示 WSSV感染宿主机理的深入研究打下基础。
1 材料和方法
1.1 病毒和表达菌株
纯化WSSV由本实验室制备, 浓度为4.8×105个/μL,保存于-80℃。WSSVvp31和中国明对虾 AK基因(Fcak)的表达载体pET30a-vp31和pET30a-fcak的E. coliBL21菌株由本实验室构建(另文报道), 该表达载体带有卡那霉素抗性基因, 所表达的目的蛋白带有6×His标签。
1.2 rVP31和rFcAK的分别表达及产物纯化
分别取-80℃保存的含pET30a-vp31和pET30afcak的E. coliBL21菌株, 按1∶1000的体积比接种于200 mL LB液体培养基(含30 μg/mL卡那霉素)中, 37℃振荡过夜培养至对数生长期。加入 IPTG 至0.4 mmol/L, 37℃诱导表达4 h。分别将菌液以10 000×g离心5 min。收集离心沉淀, 加入20 mL裂解液(10 mmol/L Tris-HCl, 1 mmol/L EDTA, 10 mmol/L CaCl2)重悬, 200W超声破碎300次(每次超声1 s间隔2 s), 10 000×g离心5 min, 收集包涵体沉淀, 用足量A液(9.5 mmol/L NaH2PO4, 40.6 mmol/L Na2HPO4, 6 mol/L盐酸胍, 0.3 mol/L NaCl, pH7.0)充分溶解2 h, 经0.45 μm滤膜过滤, 添加到5 mL Co2+亲和层析柱, 用A液过柱清洗非特异性结合蛋白, 再用 C液(4.3 mmol/L NaH2PO4, 18.2 mmol/L Na2HPO4, 5.4 mol/L 盐酸胍, 0.27 mol/L NaCl, 0.15 mol/L 咪唑, pH7.0)洗脱目标蛋白并收集。
1.3 rVP31和rFcAK的复性
洗脱的rVP31和rFcAK溶液各40 mL分别装入2只透析袋, 置于2 L尿素透析复性缓冲液(50 mmol/L NaCl, 1 mmol/L EDTA, 10%甘油, 1%甘氨酸, 50 mmol/L Tris-HCl, 6 mol/L尿素, pH8.0)在4℃透析10 h, 依次换入尿素浓度为4、2 和0 mol/L的透析复性缓冲液中各10 h, 用离心超滤管(Ultra-15, Millipore)各浓缩蛋白至4 mL, 5000×g, 4℃离心30 min。
1.4 rFcAK的地高辛(DIG)标记
取地高辛蛋白标记物(Roche)按 20 µg/µL溶于DMSO, 将50 µL上述溶液加入100 µL 360 μg/mL的rFcAK蛋白中, 室温孵育2 h, 然后在PBS中透析过夜至无多余 DIG蛋白标记物, 所得地高辛标记的rFcAK(DIG-rFcAK)经Bradford测定蛋白浓度, 保存于-75℃备用。
1.5 rFcAK与rVP31及WSSV的far-Western检测
rVP31和WSSV分别经SDS-PAGE电泳后转印到PVDF膜, 再将转印后的PVDF膜放入1% BSA封闭液(用 PBST配制)内 4℃过夜封闭。用 1× PBST (PBS含0.05% Tween-20)室温漂洗10 min。将PVDF膜置于5 mL 180 μg/mL DIG-rFcAK 37℃, 孵育2 h。1×PBST漂洗3次, 每次10 min后, 将印迹膜放入1∶10000稀释的碱性磷酸酶(AP)偶联抗 DIG抗体(Anti-DIG-AP)(Roche)中, 37℃孵育1.5 h。1× PBST漂洗3次, 每次10 min后, 将PVDF膜放入显色盒中,加入NBT/BCIP显色液(Sigma)反应约1~5 min。最后将PVDF膜转入凝胶成像仪中拍照。
1.6 体外磷酸化反应中rFcAK对rVP31的作用
按 Duan[32]和刘斌[33]的方法, 略作改动, 将 rFcAK(360 μg/mL)和rVP31(360 μg/mL)各1 mL分别置于透析袋放入激酶缓冲液(50 mmol/L HEPES, 150 mmol/L NaCl, 1 mmol/L NaF, 1 mmol/L Na3VO4, 1 mmol/L DTT, 10 mmol/L MnCl2, 1% Tween 20, 0.2% NP-40, pH7.5)中进行透析。混合rVP31和rFcAK, 然后加入ATP (100 mmol/L, pH7.5)母液至2.5 mmol/L, 30℃振荡孵育20 min进行体外磷酸化反应。
1.7 双向电泳
用 2D Clean-up 试剂盒(GE)处理体外磷酸化反应前后的rVP31样本。选择18 cm的IPG胶条(pH3-10, GE), 上样蛋白各120 μg/350 μL, 进行第一向等电聚焦(Ettan IPGphor, GE), 运行参数为: 30V 10~12 h水化, 梯度升高电压500 V 3 h, 1 000V 3 h, 2 000V 1 h, 5 000V 3 h, 8 000 V 3 h, 8 000 V Step-n-hold 32000 V·h, 20℃。聚焦完成的 IPG胶条用平衡缓冲液 I (50 mmol/L Tris-HCl, 6 mol/L 尿素, 30%甘油, 2% SDS, 0.002% 溴酚蓝, 1% DTT, pH8.8), 平衡缓冲液II(50 mmol/L Tris-HCl, 6 mol/L尿素, 30%甘油, 2% SDS, 0.002%溴酚蓝, 2.5%碘乙酰胺, pH8.8)各平衡15 min。
将平衡后的 IPG胶条转移至制备好的 12.5% SDS-聚丙烯酰胺凝胶顶面, IPG胶条与 SDS-聚丙烯酰胺凝胶胶面完全接触。在凝胶的上方加入低熔点琼脂糖封胶液。按 1W 恒功率垂直电泳使样品浓缩进胶后, 再用16W恒功率进行第二向垂直电泳(Ettan DALTsix, GE), 温度控制在10~15℃。
1.8 凝胶染色与扫描分析
将2D凝胶置于固定液(40% 甲醇, 10% 乙酸)30 min,不停摇动。倒掉固定液, 用去离子水清洗4遍, 每次摇动 15 min。将去离子水倒掉, 加入染色液(0.12%考马斯亮蓝G250, 10% (NH4)2SO4, 10% H3PO4, 20%甲醇)振荡染色过夜。倒掉染色液, 用去离子水清洗凝胶数遍, 或振荡至背景比较低为止。对胶体进行扫描(ImageScanner扫描仪)。
1.9 VP31和FcAK氨基酸序列的生物信息学分析
对VP31和FcAK (GenBank: AAV83993)的氨基酸序列进行生物信息学分析。利用Expasy中的工具ProtParam(http://web.expasy.org/protparam/) 分 析VP31和FcAK蛋白的pI和氨基酸含量; 利用在线分析蛋白质跨膜区程序 Tmpred(http://www.ch.embnet. org/software/TMPRED_form.html)检测VP31和FcAK蛋白潜在跨膜区; 利用在线工具 SignalP 4.0(http://www.cbs.dtu.dk/services/SignalP/)对 VP31和 FcAK 蛋白进行信号肽预测; 利用 NCBI/ BLAST(http://blast.ncbi.nlm. nih.gov/Blast.cgi) 对VP31和FcAK蛋白进行蛋白序列同源性分析; 利用在 线 工 具 TargetP (http://www.cbs.dtu.dk/services/TargetP/)对VP31和FcAK蛋白进行亚细胞定位预测; 通过工具 PSORT (http://psort.nibb.ac.jp/form2.html)预测 FcAK蛋白的亚细胞定位; 使用在线工 具 NLStradamus (http://www.moseslab.csb. utoronto.ca/NLStradamus/)对 FcAK蛋白进行核定位信号(NLS)预测; 利用 kinasephos2(http://kinasephos2. mbc.nctu.edu.tw/)对VP31蛋白进行磷酸化位点分析。
2 结果
2.1 rVP31和rFcAK的原核表达和纯化
含pET30a-vp31和pET30a-fcak的E. coliBL21菌株经 IPTG诱导表达的产物用 Co2+亲和层析柱纯化和复性后, SDS-PAGE显示(图1), 相应泳道分别在35和 45kD大小处有单一蛋白条带, 表明 rVP31和rFcAK得到成功表达和有效纯化。
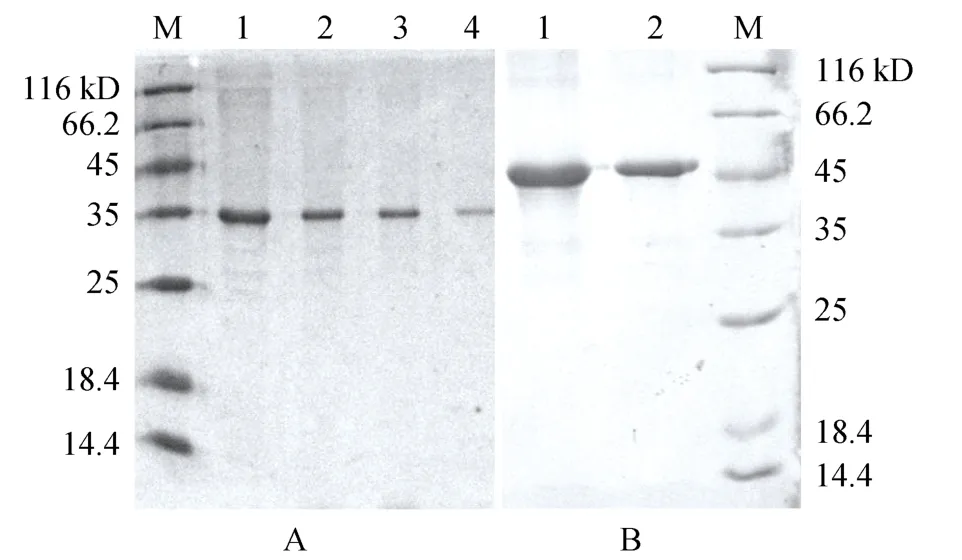
图1 纯化的rVP31和rFcAK的SDS-PAGEFig. 1 SDS-PAGE of purified rVP31 and rFcAK
2.2 rVP31和 rFcAK结合的 far-Western blotting验证
将表达纯化的rVP31进行SDS-PAGE后转印至PVDF膜, 与 DIG-rFcAK进行 far-Western blotting,结果显示, 在约35KD左右出现了显色条带, 条带位置与表达纯化的rVP31相同, 证明rFcAK与rVP31有结合反应。
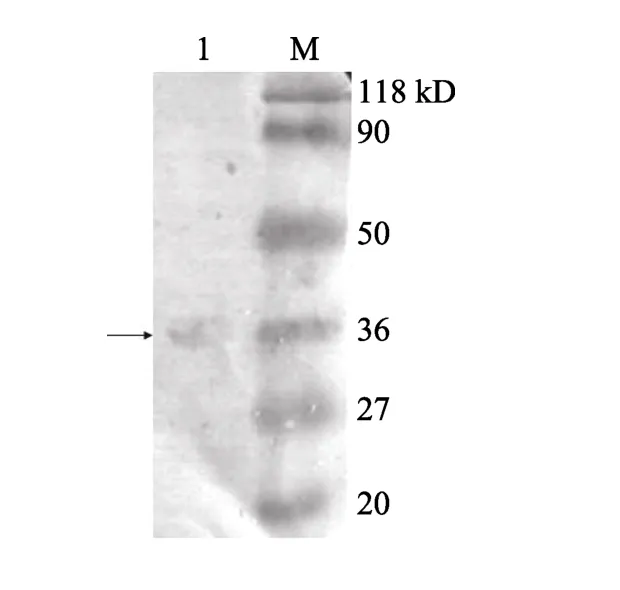
图2 rVP31与DIG-rFcAK的Far-Western blottingFig. 2 Far-Western blotting of rVP31 and DIG-rFcAK
2.3 rFcAK与WSSV结构蛋白的far-Western blotting分析
将纯化的WSSV进行SDS-PAGE后转印至PVDF膜, 与DIG-rFcAK进行far-Western blotting。经显色后, 在VP31条带大小约31.4kD处[34]有条带显色(图3)。Far-Western显示WSSV结构蛋白中还有一些蛋白带与 rFcAK结合后呈现显色反应,使用 Gel-Pro Analyzer 计算分子量, 这些显色带的分子量分别为90、74、47、36、27、20.7 kD, 表明FcAK可能还与WSSV的其他结构蛋白能发生结合作用。

图3 WSSV与DIG-rFcAK的Far-Western blotting分析Fig. 3 Far-Western blotting of WSSV and DIG-rFcAK
2.4 双向电泳检测rFcAK对rVP31的体外磷酸化作用
FcAK与VP31的结合如果能导致VP31的精氨酸残基的磷酸化反应, 将使VP31带有一个到多个磷酸基团, 等电点降低, 通过双向电泳就能区分出磷酸化的VP31(图4)。将rFcAK和rVP31分别放入激酶缓冲液中透析后, 加入ATP, 进行体外磷酸化反应,用双向电泳检测, 结果显示, 纯化的rVP31和rFcAK的等电点pI分别为6.51±0.20和6.52±0.15; 经磷酸化反应后, 在与rVP31蛋白基本相同分子量的低pH侧出现 1个较淡的新的蛋白点(pI=5.4), 新蛋白点的强度为原始位置蛋白点强度的 8.6%, 符合磷酸化蛋白质的双向电泳变化规律, 表明约8%的rVP31可能发生了磷酸化反应。

图4 rVP31和rFcAK体外磷酸化的双向电泳检测结果Fig. 4 Two-dimensional electrophoresis results after in vitro phosphorylation of rVP31 and rFcAK
2.5 VP31和FcAK氨基酸序列的生物信息学分析
经在线生物信息学工具的分析表明, VP31含261aa, 理论分子量为 29.8kD, 理论等电点为 6.68,含21个精氨酸残基(8.0%), 该蛋白含有共36个潜在磷酸化位点, 不含有跨膜结构域和明显的线粒体和胞外分泌导肽。FcAK含356aa, 理论分子量40.1kD,理论等电点为5.87, 含有15个ADP结合位点, 12个精氨酸结合位点, 以及22个位于近C端的底物特异性环形结构, 在 267~283位有一个从外向内的跨膜螺旋, N端位于膜外, 不含明显的线粒体和胞外分泌导肽, 不包含明显的核定位信号, 其亚细胞定位在细胞质中的可能性为 65.2%, 在线粒体中可能性为21.7%, 在液泡中的可能性为4.3%, 在囊泡中的可能性4.3%, 在细胞核中的可能性为4.3%。
3 讨论
激酶是催化ATP上的5′-磷酸基团转移到特定靶分子上的酶。精氨酸激酶主要存在于无脊椎动物体内, 它不仅具有调节能量平衡等的重要作用, 还可能参与病原识别与免疫反应。
Astrofsky等[35]用 RNA差异显示技术对健康和感染WSSV的细角滨对虾(Litopenaeus stylirostris)进行比较, 发现 WSSV感染后精氨酸激酶上调。而Wang等[36]利用基因芯片技术对感染WSSV后6 h和自然感染 WSSV垂死的中国明对虾分析, 显示精氨酸激酶基因在感染WSSV后下调。Zeng等[37]利用抑制消减杂交技术和基因芯片检测感染WSSV的克氏原螯虾的上调基因中有精氨酸激酶。这说明 AK基因的表达的确受WSSV感染的影响, 可能在WSSV感染过程中发挥作用, 但具体是上调或下调可能取决于病毒感染的进程。
VP31为WSSV囊膜蛋白[34,38], 带有与细胞相互作用的RGD位点, 含有8%的精氨酸, 具有36个潜在磷酸化位点。本实验室前期研究采用原核表达的rVP31对中国明对虾细胞的蛋白质进行 far-Western blotting发现FcAK是VP31的一种潜在结合蛋白(另文报道)。作者采用原核表达的rFcAK对原核表达的rVP31进行far-Western blotting证实了这种结合作用的存在, 进而通过 rFcAK与 WSSV结构蛋白的far-Western blotting发现, 除了VP31以外, rFcAK还可能与WSSV VP19、VP28、VP26以及其他3种蛋白质发生不同程度的结合反应, 表明WSSV与FcAK之间可能具有多方面的重要作用。
作者尝试采用磷酸化反应和双向电泳对 rFcAK与 rVP31的相互作用进行检测, 观察到磷酸化反应后 rVP31可能存在磷酸化的形式, 生物信息学分析表明, VP31含21个精氨酸残基, 而FcAK有12个精氨酸结合位点, 这可能为VP31和FcAK的结合的提供了靶位, 并可能引起VP31的磷酸化。
[1] 黄倢, 宋晓玲, 于佳. 杆状病毒性的皮下及造血组织坏死——对虾爆发性流行病的病原和病理学[J]. 海洋水产研究, 1995, 16(1): 1-10.
[2] 蔡生力, 黄倢, 王崇明, 等. 1993~1994年对虾爆发病的流行病学研究[J]. 水产学报, 1995, 19(2): 112-117.
[3] 易志刚, 黄倢, 解飞霞, 等. 对虾白斑综合症病毒与虾鳃细胞膜特异性结合关系的确立[J]. 中国病毒学, 2003, 18(3): 295-297.
[4] 许华, 黄倢, 杨官品. 对虾白斑综合征病毒蛋白质组的研究进展[J]. 海洋水产研究, 2008, 29(2): 118-125.
[5] 莫照兰, 雷质文, 杨冰, 等. 对虾 WSSV人工感染螯虾及其检测[J]. 海洋科学, 2002, 26(3): 43-46.
[6] 许雅香, 许梓荣, 朱玉芳, 等. 对虾白斑综合征病毒分子生物学研究进展[J]. 海洋科学, 2004, 28(12): 63-66.
[7] 陆春玲, 黄倢, 李贇. 动物病毒受体阻断剂的研究进展[J]. 中国水产科学, 2004, 11(1): 82-88.
[8] 梁艳, 宋晓玲, 黄倢, 等. 地高辛标记白斑综合征病毒(WSSV)及其与宿主细胞间结合现象观察[J]. 海洋与湖沼, 2003, “973”专辑: 1-9.
[9] Wallimann T, Wyss M, Brdiczka D, et al.. Intracellular compartmentation, structure and function of creatine kinase isoenzymes in tissues with high and fluctuating energy demands: the 'phosphocreatine circuit' for cellular energy homeostasis [J]. Biochem J, 1992, 281(1): 21-40.
[10] Holt S M, Kinsey S T. Osmotic effects on arginine kinase function in living muscle of the blue crabCallinectes sapidus[J].Biol, 2002, 205(12):1775-1785.
[11] Kinsey S T, Lee B C. The effects of rapid salinity change onin vivoarginine kinase flux in the juvenile blue crab,Callinectes sapidus[J]. Comp Biochem Physiol B, 2003, 135(3): 521-531.
[12] Suzuki T, Kamidochi M, Inoue N, et al. Arginine kinase evolved twice: evidence that echinoderm arginine kinase originated from creatine kinase [J]. Biochem, 1999, 340(3): 671-675.
[13] Iwanami K, Iseno S, Uda K, et al. A novel arginine kinase from the shrimpNeocaridina denticulata: The fourth arginine kinase gene lineage [J]. Gene, 2009, 437(1-2): 80-87.
[14] 郭淑元, 叶盛, 王政, 等. 精氨酸激酶及其底物复合物的结晶和结晶学初步研究[J]. 自然科学进展, 2004, 14(12): 1475-1477.
[15] Guo Q, Zhang J W, Liu T T, et al. Intermediates in the refolding of urea-denatured dimeric arginine kinase fromStichopus japonicus[J]. Int J Biol Macromol, 2007, 41(5): 521-528.
[16] 王政, 郭淑元, 张建伟, 等. 用点突变方法研究海参精氨酸激酶的活性位点[J]. 清华大学学报(自然科学版), 2005, 45(6): 858-861.
[17] Wu Q Y, Li F, Wang X Y. Evidence that the amino acid residue P272 of arginine kinase is involved in its activity, structure and stability [J]. Int J Biol Macromol, 2008, 43(4): 367-372.
[18] Liu T T, Wang X C. Effects of N-terminal deletion mutation on arginine kinase from the sea cucumberStichopus japonicus[J]. Int J Biol Macromol, 2008, 42(1): 68-74.
[19] Tada H, Nishimura Y, Suzuki T. Cooperativity in the two-domain arginine kinase from the sea anemoneAnthopleura japonicus[J]. Int J Biol Macromol, 2008, 42(1): 46-51.
[20] Wu X Q, Zhu W J, Lü Z R, et al.. The effect of rutin on arginine kinase: inhibition kinetics and thermodynamics merging with docking simulation [J]. Int J Biol Macromol, 2009, 44(2): 149-155.
[21] Arockiaraj J, Vanaraja P, Easwvaran S, et al. Gene profiling and characterization of arginine kinase-1 (MrAK-1) from freshwater giant prawn (Macrobrachium rosenbergii) [J]. Fish Shellfish Immunol, 2011, 31(1): 81-89.
[22] Suzuki T, Yamamoto K, Tada H, et al. Cold-adapted features of arginine kinase from the deep-sea clamCalyptogena kaikoi[J]. Mar Biotechnol (NY), 2012, 14(3): 294-303.
[23] 刘陶陶, 王希成. 铜离子对海参精氨酸激酶活力与结构的影响[J]. 海洋科学, 2011, 35(1): 17-21.
[24] France R M, Sellers D S, Grossman S H. Purification, characterization, and hydrodynamic properties of argnine kinase from gulf shrimp (Penaeus aztecus) [J]. Arch Biochem Biophys, 1997, 345(1): 73-78.
[25] Dawson N J, Storey K B. Regulation of tail muscle arginine kinase by reversible phosphorylation in an anoxia-tolerant crayfish [J]. J Comp Physiol B, 2011, 181(7): 851-859.
[26] Yao C L, W u C G, Xiang J H, et al. Molecular cloning and response to laminarin stimulation of arginine kinase in haemolymph in Chinese shrimp,Fenneropenaeus chinensis[J]. Fish Shellfish Immunol, 2005, 19(4): 317-329.
[27] Rattanarojpong T, Wang H C, Lo C F, et al. Analysis of differently expressed proteins and transcripts in gills ofPenaeus vannameiafter yellow head virus infection [J]. Proteomics, 2007, 7(20): 3809-3814.
[28] Abe H, Hirai S, Okada S. Metabolic responses and arginine kinase expression under hypoxic stress of the kuruma prawnMarsupenaeus japonicus[J]. Comp Biochem Physiol A, 2007, 146(1): 40-46.
[29] García-Orozco K D, Aispuro-Hernández E, Yepiz-Plascencia G, et al. Molecular characterization of arginine kinase, an allergen from the shrimpLitopenaeus vannamei[J]. Int Arch Allergy Immunol, 2007, 144(1): 23-28.
[30] Shen Y, Cao M J, Cai Q F, et al. Purification, cloning, expression and immunological analysis ofScylla serrataarginine kinase, the crab allergen [J]. J Sci Food Agric, 2011, 91(7): 1326-1335.
[31] Song C, Cui Z, Liu Y, et al. Cloning and expression of arginine kinase from a swimming crab,Portunus trituberculatus[J]. Mol Biol Rep, 2012, 39(4): 4879-4888.
[32] Duan C Q, Shen Y Y, Liang X E, et al. Membrane associated protein kinase activities in developing apple fruit [J]. Physiol Plant, 2003, 118: 105-113.
[33] 刘斌, 宋宜, 董燕, 等. 蛋白质体外磷酸化方法的建立[J]. 生物化学与生物物理进展, 2003, 30(1): 112-115.
[34] Tsai J M, Wang H C, Leu J H, et al. Genomic and proteomic analysis of thirty-nine structural proteins of shrimp white spot syndrome virus [J]. J Virol, 2004, 78(20): 11360-11370.
[35] Astrofsky K M, Roux M M, Klimpel K R, et al. Isolation of differentially expressed genes from white spot virus (WSV) infected Pacific blue shrimp (Penaeus stylirostris) [J]. Arch Virol, 2002, 147(9): 1799-1812.
[36] Wang B, Li F, Dong B, et al. Discovery of the genes in response to white spot syndrome virus (WSSV) infection inFenneropenaeus chinensisthrough cDNA microarray [J]. Mar Biotechnol (NY), 2006, 8(5): 491-500.
[37] Zeng Y, Lu C P. Identification of differentially expressed genes in haemocytes of the crayfish (Procambarus clarkii) infected with white spot syndrome virus by suppression subtractive hybridization and cDNA microarrays [J]. Fish Shellfish Immunol, 2009, 26(4): 646-650.
[38] Li L, Xie X, Yang F. Identification and characterization of a prawn white spot syndrome virus gene that encodes an envelope protein VP31 [J]. Virology, 2005, 340(1): 125-132.
(本文编辑: 谭雪静)
Preliminary study on the conjunction between arginine kinase ofFenneropenaeus chinensisand the structure proteins of white spot syndrome virus (WSSV)
LIU Chao1,2, ZHAO Pei2, LIANG Yan2, GAO Qiang2, LIU Sheng-ping1, HUANG Jie2
(1. Animal Science College, Qingdao Agriculture University, Qingdao 266000, China; 2. Yellow Sea Fisheries Research Institute, Chinese Academy of Fishery Sciences, Qingdao 266071, China)
Jul., 2, 2012
Arginine kinase (AK); WSSV;Fenneropenaeus chinensis; binding activity
White spot syndrome virus (WSSV) is a major shrimp pathogen causing big economic losses all over the world. Inorder ro explore ways to block WSSV infection, we worked on WSSV-binding host receptor proteins, , and we found that envelope protein VP31 of WSSV was able to engage with arginine kinase ofFenneropenaeus chinensis(FcAK). Arginine kinase (AK) plays important roles in the metabolism, storage and utilization of energy by regulation of the balance between phosphorylation of arginine and ATP in invertebrate. The present study proves the binding between the recombinant FcAK (rFcAK) and VP31 (rVP31) using far-Western blotting. Furthermore, the far-Western blotting also showed that rFcAK was able to bind other 6 structural proteins of WSSV, including VP19 and VP28. Two-dimensional electrophoresis analysis showed that part of VP31 migrated to the spot with reduced pI after thein vitrophosphorylating incubation between rFcAK and rVP31, suggesting that the rVP31 might be phosphorylated. The bioinformatics analysis showed that VP31 had 21 arginine residents and FcAK had 12 arginine binding sites. They may provide the loci for the binding activity between VP31 and FcAK. We’ll further elucidate the underlying binding mechanism between WSSV and host, and try to find ways to block the infection of WSSV.
S917.4
A
1000-3096(2014)03-0104-07
10.11759/hykx20120702003
2012-07-02
2012-12-18
现代农业产业技术体系专项资助项目(CARS-47); 公益性行业(农业)科研专项经费资助项目(201103034)
刘超(1986-), 女, 山东青岛人, 硕士研究生, 主要从事对虾病毒 WSSV 的生化及分子生物学研究, 电话: 0532-85823062, E-mail: lucy.mary@163.com; 黄倢, 通信作者: E-mail: huangjie@ysfri.ac.cn
