Taguchi正交法优化奥沙利铂长循环脂质体的制备
2014-03-07CheragaNihad涂家生
Cheraga Nihad,沈 雁,涂家生
(中国药科大学药剂学教研室,江苏南京210009)
·实验研究·
Taguchi正交法优化奥沙利铂长循环脂质体的制备
Cheraga Nihad,沈 雁,涂家生
(中国药科大学药剂学教研室,江苏南京210009)
目的通过优化奥沙利铂(L-OHP)长循环脂质体的制备工艺,以提高其包封率(entrapment efficiency,EE%)并达到缓释效果。方法采用Taguchi正交法L9(34)(TOA),以包封率作为考察指标并采用超滤法检测包封率。考察了L-OHP脂质体的粒径、zeta电位、形态以及体外释放行为。结果药物与脂质间的比例(W/W),胆固醇与磷脂酰胆碱的比值(M/M)和超声时间是影响最大的三个因素(P<0.05)。此外,优化后的奥沙利铂脂质体经mPEG修饰后与未修饰的奥沙利铂脂质体相比较,具有更好的物理化学特性,其粒径为(204±1.1)nm,包封率高达25.40%±2.5%。修饰后的脂质体在透射电子显微镜下呈现球形结构,具有较大的内部空间,脂质体表面可见白色mPEG层状结构。经mPEG修饰的奥沙利铂脂质体相比于未修饰的脂质体,具有更低的体外释放速率,具有一定缓释能力。修饰与未修饰的脂质体以及奥沙利铂溶液均符合一级释放模型,拟合系数为0.990 2。结论经Taguchi正交法优化后的奥沙利铂长循环脂质体可作为一种新型的肿瘤靶向药物传递系统。
Taguchi正交法;mPEG修饰;脂质体;奥沙利铂;药物传递系统
奥沙利铂(L-OHP)属于第三代铂类抗肿瘤化 合物。现已批准奥沙利铂与5-氟尿嘧啶(5-FU)/亚叶酸钙(FOLFOX)[1,2]联合用药,是临床治疗转移性或晚期结直肠癌的一线和二线药物。奥沙利铂与顺铂类似,通过与DNA形成DNA加合物从而抑制DNA的合成。此外,与顺铂不同,它也能抑制RNA的合成[3]。然而,单独用药时,其临床疗效相对较低,是由于其药代动力学特性导致,如高度不可逆地结合到血浆蛋白和组织蛋白以及红细胞[4]。此外,它具有剂量限制性副作用,如外周感觉神经病变和血小板减少症[5]。因此,为克服以上缺点,可以利用载体将奥沙利铂包裹,制备成奥沙利铂脂质体以减少临床使用的副作用。
脂质体是早期纳米级别的药物递送系统之一,通过改变小分子抗癌药物的组织分布,从而增加其在实体瘤部位的蓄积,提高肿瘤靶向性[6]。脂质体已被多次证明能够提高各种药物的治疗指数。此外,将聚乙二醇(PEG)-衍生化磷脂接入脂质体膜,可以通过防止脂质体与生物体内环境的相互作用而实现长循环效应[7],并增强脂质体到实体瘤的外渗作用,这一现象称为EPR效应(Enhanced Permeability and Retention Effect)。对于大分子和脂质类分子,包括脂质体[8]而言,都具有上述特点。本研究的目的是使用Taguchi正交法(TOA)优化得到mPEG-修饰的奥沙利铂脂质体的最佳处方工艺,同时还研究了不同因素对奥沙利铂脂质体包封率的影响。此外,考察了经过mPEG-修饰的奥沙利铂脂质体和未修饰脂质体的体外释放行为的差异。
1 材料
奥沙利铂(购自上海浩然生物技术有限公司);磷脂酰胆碱(PC),胆固醇(Chol),1,2-二硬脂酰-sn-甘油-3磷酸乙醇胺-N-[顺丁烯二酰亚胺(聚乙二醇)-2000](DSPE-PEG2000)(购自AVT制药有限公司,中国上海);TritonX-100(阿拉丁,中国上海);其他试剂均为分析纯。
2 方法
2.1 奥沙利铂脂质体的制备 Szoka等[9]采用逆向蒸发法(REV)制备得到奥沙利铂脂质体(PC/CHOL)和经mPEG2000-DSPE修饰的奥沙利铂脂质体,即按照一定的摩尔比将脂质溶解于氯仿/乙醚的混合液中,然后向该脂质溶液中逐滴加入奥沙利铂的9%蔗糖溶液(W/V)10 mL,使其形成W/O乳液。水相和有机相的体积比为1∶3,采用探头式超声仪(南京先欧仪器制造有限公司,20100071)将乳液超声一定时间后,于40℃减压旋蒸1 h,即得奥沙利铂脂质体。将制得的产物分别通过0.8、0.45和 0.22μm聚碳酸酯滤膜,得到大小均匀的脂质体。
2.2 试验设计 使用Taguchi正交表L9(34)(TOA),对所选因素进行筛选,得到制备高包封率L-OHP脂质体的最佳处方工艺。药物与脂质的比例(W/W),胆固醇和磷脂酰胆碱的比例(M/M),氯仿与乙醚的比例(V/V),以及超声时间,4者作为影响OHP包封率最重要的因素加以考察。这4个影响因素分别在3个水平下进行研究,如表1所示。通过L9(34)设计的9组实验中每组试验重复3次(表2)。使用Design Expert Version 8.0.6软件设计试验并评估设计的试验。采用方差分析(ANOVA)检测试验模型是否具有显著性差异。

表1 因素水平L9(34)TOA试验设计

表2 L9(34)TOA试验结果
2.3 粒径和Zeta电位 使用Zeta Plus粒子分析仪(Brookhaven Instruments Corporation,美国),利用动态光散射测定粒径和多分散系数(PDI)(25℃)。Zeta电位使用Zetasizer(Brookhaven,美国)测定。每个结果重复测定3次。
2.4 奥沙利铂HPLC分析 使用HPLC法测定奥沙利铂的浓度。试验采用Dionex 3000 Ultimate(泵:LPG-3400SD,检测器:VWD-3100,工作站:Chromeleon 6.8 SR11 Build 3161)。流动相为水-甲醇(95∶5,V/V),流速为1 mL·min-1。色谱柱为Inertsil ODSC18(4.6 mm×250 mm,5μm),检测波长为250 nm,柱温30℃,进样量20μL,检测时间15 min。奥沙利铂的标准曲线在5~100μg·m-1范围内呈线性,r=0.999 7。
2.5 包封率 包封率利用改进的超滤法进行测定[10]。使用9%蔗糖溶液(W/V)将脂质体稀释十倍,取200μL奥沙利铂脂质体混悬液,加入超滤管(截留分子量10 000)。在4℃下,以13 000 rpm离心20 min,将游离奥沙利铂从脂质体中分离出。收集滤液,利用上述的HPLC法检测游离药物的浓度。另取奥沙利铂脂质体混悬液,加入10%Triton X-100破坏脂质体,释放包封的奥沙利铂,用HPLC法测定奥沙利铂的总浓度。并对该方法进行回收率实验验证。将3种不同浓度的游离奥沙利铂溶液分别与空白脂质体混合。将混合物振摇10 min后,超滤。收集超滤液,测得奥沙利铂的浓度。回收率结果应在90%~110%的标准范围内。
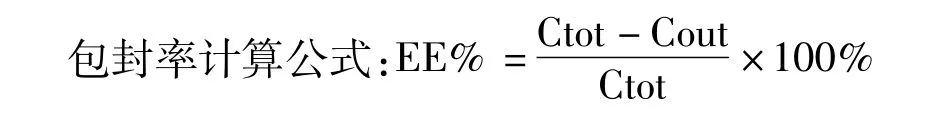
Cout表示脂质体混悬液中未包封的药物浓度;Ctot表示脂质体混悬液中药物的总浓度。所有试验重复测3次。
2.6 体外释放 使用透析法在9%蔗糖溶液中测奥沙利铂脂质体的体外释放曲线。将1 mL脂质体置于透析袋内(截留分子量14 000),将透析袋密封后,完全浸入50 mL释放介质中,于37℃水浴中振摇(转速100 rpm)。于预设时间点15 min、30 min、45 min、1 h、1.5 h、2 h、2.5 h、3 h、4 h、5 h、6 h、8 h,分别从介质中取出1 mL溶液,并补充1 mL释放介质。采用HPLC法测定并计算脂质体中奥沙利铂的释放量。以L-OHP在9%的蔗糖溶液中的释放作为对照,计算得到累积释放度。
2.7 透射电子显微镜(TEM) 修饰和未修饰DSPE-PEG2000的脂质体通过透射电镜(TEM)(日立7650型电子显微镜,日本东京)扫描(加速电压为80 kV)。脂质体用蒸馏水稀释,滴至铜网表面,用滤纸除去过量的样品后,自然挥干。以2%磷钨酸水溶液进行负染,室温下放置,待干燥后进行观察。
3 结果
3.1 试验设计和分析 Taguchi正交法最大的特点在于,可以利用最少的试验达到预设的优化目的[11]。在本研究中,4因素3水平的研究正是采用了该方法。对方差R进行分析,以选择各因素水平的最佳组合。计算得到的每一水平的平均值Kn见表2。对包封率的不同影响因素中,按照影响力大小排列,分别是:药物与脂质的比例(W/W),胆固醇和磷脂酰胆碱的比例(M/M),超声时间以及氯仿/乙醚的体积比。使用Design Expert version 8.0.6对TOA进行方差分析。如表3所示,方差分析的结果表明,该模型有显著性差异(P<0.05),其中药物与脂质的比例(A),胆固醇和磷脂酰胆碱的比例(B)和超声时间(D)具有统计学意义的显著差异(P<0.05)。

表3 TOA的方差分析
3.2 不同因素对于包封率和优化配方的影响 如图1所示,各因素各水平对于包封率的影响。胆固醇和磷脂酰胆碱的比例(B)增加,包封率增加,在1水平(1∶2)的时候达到最大值。此外,减少奥沙利铂的用量,包封率降低,1水平达到最大值。超声时间同样影响药物包封,1水平(5 min)为最优结果。分析方差结果可知,溶剂比的影响较小(P>0.05)。4个因素的优化结果为A1B1C3D1。因此,优化的制备条件为:脂质和药物的重量比1∶20,胆固醇和磷脂酰胆碱的摩尔比为1∶2,超声时间5 min,氯仿/乙醚体积比为1∶3。优化后的L-OHP脂质体物理化学性质见表4。

表4 优化L-OHP脂质体理化性质
3.3 L-OHP脂质体的理化特性 L-OHP的包封率为25.4%±1.5%,PEG修饰的脂质体包封率为23.46%±1.7%。然而,与未修饰的脂质体相比,mPEG修饰的脂质体PDI更低,二者有显著性差异(P<0.05)。实验表明PEG修饰后的脂质体具有较小的粒径分布,脂质体的粒径更加均一。PEG修饰的脂质体Zeta电位小于未修饰脂质体,说明DSPE-PEG2000一定程度上增大了膜的稳定性。利用TEM观察不同脂质体的形态。如图2所示,L-OHP脂质体具有球形结构,内部空间更大。而经过DSPE-PEG2000修饰的脂质体,可以观察到在脂质体外层有白色mPEG修饰层,证明脂质体修饰成功。

图1 奥沙利铂脂质体影响因素实验

图2 优化的未修饰L-OHP脂质体TEM图谱(a);优化的mPEG修饰L-OHP脂质体TEM图谱(b);未修饰L-OHP脂质体与mPEG修饰的L-OHP脂质体在9%蔗糖溶液中的体外释放曲线(c)
3.4 体外释放 采用优化工艺制备得到的奥沙利铂脂质体在9%蔗糖溶液中的体外释放曲线见图2c。在9%葡萄糖溶液中,L-OHP溶液在2 h内释放可达94%,未经修饰的脂质体释放达到80%,而经过PEG修饰的脂质体在2 h内释放约为62%。在经过前2 h的突释过程后,L-OHP趋于稳定释放。分别将释放结果带入零级模型,一级模型和Huguchi模型进行拟合。比较拟合的相关系数,其中一级释放模型(r=0.990 2)为药物从脂质体中释放的最佳释放模型。
4 讨论
奥沙利铂(L-OHP)是第三代铂类似物,与前几代相比,如顺铂和卡铂,奥沙利铂具有更好的活性和安全性。然而,其临床疗效在体内受到了剂量依赖神经毒性和对血红蛋白的高分区的限制[4]。因此,需要利用药物传递系统以减少其毒副作用,提高治疗指数。理想的奥沙利铂药物传递系统,应具有一定选择性的传递,以及通过提高药物在肿瘤组织的渗透和滞留效应(EPR效应)从而实现药物在肿瘤组织的蓄积和被动靶向[12]。然而,奥沙利铂良好的水溶性和低亲脂性使得药物难以被载入脂质体内[13]。而且脂质体包封率和粒径分布的均一性对制备方法具有较高依赖[14]。在本研究中,基于大多数文献有关铂及其衍生物相关载体的报道,选择使用REV方法制备奥沙利铂脂质体并实现被动靶向。之所以选择这种方法,是由于其对水溶性药物的包封率较高,可达50%[9]。针对血液循环中的稳定性问题,可通过将稳定剂接入脂质双分子层加以克服。为了减小网状内皮系统(RES)对脂质体的吞噬,引入了PEG化脂质(DSPE-PEG2000),实现在血液中的长循环效应。据报道,REV方法的包封率受多种因素影响,包括PC与胆固醇的比例,药物与脂质的比例,油相与水相比例,超声时间等[15]。在这项研究中,通过正交实验设计确定了最佳制备工艺。优化后,mPEG修饰的脂质体平均粒径减小到约200 nm,包封率提高至25%。此结果与之前报道的,使用REV方法得到奥沙利铂脂质体的结果基本一致。报道同时指出,使用磷脂,可提高脂质体稳定性。Abu-Lila等[16]使用半合成脂质体(HSPC)制备了奥沙利铂脂质体,粒径为200 nm,包封率为20%,他们使用的半合成脂质体比天然脂质体更稳定。此外,可以通过不同的方法除去游离的奥沙利铂,如:5%葡萄糖透析法[16],超速离心或超滤法[14]等。本文中,使用超滤法分离游离药物,药物加入到空白脂质体后,在超滤液可以回收99.17%的游离药物。TOA(表1)结果显示,药物与脂质的比例是影响包封率(K1平均值)的最重要因素。如图1所示,增加药物与脂质的比例可以增加包封率。这可能是由于药物浓度在水相中增加,意味着药物分子被载入脂质体的几率增大,从而达到更高的包封率。然而,增加不成比例的药量,当该比率升高到1∶10,包封率略有下降(数据未显示)。胆固醇的作用同样重要,胆固醇量的增加,包封率也会随之增加。加入胆固醇可以增加脂质体双分子层的刚性,因此,可以减少药物的泄漏[17]。超声时间也可以影响包封率。据报道,超声时间过长可诱导药物从脂质体中泄漏[18]。本研究中,5 min的超声时间即可达到最高包封率。但即使延长超声时间,若胆固醇的量控制得当,同样可以减少药物渗漏。此外,奥沙利铂从PEG修饰的脂质体中释放速度慢于从未修饰脂质体中的释放。这一现象可能是由于PC的低相转变温度(约20℃)导致了脂质体膜的高流动性,从而诱发奥沙利铂从未修饰脂质体中的快速释放。DSPE-PEG2000修饰的脂质体膜可使药物在生理条件下具有更好的稳定性和体内释放行为。此外,PEG2000修饰的脂质体具有更小的粒径,可以降低脂质体粒子间的聚集。TEM表征结果表明,脂质体具有完整的球形形态,可以较好的包载药物与脂质体内部。
5 结论
在本研究中,采用逆向蒸发法制得了未修饰的长循环奥沙利铂脂质体。采用Taguchi正交设计法深入研究了影响奥沙利铂脂质体包封率的多种因素,并确定了最优处方工艺。优化工艺制备的经mPEG2000修饰的奥沙利铂脂质体在生理条件下更加稳定,与未修饰脂质体相比,具有更好的稳定性且具有缓释特性。因此,经过优化的PEG修饰的长循环奥沙利铂脂质体,是一种较好的抗肿瘤药物递送系统。
[1]Des Guetz G,Lecaille C,Mariani P,et al.Prognostic impact of microsatellite instability in colorectal cancer patients treated with adjuvant FOLFOX[J].Anticancer Res,2010,30(10):4297-4301.
[2]Tampellini M.Pharmacoeconomic aspects of FOLFIRI or FOLFOX regimens administered with a fully ambulatory pump compared to the day hospital setting[J].Tumori,2010,96(3):438-442.
[3]Tashir T,Kawada Y,SakuraI Y,et al.Antitumor activity of a new platinum complex,oxalato(trans-l-1,2-diaminocyclohexane)platinum(II):new experimental data[J].Biomed Pharmacother,1989,43(4):251-260.
[4]Pendyala L,Creaven PJ.In vitro cytotoxicity,protein binding,red blood cell partitioning,and biotransformation of oxaliplatin[J].Cancer Res,1993,53(24):5970-5976.
[5]Extra JM,Espie M,Calvo F,et al.Phase I study of oxaliplatin in patients with advanced cancer[J].Cancer Chemother Pharmacol,1990,25(4):299-303.
[6]Hussain S,Pluckthun A,Allen TM,et al.Antitumor activity of an epithelial cell adhesion molecule targeted nanovesicular drug delivery system[J].Mol Cancer Ther,2007,6(11):3019-3027.
[7]Allen TM,Hansen C,Martin F,et al.Liposomes containing synthetic lipid derivatives of poly(ethylene glycol)show prolonged circulation half-lives in vivo[J].Biochim Biophys Acta,1991,1066(1):29-36.
[8]Ishida O,Maruyama K,Sasaki K,et al.Size-dependent extravasation and interstitial localization of polyethyleneglycol liposomes in solid tumor-bearing mice[J].Int J Pharm,1999,190(1):49-56.
[9]Szoka F Jr,Papahadjopoulos D.Procedure for preparation of liposomes with large internal aqueous space and high capture by reverse-phase evaporation[J].Proc Natl Acad Sci USA,1978,75(9):4194-4198.
[10]Ishii F,Nagasaka Y.Simple and convenientmethod for estimation marker entrapped in liposomes[J].JDispersion Sci Technol,2001,22(1):97-101.
[11]Ghambarian M,Yamini Y,Saleh A,et al.Taguchi OA16 orthogonal array design for the optimization of cloud point extraction for selenium determination in environmental and biological samples by tungsten-modified tube electrothermal atomic absorption spectrometry[J].Talanta,2009,78(3):970-976.
[12]Abu Lila AS,Doi Y,Nakamura K,etal.Sequential administration with oxaliplatin-containing PEG-coated cationic liposomes promotes a significant delivery of subsequent dose into murine solid tumor[J].J Control Release,2010,142(2):167-173
[13]van Zutphen S,Reedijk J.Targeting platinum antitumour drugs:Overview of strategies employed to reduce systemic toxicity[J].Coord Chem Rev,2005,249(24):2845-2853.
[14]Zalba S,Navarro I,Trocóniz IF,et al.Application of differentmethods to formulate PEG-liposomes of oxaliplatin:evaluation in vitro and in vivo[J].Eur JPharm Biopharm,2012,81(2):273-280.
[15]Kulkarni SB,Betageri GV,Singh M.Factors affectingmicroencapsulation of drugs in liposomes[J].JMicroencapsul,1995,12(3):229-246.
[16]Abu-Lila AS,Suzuki T,Doi Y,et al.Oxaliplatin targeting to angiogenic vessels by PEGylated cationic liposomes suppresses the angiogenesis in a dorsal air sac mouse model[J].JControl Release,2009,134(1):18-25.
[17]Castaing M,Loiseau A,Djoudi L.Effects of cholesterol on dye leakage induced by multidrug-resistancemodulators from anionic liposomes[J].Eur J Pharm Sci,2003,18(1):81-88.
[18]Taha EI,El-AnaziMH,El-Bagory IM,et al.Design of liposomal colloidal systems for ocular delivery of ciprofloxacin[OL/J].Saudi Pharm J,2013.http://dx.doi.org/10.1016/j.jsps.2013.07.003.
Optim ization of oxalip latin long circulated liposom es by Taguchi orthogonal design
Cheraga Nihad,SHEN Yan,TU Jia-sheng
(State Key Laboratory of Natural Medicines,Department of Pharmaceutics,China Pharmaceutical University,Nanjing 210009,China)
ObjectiveTo optimize the preparation parameters of oxaliplatin long circulated liposomes for enhancing maximum entrapment efficiency(EE%)exerting sustained-release property.MethodsTaguchiorthogonal arrays L9(34)(TOA)was applied in this investigation with encapsulation efficiency as an evaluation index.The entrapmentefficiency was calculated using Ultra-filtration techniques.The particle size,zeta potential and in vitro release behavior of L-OHP liposomeswere characterized.ResultsThe drug to lipids ratio(W/W),the cholesterol to phosphatidylcholine ratio(M/M)and the sonication time were found to be the most influencing factors(P<0.05).Moreover,the optimized L-OHPmPEG-modified liposome showed better physicochemical characteristics compared to the optimized L-OHP bare liposomeswith a smaller particle size of204 nm and higher entrapment efficiency up to 25.4%.TEM visualization revealed spherical structure with a large internal space and a white coated film surrounding themPEG-modified liposomes.The in vitro release of L-OHP from mPEG-modified liposome was found to be slower than that of bare liposomes and L-OHP solution,respectively.The release profile of both liposomes and solution were well described by first ordermodelwith a coefficient correlation of0.990 2.ConclusionThe optimized L-OHP long circulated liposomes using TOA designmay be a promising carrier for L-OHP delivery into tumors compared to the conventional bare liposome.
Taguchiorthogonal array;mPEG-modified liposome;Bare liposome;Oxaliplatin;Drug delivery system
R979.1
A
2095-5375(2014)04-0187-006
国家自然科学基金(No.81201182);中央高校基本科研业务费专项基金(No.JKPZ2013006)
Cheraga Nihad,女,研究方向:药物新剂型与新技术,E-mail:missritchi@hotmail.com
涂家生,男,教授,研究方向:药物新剂型与新技术,Tel:025-83271305,E-mail:jiashengtu@cpu.edu.cn
