皂基皮肤清洁剂的泡沫形态及其对皮肤渗透性的影响
2014-03-07王海燕编译
王海燕 编译
(中国安全生产科学研究院,北京 100012)
皂基皮肤清洁剂的泡沫形态及其对皮肤渗透性的影响
王海燕 编译
(中国安全生产科学研究院,北京 100012)

现今,对皮肤刺激小的清洁剂备受关注。本文利用液相色谱/质谱技术,从表面活性剂渗透的角度,研究泡沫特征与皮肤刺激性之间的关系。结果显示,随着泡沫析出液中表面活性剂浓度的降低,析出液中长链表面活性剂的含量降低,而此时泡沫的体积在逐渐变小。当皮肤上与泡沫接触时,泡沫的排水量决定了表面活性剂渗入皮肤的量,表面活性剂渗入到皮肤的量随泡沫体积的增大而增加。这是由于气/液界面的表面活性剂不能自由移动,因而泡沫析水液中的表面活性剂易于渗入皮肤。结果说明,在设计皮肤清洁剂配方时,表面活性剂种类、泡沫形态以及产生泡沫的方式都是应该考虑到的重要因素。
表面活性剂;皮肤清洁剂;泡沫;皮肤渗透;脂肪酸;液相/质谱
1. 前言
角质层是皮肤的最外层,它为皮肤提供最大程度的屏障作用。皮肤清洁剂的清洁机理是利用表面活性剂来去除皮肤表面的油污、汗渍和皮脂等。许多文献报道了表面活性剂对于皮肤的刺激作用,尤其是阴离子表面活性剂在与皮肤接触时,会使皮肤颜色变红,经表皮的失水量增加。表面活性剂的存在还会使得角质层溶胀,除去角质层中的保湿物质(如氨基酸),改变和除去脂肪细胞间的填充物,使蛋白质变性。因此,为了保护皮肤的屏障作用,有必要深入了解表面活性剂是如何渗入皮肤的。
为此,许多文献研究了表面活性剂的皮肤渗入量。之前,人们曾经普遍认为,只有表面活性剂单体可以渗入皮肤,故而由表面活性剂引起的皮肤刺激一般与其临界胶束浓度(cmc)存在关联性。通常认为,胶束的体积较大,不能渗入皮肤,因此皮肤清洗剂通常设计为阴离子表面活性剂与其他表面活性剂的混合物,以降低cmc和减少对皮肤的渗入。
然而,最近这一假设已经发生了变化。因为对于十二烷基硫酸钠(SDS)而言,即使在浓度高于cmc时,其皮肤刺激性仍会随着浓度的增加而持续增加。当十二烷基硫酸钠与醇醚类非离子表面活性剂进行配伍时,氧乙烯单元与SDS胶束发生键合,可以防止十二烷基硫酸钠渗入皮肤。另外,有文献报道,椰油基羟乙基磺酸钠(SCI)胶束比皮肤中进水孔的体积大,使得SCI胶束无法穿透皮肤。因此,表面活性剂在水溶液中的状态(单分子、胶束或其他结构)可能会影响其对皮肤的渗透力。虽然绝大多数皮肤清洁剂是以泡沫形式作用于皮肤的,但在测定表面活性剂的皮肤渗入量时,却是在溶液状态下进行的。这就意味着,当前的皮肤清洗模型是不完善的,测量值不能客观反映真实的状态。
泡沫是一个非常复杂的系统,它会随着时间的推移而逐渐破裂。因此,从重复测量的角度来看,评价泡沫较为困难。相反,由于薄液膜(如气泡)容易再现,因而常被作为研究对象。例如,通过高速相机可以清楚地观察到泡沫的破灭。另一方面,迄今关于泡沫的研究主要是从物理的角度(如流变学)进行,许多现象可以通过物理学理论来加以解释,但这些泡沫高度依赖于所添加剂的化学品,如表面活性剂。此外,泡沫稳定性和动态表面张力间的关系已得到广泛研究和探讨。众所周知,三个气泡进入相互接触的点为plateau边界,该处的压力比泡沫的其他部分要低,因此泡沫中的水容易流入plateau边界。这种析水现象导致膜变得更薄、气泡更容易破裂。
在之前的相关研究中已经发现:表面活性剂在水溶液中的状态(单分子、胶束或其他结构),可能会影响其对皮肤的渗透力;绝大多数皮肤清洁剂均以泡沫形式作用于皮肤,而测定表面活性剂的皮肤渗入量却是在溶液状态下进行的。为进一步弄清表面活性剂的渗入对皮肤产生的刺激作用,本文通过液相色谱/质谱技术,对表面活性剂的渗入机理以及泡沫特性与皮肤间的联系进行了分析和测定。
迄今为止,人们对于泡沫中表面活性剂对皮肤产生刺激性的机理尚不清楚。表面活性剂在泡沫中的状态不同于其在水溶液中的状态,而泡沫中的表面活性剂对皮肤的影响也不同于水溶液中的表面活性剂。为此,揭示泡沫在皮肤上的作用机理,了解泡沫形态以及泡沫产生的方式,将有助于改进温和型皮肤清洁剂的配方设计。
本文从泡沫中的气泡大小、表面活性剂皮肤渗透量以及渗入皮肤的表面活性剂组成、泡沫析水量三方面进行综合研究。
2. 试验部分
2.1 原料
不同烷链的脂肪酸混合物(月桂酸、肉豆蔻酸、棕榈酸和硬脂酸),经氢氧化钾在70~80℃下中和,每种脂肪酸的质量分数为0.5%。
为定量分析渗入到皮肤中的表面活性剂,脂肪酸部分氘取代来说明那种脂肪酸形成泡沫(因为在人体皮肤中有大量的脂肪酸,因此它们不能被完全除去)。2,2-氘代月桂酸、2,2-氘代肉豆蔻酸、2,2-氘代棕榈酸和2,2-氘代硬脂酸的混合物各为0.5%(重量)的水溶液,将上述脂肪酸均用氢氧化钾在70~80℃下中和。
样品水溶液在室温下平衡一周时间,pH为10.6。样品刚制备好时为澄清状态,然后逐渐浑浊。
表面张力法测定样品的cmc为0.2wt%(7.1×10-3M),即样品所使用的浓度在其cmc之上。
为了制备具有三个气泡大小的泡沫,在500mL烧杯中加入10g样品并搅拌(7000转,叶片大小为1×2cm),搅拌不同时间(5s、15s、120s)后分别得到三种不同的泡沫(即泡沫C、泡沫B、泡沫A)。对于泡沫A和泡沫B,其整个溶液几乎都变成了泡沫(泡沫A体积为140cm3,泡沫B体积为60cm3);而泡沫C的溶液还没有完全变成泡沫,故将泡沫部分从水溶液中分离出来,测得其体积为35cm3。
2.2 泡沫中气泡大小的测量
泡沫制备好后,直接在烧杯中用数码显微镜观察。配有VH-Z20变焦镜头(2009)的数字显微镜(VHX-1000,日本Keyence公司)可用于获得300张随机选择的泡沫照片。拍照后,用数字显微镜软件手动测量气泡的直径,由体积重量加权平均值进行计算。
2.3 排水量的采集
泡沫制备好后,将气泡放在筛孔大小为355μm的滤网上。1min后,用棉花收集网格的液滴,其中的脂肪酸已由体积比为1∶1的氯仿/甲醇除去,样品保持在一个用氯仿/甲醇清洗过的玻璃容器中。收集完成后,每个样品称重。
2.4 泡沫处理皮肤
招募5个年龄为20~49岁的健康的志愿者。先用乙醇擦拭志愿者前臂,再将1.0g泡沫放置在其中的4cm×4cm区域,1min后,用200mL的离子交换水冲洗泡沫,然后用毛巾擦干,在上述部位进行胶带(PPS胶带,规格为2.5cm× 1.8cm)剥离实验:以65g/cm2的压力将胶带在皮肤上持续按压20s,然后撕下;如此操作在同一点上进行3次。以此方法通过胶带收集渗入皮肤上的脂肪酸。另外,用同样方法在乙醇擦拭的未处理过的前臂进行空白试验。

图1 不同搅拌时间得到的泡沫的数字显微镜图片(标尺为200 μm)
2.5 脂肪酸的定量分析
在氮气流下将排水样品干燥,残留物溶解于50mL甲醇中,超声波振动20min提取脂肪酸。取0.1mL溶液用甲醇稀释至10mL;将从皮肤上撕下的胶带剪成两半,放入已用氯仿/甲醇(体积比为1∶1)除去脂肪的玻璃容器中;加入5mL甲醇,超声波振动提取10min,然后将溶液浓缩至1/10。
脂肪酸的含量用液相色谱/质谱(LC/MS)仪分析。该系统中,二元泵连接两个流动相(A1,V (甲醇)∶V(水)=9∶1,其中乙酸铵和乙酸分别为100mM和50mM;B1,异丙醇,其中乙酸铵和乙酸分别为100mM和50mM),流动相洗脱速率0.2mL/min。流动相程序如下:0~20min,A1为100%,20.1~25min,B1为100%。注射体积10μL;ODS柱,2.1mm×150mm;温度为40℃。
电喷雾质谱条件如下:离子检测(SIM);极性检出模式为负模式;干燥气(N2)流速8.0L/min;雾化器压力30psi;干燥气温度250℃;毛细管电压3000V;碰撞电压200V。
月桂酸、肉豆蔻酸、棕榈酸和硬脂酸失去质子后的质核比m/Z分别为199.0、227.0、255.0和283.0,而2,2-氘代月桂酸、2,2-氘代肉豆蔻酸、2,2-氘代棕榈酸和2,2-氘代硬脂酸失去质子后的质核比m/Z分别为201.0、229.0、257.0和285.0。
2.6 蛋白质的定量分析
胶带上剥离下来的蛋白质含量测定方法如下:将前面剩余的另一半胶带放在玻璃容器中,加入0.45mL含0.1mol/L NaOH和1%SDS的水溶液。60℃保温150min后冷却至室温。然后加入200μL,2mol/L的盐酸水溶液,搅拌。溶液中的总蛋白含量采用BCA蛋白分析法进行测量。
3. 实验结果
3.1 泡沫析水中脂肪酸的定量分析
图1为不同搅拌时间得到的3种泡沫的显微镜图片。泡沫A、泡沫B和泡沫C的平均直径分别为120μm、295μm和753μm。
图2为每克泡沫的析水体积。从图中看出,析水量随泡沫直径的增大而增加,析水速率明显受泡沫大小控制。
泡沫析出液中脂肪酸含量的定量分析结果如图3所示。脂肪酸的总浓度随泡沫体积的增大而增加:泡沫A最小,故其析出液中的脂肪酸含量也明显低于其他两个。泡沫A、泡沫B和泡沫C的析出液中,脂肪酸组成有所不同:泡沫A的析出液中,长链脂肪酸(肉豆蔻酸、棕榈酸和硬脂酸)的浓度明显低于另外两个泡沫。这意味着,长链脂肪酸在泡沫A中容易被析出。泡沫B和泡沫C中脂肪酸的组成完全等同于制备泡沫时的样品溶液。

图2 泡沫气泡大小对析水体积的影响
3.2 渗入皮肤的脂肪酸的定量分析
图4显示的是渗入皮肤中的脂肪酸含量(空白样品的渗入量未检测)。从图中看出,脂肪酸的渗入量随泡沫的增大而增加。使用泡沫A时,渗入到皮肤中的表面活性剂最少。尽管长链脂肪酸容易渗入到皮肤中,但是相比于泡沫B和C,泡沫A中的长链脂肪酸不易渗入皮肤中。
4. 讨论与分析
4.1 泡沫析水体积
从图2中可以看出,析水体积随气泡体积的减小而减少。这是由于,气/液界面的面积随着气泡的减小而增大,因而在界面膜内可以储存更多的水。此外,泡沫析水是由plateau边界与不同泡沫接触点之间存在压力差而引起的。因此,析水率将随着气泡体积的增大而增加。
吸附在气/液界面的表面活性剂的堆积随溶液pH而改变,所以起泡能力(泡沫稳定性,体积和泡沫大小)也受之影响。通常而言,以脂肪酸盐为基础的个人护理产品的pH为8~11,本实验中的样品pH为10.6。因此,该研究适宜用来模拟个人护理产品。
4.2 析水液中脂肪酸的含量
从图3a可以看出,泡沫A析出液中脂肪酸的总浓度明显低于其他两个泡沫。泡沫A中气/液界面的表面积大,因此有大量的脂肪酸吸附在气/液界面上。这将导致析水液中脂肪酸的浓度降低,远低于初始样品中的含量。
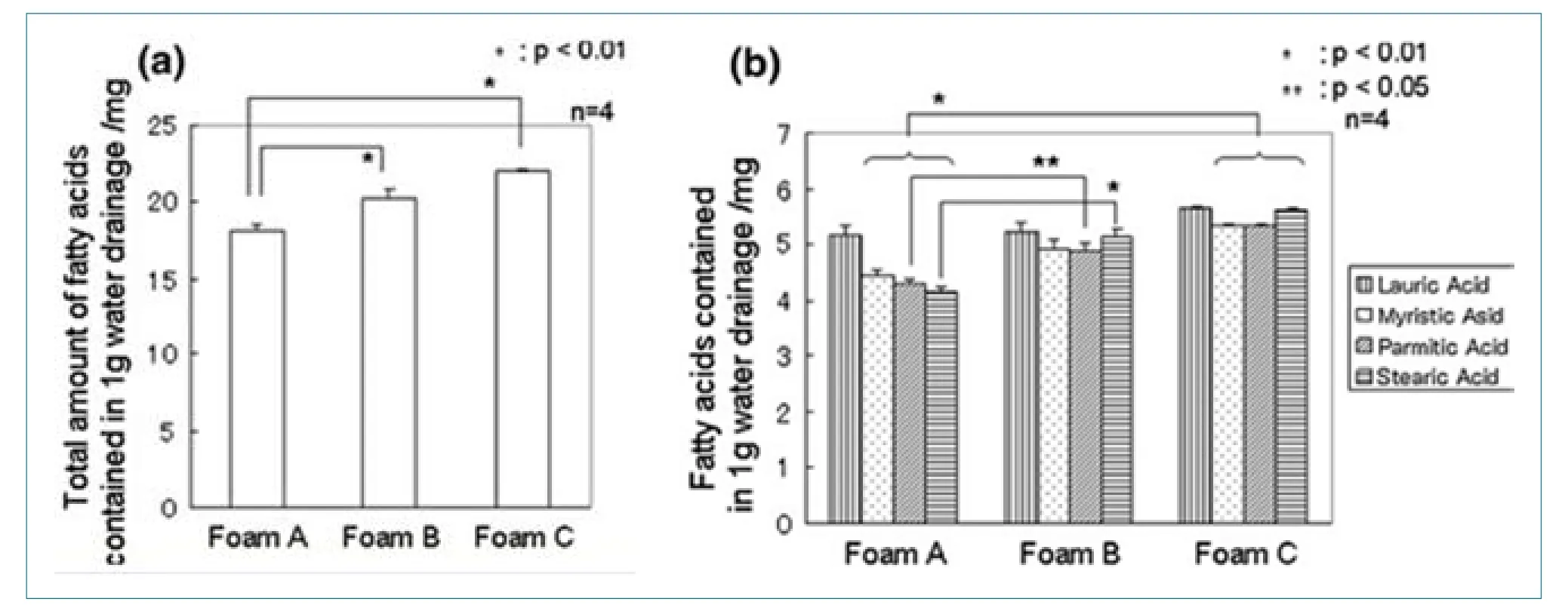
图3 a. LC/MS分析泡沫析出液中脂肪酸总含量 b. LC/MS分析泡沫析出液中脂肪酸组成含量

图4 a. LC/MS分析渗入到皮肤中的总脂肪酸含量 b. LC/MS分析渗入到皮肤中的脂肪酸组成
从图3b可以看出,泡沫A析出液中脂肪酸的组成不同于其他两个泡沫。通常长链表面活性剂易于在气/液界面吸附。泡沫A中,气/液界面的表面积大,因此长链脂肪酸(如肉豆蔻酸、棕榈酸和硬脂酸)倾向于在界面上吸附,而在析出液中的含量减少,这就导致了泡沫A和其他泡沫析水液中组成的差异。
4.3 渗入到皮肤中的脂肪酸含量
从图4b看出,在所有类型的泡沫中,长链脂肪酸更易渗入到皮肤中,这可能是由疏水链对皮肤这种疏水基质的强烈亲和力造成的。从图4a可以看出,泡沫A中渗入到皮肤中的脂肪酸皂的总浓度明显小于其他泡沫。这意味着渗入到皮肤中的脂肪酸含量少。
泡沫的哪个部分对皮肤渗入影响最大呢?当泡沫应用于皮肤时,只有气液界面和析出液与皮肤接触。
吸附在气液界面的表面活性剂不能自由行动,因此泡沫析出液中的表面活性剂更容易渗入皮肤中。从图2可以看出,随着气泡的减小,泡沫析水量呈线性减少。当气泡体积变小时,气液界面的表面积增加,泡沫析出水中的表面活性剂主要影响皮肤渗透量。泡沫A中,析水量明显低于其他两个泡沫。此外,析出水中表面活性剂浓度明显偏低。该现象与假设相吻合。泡沫A中的长链脂肪酸(肉豆蔻酸、棕榈酸和硬脂酸)渗入皮肤中的数量少于其他泡沫,这可能应归因于析出液中表面活性剂的浓度。
泡沫中的表面活性剂存在于气/液界面和界面之间的液相中,表面活性剂自发吸附在气/液界面上。因此,如果泡沫没有破裂,则多数表面活性剂被用于保持泡沫结构,不会渗入皮肤。这种作用会导致表面活性剂渗入皮肤的量减少。对于细腻的泡沫(如泡沫A),可以很清晰地观察到这种趋势(如图5所示)。已有一些研究从表面活性剂的渗透机理入手,调整个人护理配方结构,以降低其对皮肤的刺激性。为降低渗透量,需要控制较大聚集体的形成(如由表面活性剂形成的胶束),在该状态下表面活性剂不能像单体一样自由活动。换言之,表面活性剂以一个类似泡沫和胶束的状态存在。表面活性剂在气/液界面的吸附也同样降低其向皮肤的渗透量。同所使用的表面活性剂一样,泡沫产生的方法也影响渗透作用。因此,理解泡沫的形态学对表面活性剂渗透的影响,有助于改善温和型清洗剂和皮肤清洁剂的配方设计。
5. 结论

图5 泡沫开始接触皮肤时的示意图
通过LC/MS阐明了泡沫中气泡体积大小、泡沫析出液中表面活性剂含量和表面活性剂皮肤渗入量之间的关系。泡沫析水液的体积和浓度与泡沫中气泡体积大小有关。如果气/液相表面积大,就可以储存更多的水。因此,泡沫越细腻,泡沫析水量越小。长链表面活性剂易于在气/液界面吸附,细腻泡沫析出液中的脂肪酸浓度低于气泡体积大的粗糙泡沫。脂肪酸渗入到皮肤中的组成和在泡沫析出液中的组成相似。对于泡沫细腻的A,渗入皮肤以及泡沫析出液中的长链脂肪酸含量均较低。由于泡沫体积和泡沫析出液中浓度类似,脂肪酸组成类似,所以皮肤用泡沫处理时,皮肤主要受析出液中表面活性剂的影响。因此,表面活性剂渗入皮肤的量随气泡体积的增大而增大,这是由析出液中表面活性剂的含量所导致的。这一独特的发现是源于对皮肤渗透的新的评价方法。本结果将为开发更加温和、有效的清洗剂配方和皮肤清洁剂配方提供参考。
