MRI诊断腕舟骨骨折及评价骨折后骨质活性的应用
2014-03-07王淑丽马信龙
王淑丽马信龙
MRI诊断腕舟骨骨折及评价骨折后骨质活性的应用
王淑丽1马信龙2
腕骨;骨折;磁共振成像
腕舟骨骨折是最常见的腕骨骨折,目前认为MRI是诊断隐匿性腕舟骨骨折的“金标准”[1]。常规MRI及对比增强MRI可以用于检测腕舟骨骨折后舟骨近极骨质活性状况,以及预测术后舟骨愈合,为临床制订有效的治疗方案提供依据。本文对其研究进展作一综述。
1 隐匿性腕舟骨骨折的诊断及MRI应用价值
腕舟骨骨折占腕骨骨折的60%以上,早期诊断和有效治疗可以避免出现延迟愈合、骨折不愈合、缺血性坏死,以及继发的骨性关节炎、腕不稳、腕管综合征等并发症[2]。目前X线仍是其首选的检查方法,标准X线正侧位像主要用于显示腕关节的排列情况,然而,各腕骨影像重叠极易漏诊无移位的腕舟骨骨折,所以要增加腕斜位和腕尺偏位的投照[3,4],以提高腕舟骨骨折的检出率(图1)。Welling等[5]以多层螺旋CT检查为对照,发现常规X线可以遗漏30%的腕骨骨折。多层螺旋CT可以立体、直观、多角度地显示腕舟骨骨折移位情况,以及舟骨与其相邻结构的解剖关系,监测陈旧性腕舟骨骨折的愈合情况和内固定术后的愈合情况[6,7]。MRI诊断腕舟骨骨折是否累及骨皮质的敏感度只有38%,不及多层螺旋CT的100%;但MRI诊断腕舟骨骨小梁微骨折的敏感度(100%)高于多层螺旋CT(89%)[7]。
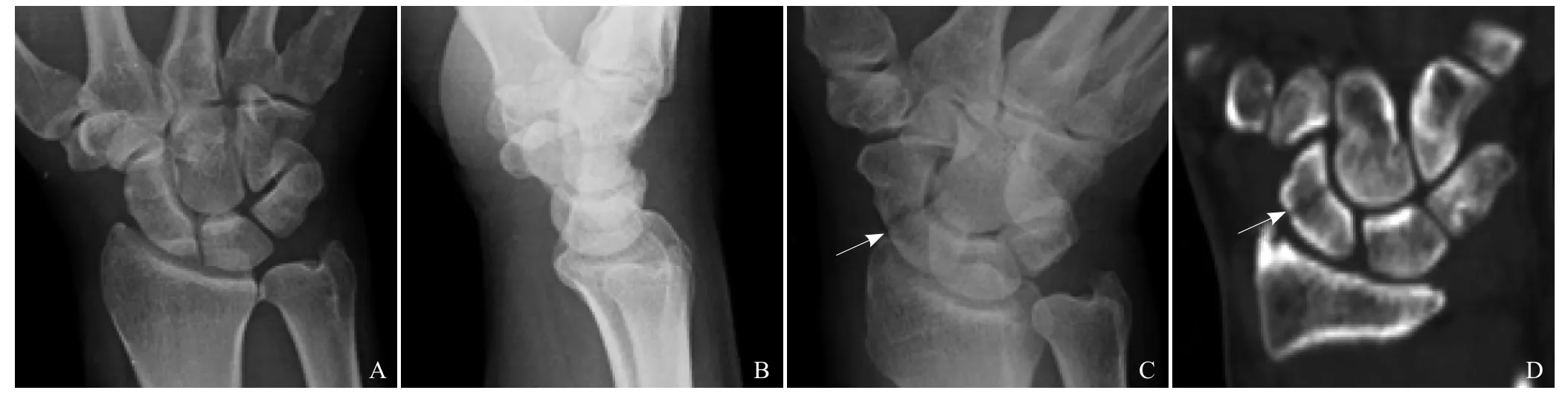
图1 男,55岁,右腕。A、B.腕关节正、侧位未见异常;C.腕关节尺偏位示舟骨腰部线样低密度影(箭);D.多层螺旋CT冠状位重组图像示腕舟骨腰骨骨折(箭)
国内关于MRI在腕舟骨骨折诊断中的应用报道较少见,国外则见大量报道[8-10]。隐匿性腕舟骨骨折在MRI T1WI、T2WI中骨折线或骨髓呈低至中等强度异常信号,与周边正常骨髓的相对高信号反差明显;在短时间反转恢复(STIR)序列上出现异常高信号与周围正常骨髓的低信号形成对比,其中T1WI的诊断价值最高。Breitenseher等[9]对42例X线检查均为阴性的腕部外伤患者行MRI检查,分别采用T1WI、T2WI和STIR序列发现,14例(33%)舟骨骨折,4例头状骨骨折,1例大多角骨骨折,2例桡骨远端骨折,6周后复查全部得到证实。Brydie等[10]分析了X线检查阴性的195例腕部损伤患者的MRI资料,发现37例(19%)舟骨骨折,28例(14%)桡骨远端骨折,9例(5%)其他腕骨骨折,其中180例(92%)依据MRI的检查结果改变了原治疗方案,因此MRI是诊断隐匿性腕舟骨骨折的“金标准”(图2)。MRI作为确诊可疑腕舟骨骨折的首选影像学诊断方法[11],可以避免既往因可疑腕舟骨骨折行外固定所带来的生活不适和经济负担,甚至有学者提出应去除“临床舟骨骨折”这一概念,以避免临床过度治疗[1]。但MRI诊断可疑腕舟骨骨折的观察者间的一致性中等,有影像学诊断经验的医师诊断效果更佳[12]。
2 MRI评价腕舟骨骨折舟骨近极活性的应用
不稳定型腕舟骨骨折的并发症发生率高达55%[13],包括延迟愈合、骨折不愈合、缺血性坏死及骨性关节炎等,常规的治疗方法是手术。治疗方案根据舟骨近极骨质活性状况,当腕舟骨骨折后出现骨坏死或可疑舟骨缺血性改变时,应选用桡骨远端带血管蒂的骨移植,并用螺钉内固定;当骨折后舟骨近极仍存在良好血供时,可以行不带血管蒂的骨移植或螺钉内固定,手术创伤小且时间短[13,14]。目前确定舟骨断端是否缺血即舟骨骨质活性状况的影像学诊断技术主要是常规MRI、静态和动态对比增强MRI及骨核素扫描,MRI作为无创的检查技术已被临床广泛认同,并同时用于预测术后舟骨愈合情况。

图2 女,63岁,左腕。A~C.腕关节正、侧位及尺偏位未见明显异常;D. T1WI示左腕舟骨骨髓稍低信号及线样低信号(箭);E. STIR序列示舟骨远端骨髓水肿样信号,左腕舟骨隐匿性骨折(箭)
2.1 常规MRI 组织学上腕舟骨骨质缺血性改变于标本的不同位置有不同的形态,中心区域的坏死程度大于舟骨掌侧及背侧区域,缺血骨的有活性区域和无活性区域呈不规则分布,因此随机活检不能预测整个标本的组织学状态[15]。Cerezal等[16]根据常规MRI的信号特征将30例陈旧性舟骨骨折不愈合的病例分为4组,即骨质正常或轻微缺血组,表现为T1WI上舟骨近极等信号强度或正常腕骨信号;中度缺血组,表现为T1WI上舟骨近极稍低信号,T2脂肪抑制序列上增高信号;重度缺血组,表现为T1WI上舟骨近极低信号,T2脂肪抑制序列上不均匀信号;坏死或缺血性坏死组,表现为T1WI上舟骨近极低信号,T2脂肪抑制序列上一致性信号减低;常规MRI诊断术中血运情况,即术中显示骨折断端无出血点为缺血,有出血点为舟骨近端血供、骨质有活性的敏感度、特异度和准确度分别为36%、78%和68%。Fox等[17]回顾性分析29例陈旧性腕舟骨骨折不愈合行手术治疗患者的术前MRI资料,发现T1WI诊断的敏感度、特异度、准确度分别为55%、94%、79%;STIR序列对确定舟骨近极骨活性无意义,因为舟骨近极坏死病例(7/11)和舟骨近极无坏死病例(10/18)在STIR上均显示为弥漫增高信号。
常规MRI评价舟骨活性情况的敏感度较低,考虑为坏死细胞与有活性细胞紧密相连,而MRI的容积效应会出现正常细胞和坏死细胞混杂在一起,致影像评价困难,不能单纯依据T1WI上的低信号就认定舟骨坏死,该表现仅仅表示一种缺血状态,可能存在正常骨细胞,组织学检查亦证明T1WI低信号区大于实际骨坏死区[15]。
2.2 对比增强MRI
2.2.1 常规对比增强MRI 常规对比增强MRI又称静态对比增强MRI。静脉注射药物后,可以根据骨折断端的信号强度变化情况评价急性和陈旧性腕舟骨骨折的骨质活性状况。典型表现为T1加权脂肪抑制序列中富血运区域出现强化,而坏死区域因缺乏血液灌注无强化。Cerezal等[16]将30例陈旧性腕舟骨骨折不愈合的病例按照T1加权脂肪抑制序列中舟骨近极强化范围占整个舟骨近极的百分比分为4组:正常或轻度缺血组,均匀的强化范围超过舟骨近极面积的80%;中度缺血组,斑片状强化区域占舟骨近极端的50%~80%;严重缺血组,斑片状强化区域占舟骨近极端的20%~50%;骨质坏死组,舟骨近极无强化或强化区域不及舟骨近极20%;结果发现常规对比增强MRI的诊断敏感度、特异度和准确度分别为66%、88%和83%。Schmitt等[19]的研究支持该观点,认为常规对比增强MRI评价舟骨近极活性能力(判定舟骨近极缺血的敏感度、特异度、准确度分别为76.5%、98.6%、94.3%)优于常规非增强MRI(敏感度、特异度、准确度分别为6.3%、100.0%、82.9%)。Megerle等[20]报道的常规对比增强MRI评价骨质活性的敏感度、特异度和准确度分别为71.4%、90.5%和87.8%,同时发现对比增强MRI结果与术后愈合率无显著相关性,即术后的坚强内固定至关重要。即使舟骨近极骨坏死,在常规对比增强MRI中仍可以出见强化现象,可能是因为坏死区内存在有活性的纤维间质组织或常规对比增强检查时进行图像采集是在注射对比剂4~9 min后,此时通过邻近软组织血流灌注弥散至骨[16]。
2.2.2 动态对比增强MRI 动态对比增强MRI根据时间-信号强度曲线类型评价舟骨近端及近极的血流灌注,主要评价指标包括最大强化曲线斜率(SSV)和强化率(%E),该检查技术的关键是兴趣区的选定[18]。Dawson等[18]采用动态对比增强MRI分析32例伤后1~2周的急性无移位性腕舟骨骨折患者(发生于舟骨腰部29例,近端2例,远端1例)的舟骨近极骨质活性,发现所有腕舟骨骨折的舟骨近端及近极的SSV和%E值均明显低于舟骨远侧断端,差异有统计学意义;保守治疗12周后4例不愈合,愈合组和不愈合组的近端SSV和%E值组间差异无统计学意义,而2组近极的SSV和%E值差异有统计学意义,不愈合组的%E值高于愈合组;且6例舟骨近极无强化,即无血运的病例均骨性愈合,因此认为动态对比增强MRI评价无移位型腕舟骨骨折后近极骨质活性无意义。Donati等[21]研究显示动态对比增强MRI评价舟骨活性的诊断效能低于常规对比增强MRI,认为若同时考虑检查时间、检查费用及对比剂应用的技术要求等,动态对比增强MRI不适用于评价腕舟骨骨折后舟骨近极骨质活性。
3 常规对比增强MRI预测腕舟骨骨折术后愈合能力的应用
动态对比增强MRI不能有效地预示腕舟骨骨折后的愈合潜力[17,18],但学者对常规对比增强MRI对腕舟骨骨折术后愈合能力的预测价值观点并不一致。Cerezal等[16]对30例陈旧性舟骨骨折不愈合的病例按照T1加权脂肪抑制序列强化范围占舟骨近极的百分比分为4组,即正常或轻度缺血组、中度缺血组、严重缺血组和骨质坏死组,手术后舟骨愈合率分别为100%、89%、75%和0,表明常规对比增强MRI对骨折术后愈合率有良好的预测能力。而Singh等[22]发现12例对比强化超过50%的病例中4例未愈合,而4例对比强化小于50%的病例中3例愈合,认为常规对比增强MRI结果与术后愈合率不相关。Megerle等[20]认为骨折后舟骨远端血管的爬行替代致舟骨近端尚存部分血供,而影响腕舟骨骨折愈合的原因还包括骨折断端间是否有软组织充填。Ciprian等[23]根据常规对比增强MRI诊断结果将舟骨近极无活性病例采用不同手术方式治疗,发现带血管蒂移植固定治疗可将术后愈合率从50%提高到80%。若舟骨术后出现愈合延迟则可能会导致影像学评价失误[14]。术中探查发现舟骨外形完整,周围粘连严重,只需行关节松解术,术后6周骨性愈合,纤维粘连使桡骨和腕舟骨骨折的近极间活动度减低,而部分愈合的腕舟骨骨折位置出现轻微活动致愈合延迟。
总之,由于腕骨排列的特征常遗漏腕舟骨微细骨折,MRI已成为诊断隐匿性腕舟骨骨折的首选检查技术。腕舟骨骨折后应用常规对比增强MRI评价舟骨近极骨质活性、预测骨折愈合潜力,为临床治疗方案的制订提供了依据,可以最大限度地减少并发症的发生,提高患者的生活质量。虽然常规MRI判定舟骨近极骨质活性的敏感度低于对比增强MRI,但其具有较高的诊断特异性,可以作为对比增强MR检查的补充技术。
[1] Shetty S, Sidharthan S, Jacob J, et al. 'Clinical scaphoid fracture': is it time to abolish this phrase? Ann R Coll Surg Engl, 2011, 93(2): 146-148.
[2] Tysver T, Jawa A. Fractures in brief: scaphoid fractures. Clin Orthop Relat Res, 2010, 468(9): 2553-2555.
[3] 路来金, 刘志刚, 中村廖吾, 等. 腕舟骨骨折的临床诊断与治疗.中华手外科杂志, 1998, 14(3): 144-146.
[4] Cheung GC, Lever CJ, Morris AD. X-ray diagnosis of acute scaphoid fractures. J Hand Surg Br, 2006, 31(1): 104-109.
[5] Welling RD, Jacobson JA, Jamadar DA, et al. MDCT and radiography of wrist fractures: radiographic sensitivity and fracture patterns. Am J Roentgenol, 2008, 190(1): 10-16.
[6] Hackney LA, Dodds SD. Assessment of scaphoid fracture healing. Curr Rev Musculoskelet Med, 2011, 4(1): 16-22.
[7] 丁建林, 易旦冰, 陈晓亮, 等. 64层CT及MRI诊断隐匿性骨折的临床价值. 中国医学影像学杂志, 2009, 17(1): 12-15.
[8] Memarsadeghi M, Breitenseher MJ, Schaefer-Prokop C, et al. Occult scaphoid fractures: comparison of multidetector CT and MR imaging--initial experience. Radiology, 2006, 240(1): 169-176.
[9] Breitenseher MJ, Metz VM, Gilula LA, et al. Radiographically occult scaphoid fractures: value of MR imaging in detection. Radiology, 1997, 203(1): 245-250.
[10] Brydie A, Raby N. Early MRI in the management of clinical scaphoid fracture. Br J Radiol, 2003, 76(905): 296-300.
[11] Yin ZG, Zhang JB, Kan SL, et al. Diagnosing suspected scaphoid fractures: a systematic review and meta-analysis. Clin Orthop Relat Res, 2010, 468(3): 723-734.
[12] Beeres FJ, Hogervorst M, Kingma LM, et al. Observer variation in MRI for suspected scaphoid fractures. Br J Radiol, 2008, 81(972): 950-954.
[13] Morin P, Reindl R, Berry GK, et al. Incorrect radiographic evaluation after vascularized bone grafting for scaphoid fracture or nonunion. Can J Plast Surg, 2011, 19(1): e6-e9.
[14] Suh N, Benson EC, Faber KJ, et al. Treatment of acute scaphoid fractures: a systematic review and meta-analysis. Hand (N Y), 2010, 5(4): 345-353.
[15] Urban MA, Green DP, Aufdemorte TB. The patchy confguration of scaphoid avascular necrosis. J Hand Surg Am, 1993, 18(4): 669-674.
[16] Cerezal L, Abascal F, Canga A, et al. Usefulness of gadoliniumenhanced MR imaging in the evaluation of the vascularity of scaphoid nonunions. Am J Roentgenol, 2000, 174(1): 141-149.
[17] Fox MG, Gaskin CM, Chhabra AB, et al. Assessment of scaphoid viability with MRI: a reassessment of fndings on unenhanced MR images. Am J Roentgenol, 2010, 195(4): 281-286.
[18] Dawson JS, Martel AL, Davis TR. Scaphoid blood fow and acute fracture healing. A dynamic MRI study with enhancement with gadolinium. J Bone Joint Surg Br, 2001, 83(6): 809-814.
[19] Schmitt R, Christopoulos G, Wagner M, et al. Avascular necrosis (AVN) of the proximal fragment in scaphoid nonunion: is intravenous contrast agent necessary in MRI? Eur J Radiol, 2011, 77(2): 222-227.
[20] Megerle K, Worg H, Christopoulos G, et al. Gadolinium-enhanced preoperative MRI scans as a prognostic parameter in scaphoid nonunion. J Hand Surg Eur Vol, 2011, 36(1): 23-28.
[21] Donati OF, Zanetti M, Nagy L, et al. Is dynamic gadolinium enhancement needed in MR imaging for the preoperative assessment of scaphoidal viability in patients with scaphoid nonunion? Radiology, 2011, 260(3): 808-816.
[22] Singh AK, Davis TR, Dawson JS, et al. Gadolinium enhanced MR assessment of proximal fragment vascularity in nonunions after scaphoid fracture: does it predict the outcome of reconstructive surgery? J Hand Surg Br, 2004, 29(5): 444-448.
[23] Ciprian S, Iochum S, Kohlmann R, et al. MR imaging accuracy in the prediction of bone graft healing potential in scaphoid nonunion. J Radiol, 2004, 85(10 Pt 1): 1699-1706.
R683.41;R455.2
2013-08-21
2013-10-18
(责任编辑 唐 洁)
1.天津医院放射科 天津 300211; 2.天津医院骨科 天津 300211
马信龙 E-mail: maxinlong8686@sina.com.cn
10.3969/j.issn.1005-5185.2014.03.018
