植物病原真菌拮抗细菌的筛选鉴定及活性成分分析1)
2014-03-06任建军师光禄高美娟王有年
任建军 师光禄 高美娟 王有年
(北京林业大学,北京,100083) (北京农学院) (农业部都市农业(北方)重点开放实验室(北京农学院))
据联合国粮农组织统计,每年因植物病害造成的减产量为总产量的10% ~15%[1]。目前,植物病害的防治方法主要是利用化学农药防治。随着人们对环保和健康关注程度的提高,使用化学合成农药带来的毒性、污染、残留、生态破坏等问题日益受到关注。因此,以高效、低毒、低残留的环境友好型生物农药逐步替代传统的高毒化学农药是农药发展的一种必然趋势[2],而安全性高、绿色环保的微生物农药则成为一种新兴的替代方法[3]。近年来,利用土壤中有益微生物控制病害的研究国内外均有报道[4-5],其中拮抗细菌在植物病害防治中起到非常重要的作用[6]。研究发现在植物根围区系中存在大量微生物,许多微生物及其代谢产物能够抑制植物病原菌的生长发育,因此从土壤中筛选植物病原菌的拮抗菌反施于土壤,可人为增加有益微生物类群,限制有害微生物生长,减少化学农药可能带来的环境污染,又解决了抗病品种筛选周期长、抗病单一的缺点[7-11]。获得高效拮抗菌株是进行生物防治研究的基础。本研究以筛选广谱拮抗菌株为目标,以园艺生产中常见的10 种植物病菌为指示菌,对采自北京市昌平区和怀柔区的农田土样中分离的103 株细菌菌株进行抑菌筛选。对拮抗效果好的细菌进行生理生化测定及16 S rRNA 序列分析,以鉴定细菌种类,并对活性菌株产生的抑菌蛋白进行提取及生物测定。旨在为植物病原菌的新型生防杀菌剂的研究和开发提供新的生防材料,为利用拮抗菌防治农业生产中各种病害提供理论依据。
1 材料与方法
1.1 材料
生防细菌:2010年7月于北京市昌平区南口镇和怀柔区桥梓镇农田采集的土样中分离获得。放入冰箱中4 ℃保存。
供试病原菌:棉花红腐病菌(Fusarium moniliforme Sheld.)、辣椒炭疽病菌(Colletotrichum gloesporioides (Syd.)Butl.)、茄子黄萎病菌(Verticillium dahliae Kleb.)、马铃薯干腐病菌(Fusarium solani(Mart.)Sacc.)、玉米青枯病菌(Ralstonia solanacearum Schw.)、辣椒根腐病菌(Fusarium vasinfectum Atk.)、黄瓜霜霉病菌(Pseudoperonospora cubensis (Berk.et Curt.)Rostov.)、李干腐病菌(Poloporus hirsutus Sacc.)、草莓灰霉病菌(Botrytis cinerea Pers.)、桃褐腐病菌(Monilinia laxa(Aderh.et Ruhl.)Honey),以上菌株由北京农学院都市农业(北方)重点实验室分离鉴定并保存。
供试培养基:PDA 培养基、LB 培养基。
1.2 方法
1.2.1 土壤细菌的分离与纯化
称取10 g 土样,在超净工作台中无菌条件下置于含有90 mL 磷酸缓冲液的三角瓶中,封口,用摇床160 r/min 振荡30 min,静置5 min,然后吸取上清液稀释至10-2~10-8倍,取10-5至10-8倍的稀释液0.1 mL 均匀涂满LB 培养基平板。37 ℃恒温培养12 h 后进行观察,挑取不同形态单菌落,分离纯化后将其编号为RN-01,RN-01,RN-03……并于冰箱中4 ℃保存备用[12]。
1.2.2 拮抗菌株的筛选
采用传统的对峙培养法初筛,将实验室冰箱中保存的病原菌从斜面转接到PDA 平板中,27 ℃培养3 ~5 d,待病原菌长满平板后,用直径为0.4 cm 的打孔器在病原菌边缘打取菌碟备用。然后在PDA 培养基平板中央接入病原真菌菌饼,在距离菌饼左右2.5 cm 处,用沾有细菌的接菌环划两条平行线,27℃培养,3 ~5 d 后测量细菌与病原真菌之间抑菌带的宽度,重复上述歩骤3 次,对所分离细菌的拮抗性进行初步筛选。根据拮抗细菌与病原真菌之间的拮抗直径采用分级方法统计拮抗效果:1 级,0 ~3 mm;2 级,3 ~6 mm;3 级,>6 mm。
1.2.3 细菌发酵后无菌滤液的抗菌谱活性测定
将初选的拮抗作用强的菌株转接至LB 培养基,37 ℃下培养12 h 后,接种至LB 液体培养基中,置于摇床上,在37 ℃、180 r/min 条件下,振荡培养24 h,然后在无菌条件下将菌体发酵液10 000 r/min离心15 min,取上清液在0.45 μm 微孔滤膜过滤器中过滤,即得到无菌滤液。然后将滤液与LB 培养基以体积比1∶ 9 混合。以不加滤液的培养基为对照,采用生长速率法测定其抑菌谱。按公式计算菌丝生长抑制率。生长抑制率=(对照菌落直径-处理菌落直径)/对照菌落直径×100%。
1.2.4 活性菌株的鉴定
形态特征的观察及生理生化测试:将活性菌株分别在LB 上划线和混入LB 培养基,于37 ℃下培养12 h 后观察单菌落形态特征,并将斜面培养24 h的待测菌接种于LB 液体培养基,37 ℃恒温静置培养2 d,观察培养液的变化。对抑菌效果稳定的菌株进行形态观察及革兰氏染色和芽孢染色初步鉴定其种属。参照文献[13]、[14]对活性菌株进行糖醇类发酵-产酸、运动性、耐盐性和需盐性、硝酸盐还原反应、接触酶反应、乙酞甲基甲醇试验(V- P 试验)、淀粉水解反应、柠檬酸盐利用、明胶液化反应测定。
分子生物学(16 S rRNA)鉴定:采用CTAB 法提取细菌基因组DNA[15],根据原核生物16 S rDNA 保守序列,采用上海英骏生物科技有限公司测定细菌16 S rRNA 的通用引物对DNA 模版进行PCR 扩增,F(5'-AGAGTTTGATCCTGGCTCAG-3')(Invitrogen);R(5'-GGTTACCTTGTTACGACTT-3')(Invitrogen)。扩增反应在25 μL 的16 S rRNA 扩增反应体系中进行。95 ℃下预变性5 min;95 ℃变性30 s,53 ℃退火30 s,72 ℃延伸90 s,32 个循环;然后72 ℃延伸5 min。反应结束后产物放于4 ℃保存。取5 μL PCR 扩增产物用0.8%琼脂糖凝胶在70 V 电压下电泳45 min,以DL5000 为Marker 进行分析。将PCR 回收产物送至上海英骏生物工程技术公司测序,将获得的序列用GeneBank 数据库中BLAST 程序进行分析并与己报道的序列进行同源性比较(http://blast.ncbi.nlm.nih.gov/),确定各菌株的系统发育学地位。
1.2.5 RN-61 蛋白质提取及抑菌活性测定
(4)有利于提高物流园区建设质量。基于EPC的智慧物流园区总包业务,设计发挥主导决定作用,可以及时便捷的向采购和实施提供技术支持和引导,将智慧物流园区的规划和设计方案贯穿整个总包项目中,实现园区建设质量的提升。
将拮抗菌株RN-61 培养于LB 液体培养基中,180 r/min,37 ℃的条件下震荡培养48 h。将培养液在4 ℃下置于离心机上10 000 r/min 离心15 min,取离心后上清液各500 mL 分别溶于不同饱和度的(NH4)2SO4溶液(60%、70%、80%、90%、100%)各500 mL 中。然后将该混合液放于冰箱中4 ℃静置48 h,将发酵液中的蛋白絮凝沉淀析出,再次以4℃,10 000 r/min 离心15 min,弃去上清液。用PBS缓冲液进行悬浮,并用与悬浮液相同浓度的PBS 透析(透析袋规格:25 KD)去除盐分,并稀释每种析出物到不同体积,测定提取物对桃褐腐病菌的抑菌活性,确定析出蛋白所需(NH4)2SO4的最适饱和度。
1.3 数据处理
应用DPS 软件Duncan’s 新复极差法进行统计分析。
2 结果与分析
2.1 土壤中拮抗细菌的分离与筛选
从采集的土样中共分获103 株细菌。用农业生产中10 种常见病原真菌做平板对峙试验,进行初步筛选。研究发现一部分菌株对所有供试病原菌均有抑制效果,这些菌株对多数病原菌有强拮抗活性。从表1中可以看出,对棉花红腐病菌、辣椒炭疽病菌、茄子黄萎病菌、玉米青枯病菌、辣椒根腐病菌、黄瓜霜霉病菌、李干腐病菌、草莓灰霉病菌、马铃薯干腐病菌具有抑菌活性的菌株分别为23、28、7、32、35、32、36、15、43、30 株,占分离得到菌株总数22.3%、27.3%、6.79%、31.06%、33.98%、31.67%、34.95%、14.56%、41.74%、30.09%。103 株野生菌株中对桃褐腐病菌有拮抗作用的菌株数最多,对茄子黄萎病菌有拮抗活性的菌株最少。对这些菌株的抑制难度前5 位为:茄子黄萎病菌、草莓灰霉病菌、棉花红腐病菌、辣椒炭疽病菌、马铃薯干腐病菌。对辣椒炭疽病菌和茄子黄萎病菌拮抗活性最强的仅为1 株,为难抑制病原菌,对黄瓜霜霉病菌有强抑制效果的菌株最多,为10 株。其中对10 种病原真菌均有抑制效果,而且拮抗活性多数为三级的菌株为RN-61 和RN-88。
图1为菌株RN-61 对10 种病原真菌的抑制效果图。可以看出,在菌株RN-61 的菌落周围有大小不等的抑菌带,真菌无法生长。由此可以推断,该菌在生长过程中有拮抗活性物质代谢并于培养基内渗透。其中RN-61 对辣椒炭疽病菌和玉米青枯病菌的抑菌效果相对其他病原菌略差,对桃褐腐病菌和草莓灰霉病菌的效果最明显。但可以确定该菌株为一株对各供试菌株均有抑制效果的广谱拮抗菌株。
2.2 活性菌抑菌谱的测定
用生长速率法测定筛选出的拮抗活性最好的2株菌株RN-61 和RN-88 的离体菌液抑菌活性,如表2所示。结果表明,2 菌株发酵后的无菌滤液对10 种供试病原真菌均表现出了不同程度的抑制生长作用。对桃褐腐病菌的抑制率都在80%以上;对棉花红腐病菌、辣椒炭疽病菌的抑制率较小,但也达到了在25%以上;对草莓灰霉病菌的抑制率也比较大,RN-61 达到79.12%,RN-88 菌株达到了73.68%;另外,RN-61 菌株的无菌滤液除了对玉米青枯病菌效果稍差以外,对茄子黄萎病菌、马铃薯干腐病菌、辣椒根腐病菌、黄瓜霜霉病菌、李干腐病菌的抑制率也都达到了50%以上。用肉眼可看到2 种菌株对所有指示菌都有拮抗效果,在其周围都有大小不等的抑菌带产生。
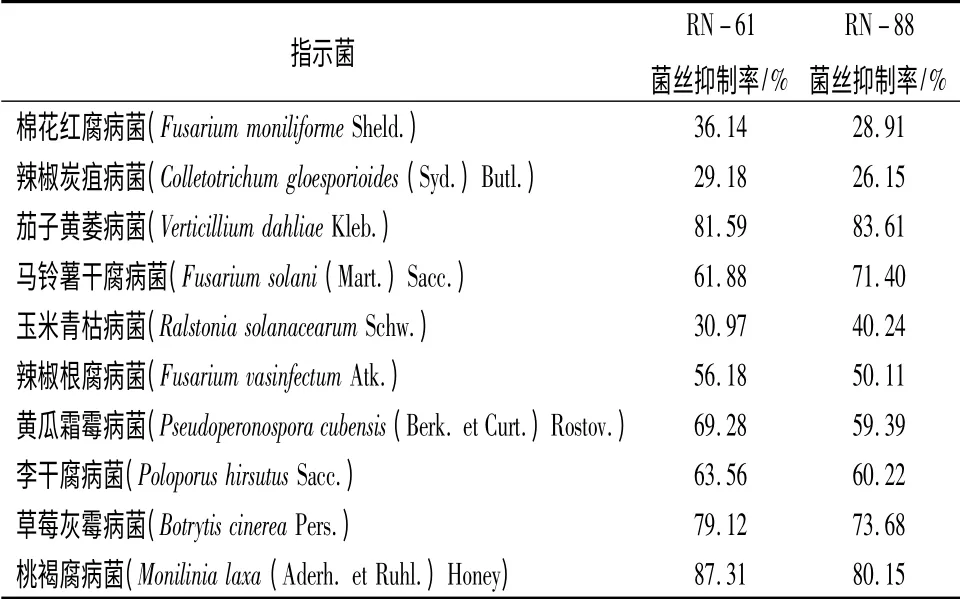
表2 菌株RN-61 和RN-88 无菌滤液的抑菌谱
2.3 RN-61 和RN-88 菌落形态及菌株的生理生化特征
对分离到的2 种具有广谱效果的拮抗菌的形态观察和生理生化测定结果见表3。分离菌株RN-61 在LB 上生长良好,培养24 h 后菌落中型,为圆形或近似圆形,乳白色,不透明,表面不光滑,无光泽,不产色素,随着培养时间延长,菌落变干,边缘突起,菌落上有褶皱及突起,亚甲基兰染色后光学显微镜下观察到菌体呈杆状,大小为(1.2 ~1.4)μm ×(0.6 ~0.8)μm,菌体周生鞭毛,芽孢椭圆形;分离纯化后的菌株RN-88,杆状,革兰氏染色阴性,无芽孢,能运动。在LB 培养基上培养20 h 后可形成菌落,菌落呈圆形,表面凸起,光滑,有光泽,较粘稠,为脓状物,边缘整齐。根据《常见细菌系统鉴定手册》及《伯杰细菌鉴定手册》所列的细菌菌株形态学和生理生化性状与表4描述的菌株RN-61 和RN-88的特征进行对比,初步判定这2 株菌株分别为枯草芽孢杆菌和荧光假单胞杆菌。
2.4 分离拮抗菌株的分子生物学(16 S rRNA)鉴定
2.4.1 16 S rRNA 的PCR 扩增结果
通过克隆将RN-61 号细菌与RN-88 号细菌的16 S rRNA,并进行测序分析,来确定它们在细菌分类中的地位。测序结果可以看出,RN-61 的16 S rRNA 序列长度为1 440 bp,RN-88 的16 S rRNA 序列长度为1 412 bp。表明针对细菌设计的引物序列比较准确,能够扩增出特异性片断。
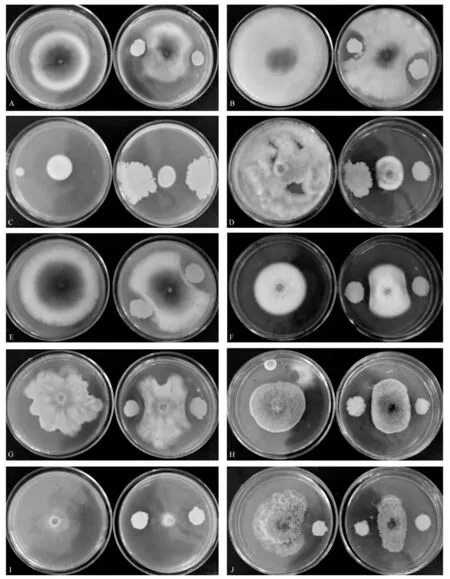
图1 拮抗真菌RN-61 对10 种病原真菌的拮抗活性
将RN-61 16 S rRNA 序列通过BLAST 程序与GeneBank 中收集的核苷酸序列比对,结果表明,相似性在99%以上的有20 个菌株核酸序列,主要是枯草芽孢杆菌(Bacillus subtilis),以及一些未确定的芽孢杆菌(Bacillu ssp.)。与地衣芽胞杆菌(Bacillus licheniformis)相似度为98%。与蜡状芽孢杆菌(Bacillus cereus)和专性嗜碱性芽孢杆菌(Bacillus pseudofirmus)相似度均为94%。由此可见,分离纯化的菌株RN-61 应为枯草芽孢杆菌属的一个菌株。该菌株的16 S rRNA 基因序列已收录于NCBI 数据库的GeneBank 里,登录号为KC840668。由于其与已知数据库中各菌株的最大相似度为99%,所以认为该菌株为一个新菌株,暂命名为Bacillus subtilis RN-61。这是由同种细菌的种内差异造成的,同属于枯草芽孢杆菌,但地理分布不同的菌株之间在遗传上存在的微小差异可以通过16 S rRNA 序列上的差异反映出来。
菌株RN-88 测序后与NCBI 数据库中已有菌株同源性比较的结果显示与该菌株相似度最大的是假单胞杆菌(Pseudomonas fluorescens F113)和丁香假单胞菌(Pseudomonas syringae),相似度均为99%,与施氏假单胞菌(Pseudomonas stutzeri)的相似度为97%。初步确定菌株RN-88 为假单胞菌属(Pseudomonas)。因此再结合菌株RN-88 的形态和生理生化的测定结果,可以鉴定该菌株荧光假单胞杆菌。
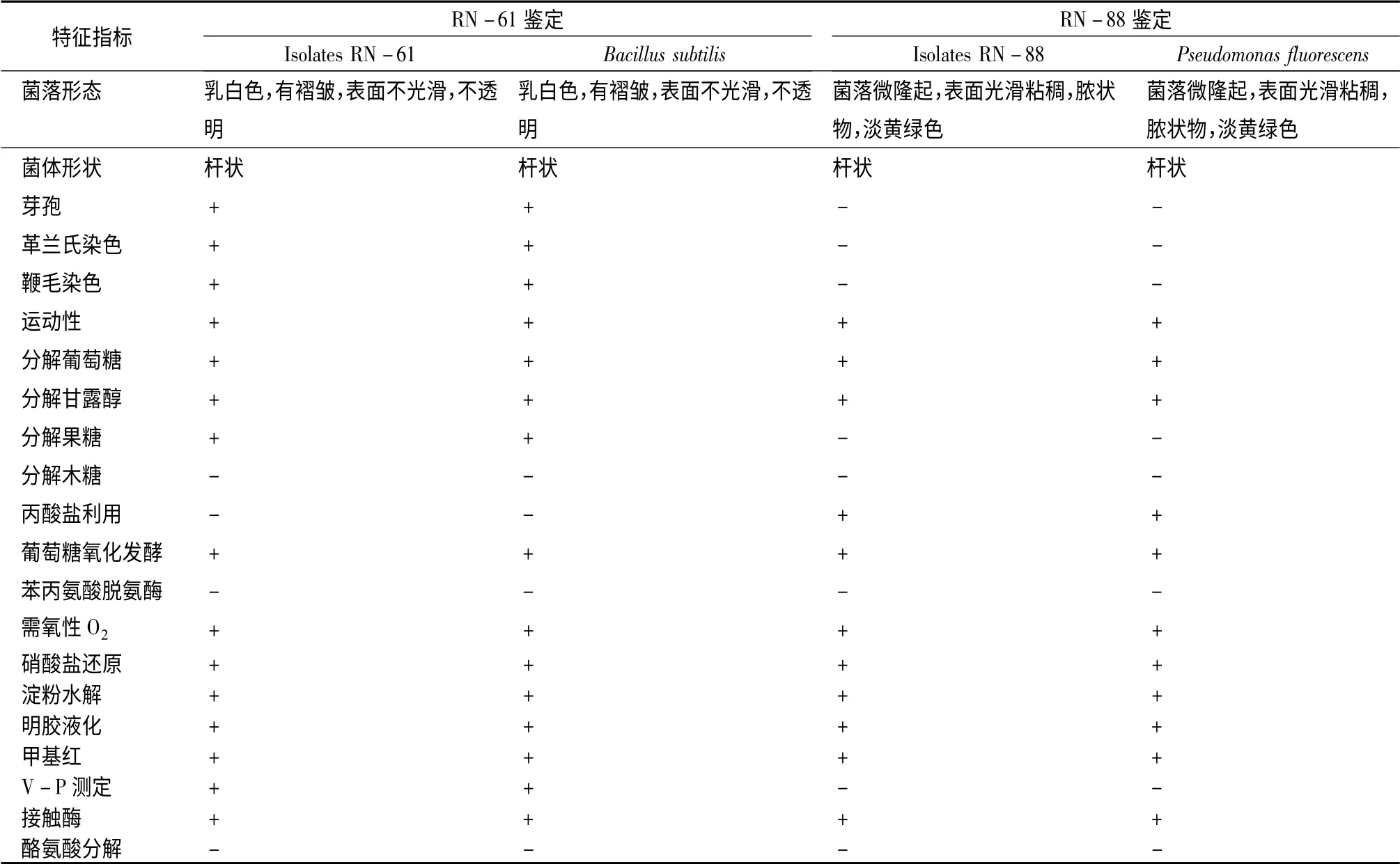
表3 菌株RN-61 和RN-88 形态及主要生化特征
2.4.3 RN-61 抗菌蛋白的提取及活性
由表4和图3可知,用饱和度为80% 的(NH4)2SO4析出的粗蛋白的抗菌能力最强,菌落直径为29.0 mm(P <0.05)。用饱和度为70%与90%的(NH4)2SO4提取的蛋白拮抗性相似,与80%饱和度下提取的蛋白相比,其抑菌活性相对较小。当饱和度在60%和100%时,抑菌活性大致相同,与其它饱和度相比最差(P <0.05)。不同的蛋白在不同的盐浓度下有着不同的溶解度,随着盐浓度的升高溶解度会有下降,因此,不同溶解度的蛋白会相继析出。
蛋白质的分子质量大小各有不同,对水的亲和程度也不同,因此,不同饱和度的(NH4)2SO4可以析出不同的蛋白。通过调节(NH4)2SO4的饱和度可使不同蛋白分别析出。由此可知,抑菌活性蛋白在饱和度为80%的(NH4)2SO4溶液中溶解度最小。
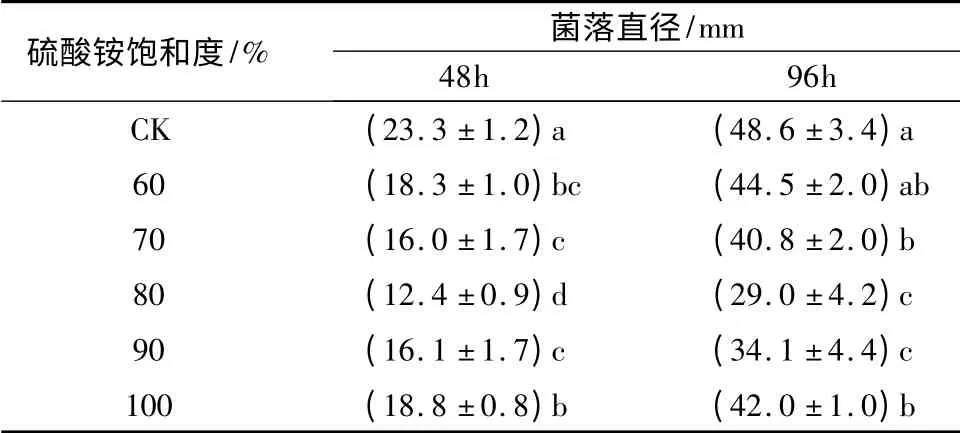
表4 不同饱和度(NH4)2SO4 沉淀蛋白的抑菌效果
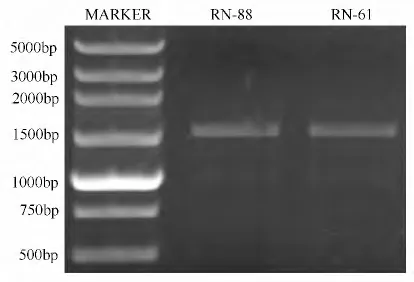
图2 RN-88 与RN-61 16 S rRNA 基因克隆

图3 (NH4)2SO4 不同饱和度下沉淀蛋白的抑菌效果
3 结论与讨论
从北京不同农田区土壤中共分离得到103 株细菌,以10 种农业生产中常见病菌为指示菌用对峙培养筛选法筛选具有广谱抑菌活性的拮抗细菌,并对其发酵产物进行抑菌活性测定。结果表明,编号为RN-61 和RN-88 的细菌菌株分别对指示病原菌具有强抑菌活性,鉴定其分别为枯草芽孢杆菌和荧光假单胞杆菌。经过不同饱和度(NH4)2SO4提取菌株RN-61 抑菌蛋白,并比较其抑菌效果,得出饱和度为80%的(NH4)2SO4析出的蛋白抗菌活性最好。
在长期的进化过程中存在植物根周围的多种微生物与植物之间形成紧密联系,一部分细菌能够很好抑制植物病原菌的生长和繁殖[16]。大量研究表明,拮抗细菌通过同植物竞争空间和营养的作用或诱导植物产生抗病性等作用机制防治植物细菌性病害传播。目前,关于生防芽孢杆菌应用研究的报道很多[3]。国内外有研究者研究表明,从根际土壤中筛选到的生防细菌较多的是芽胞杆菌、假单胞菌等[17-18]。本试验研究结果与前人所做研究的成果一致。目前蛋白质的分离和纯化技术相对成熟,国内外均有有关枯草芽孢杆菌的抗菌蛋白质的分离和纯化报道。谢栋等[19]从枯草芽饱杆菌BS-98 中分离到抗菌蛋白质对黄曲霉菌都有明显抑制作用;Lee等[20]从Bacillus subtilis SC-8 菌株的培养物中分析检测到一种对腊状芽孢杆菌有明显拮抗活性的物质。但对枯草芽孢杆菌RN-61 的抗菌蛋白质并不清楚。本研究根据前人研究方法,对粗分离拮抗菌株的抑菌蛋白进行研究,并确定了该类抑菌蛋白的最适(NH4)2SO4提取饱和浓度,为菌株蛋白的进一步研发应用奠定了基础。
利用细菌的抑菌作用研制出针对真菌所引起的植物病虫害的农药,可以很好的保护土壤环境,而且还能保证食物安全。新型的生物杀菌剂的研发和使用,在无公害生产中具有重要应用前景。筛选对病原菌有拮抗作用的细菌、真菌、放线菌等微生物,是采用生物防治手段控制土传病害的基础,国内外学者积极致力于生防微生物筛选[21-23]。王彩霞等[24]在对苹果树腐烂病拮抗细菌菌株BJ-1 的鉴定及其抑菌作用的研究中,以苹果树腐烂病菌为指示菌,筛选出拮抗细菌菌株BJ-1 对常见的8 株果树病原真菌表现显著的拮抗作用。本研究以广谱高效作为拮抗细菌筛选指标,对初歩筛选的对10 种病原菌抑菌效果较好的菌株RN-66 和RN-88 进行活性测定,菌株的无菌发酵液同样可以有效防治10 种病原真菌,显著抑制菌丝生长,说明菌株在发酵过程中产生了抑菌活性物质,在对发酵产生的抑菌蛋白活性进行了初步分离及活性测试,效果显著。由此可见,该菌株有潜在的生防应用价值。之前关于筛选拮抗细菌的研究中所选指示细菌数目较少,指标单一,筛选得到的拮抗细菌可能不具有广谱性,该试验将为广谱菌株的筛选提供理论基础,筛选出的菌株也将为广谱杀菌剂的研发提供新的材料。
植物根系周围土壤中生活着大量不同种类的细菌,大量研究表明不同生防菌提高植物抗耐病性的机制不同,有的是由某种机制单独起作用,有的是多种机制共同发挥作用[25-26]。此外,生防微生物多为活菌制剂,进行田间施用时,常受到温度、湿度、土壤、pH 值及土壤中其它细菌等外界因素的影响,生防菌株的生防能力和室内试验相比会有所变化[27]。本试验仅对筛选出的拮抗细菌的抗菌性进行了研究。因此,对筛选出的拮抗细菌拮抗蛋白的活性成分的鉴定、抑制机理和田间防治作用还需要在后续做进一步研究。
[1] 刘志俊,段渝峰.生物农药新概念新发展[J].农药科学与管理,2003,24(7):28-32.
[2] 康卓.中国生物源农药产业化进展[J].农药,2001,40(3):4-8.
[3] Emmert E A B,Handelsman J.Biocontrol of plant disease:a(Gram-)positive perspective[J].FEMS Microbiology Letters,1999,171(1):1-9.
[4] 程亮,游春平,肖爱萍.拮抗细菌的研究进展[J].江西农业大学学报,2003,10,25(5):732-737.
[5] 李长松.拮抗性细菌生物防治植物土传病害的研究进展[J].生物防治通报,1992,8(4):168-172.
[6] 李洪连,王守正.根际微生物与植物病害[J].河南农业大学学报,1989,23(4):401-408.
[7] 王光华,Raaijmakers J M.生防细菌产生的拮抗物质及其在生物防治中的作用[J].应用生态学报,2004,15(6):1100-1104.
[8] 孔健.农业微生物技术[M].北京:化学工业出版社,2005:46.
[9] Park J Y,Okada G,Takahashi M,et al.Screening of fungal antagonists against yellow of cabbage caused by Fusarium oxysporum f.sp.Conglutinans[J].Mycoscience,2002,43(6):447-451.
[10] Anith K N,Radhakrishnan N V,Manomohandas T P.Screening of antagonistic bacteria for biological control of nursery wilt of black pepper (Piper nigrum)[J].Microbiological Research,2003,158(2):91-97.
[11] 何礼远.细菌在植物病害生物防治上应用研究的进展[J].生物防治通报,1985,1(3):28-31.
[12] 贾凤安,陈亮,陈立,等.大棚甜瓜三种主要真菌病害拮抗细菌的筛选与鉴定[J].植物保护学报,2010,37(6):505-510.
[13] Gordon R E.芽孢杆菌属[M].蔡妙英,刘聿太,译.北京:中国农业出版社,1983.
[14] 东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001.
[15] 徐涛,胡同乐,王亚南,等.苹果树皮内生真菌的分离及其对腐烂病的生物防治潜力[J].植物保护学报,2012,39(4):327-333.
[16] 宗兆锋,钮绪燕,李君彦,等.西瓜枯萎病颉颃菌的筛选研究[J].西北农业大学学报,1995,23(2):60-64.
[17] Watanabe T,Tsukamoto T,Shirata A.Potential of an antagonistic bacterium isolate obtained from Lentinus lepideus basidiospores as a biocontrol agent[J].Mycoscience,2000,41(1):79-82.
[18] 汪雪静,卜春亚,靳永胜,等.草莓根腐病菌拮抗细菌的分离与鉴定[J].园艺学报,2011,38(9):1657-1666.
[19] 谢栋,彭憬,王津红,等.枯草芽孢杆菌抗菌蛋白X98Ⅲ的纯化与性质[J].微生物学报,1998,38(1):13-19.
[20] Lee N K,Yeo I C,Park J W,et al.Isolation and characterization of a novel analyte from Bacillus subtilis SC-8 antagonistic to Bacillus cereus[J].Journal of Bioscience and Bioengineering,2010,110(3):298-303.
[21] Heungens K,Parke J L.Postinfection biological control of oomycete pathogens of pea by Burkholderia cepacia AMMDR1[J].Phytopathology,2001,91(4):383-391.
[22] Saligkarias I D,Gravanis F T,Epton H A S.Biological control of Botrytis cinerea on tomato plants by the use of epiphytic yeasts Candida guilliermondii strains 101 and US 7 and Candida oleophila strain I-182:I.in vivo studies[J].Biological Control,2002,25(2):143-150.
[23] 何红,蔡学清,洪永聪,等.辣椒内生细菌的分离及拮抗菌的筛选[J].中国生物防治,2002,18(4):171-175.
[24] 王彩霞,张清明,李桂舫,等.苹果树腐烂病拮抗细菌菌株BJ1的鉴定及其抑菌作用[J].植物保护学报,2012,39(5):431-437.
[25] 许艳丽,张红骥,张匀华,等.复配生防菌株防治大豆根腐病的研究[J].大豆科学,2008,27(2):270-274.
[26] 徐刘平,尹燕妮,李师黙,等.拮抗细菌对土传病原菌的作用机理[J].中国生物防治,2006,22(1):10-14.
[27] 张丽,孙书娥.利用微生物防治植物病害研究进展[J].农药研究与应用,2010,14(6):10-13,24.
