神经干细胞定向分化过程中编码基因表达谱分析
2014-03-05朱丽媛彭小忠
张 靖,朱丽媛,阴 彬,侯 琳,彭小忠,2*
(中国医学科学院1.基础医学研究所北京协和医学院基础学院医学分子生物学国家重点实验室;2.神经科学中心,北京 100005)
哺乳动物中枢神经系统的早期发育包含一个重要的生物学事件即神经干细胞(neural stem cells,NSCs)定向分化为神经元和其他类型的神经细胞。这种时空严格限定的分化调控机制至今仍为神经发育研究领域关注的重要科学问题[1-2]。一些重要的编码基因在时间和空间上形成复杂的交互作用,共同完成对干细胞命运决定的促进与协调[3]。
本研究从神经干细胞定向分化为神经元与星形胶质细胞等不同的神经细胞类型过程中全基因编码基因的表达谱筛查入手,验证了一些已知的神经干细胞、神经元、星形胶质细胞特异表达基因的特征,同时也分析了基因组范围内编码基因转录产物的表达变化特点。从中归纳出一些神经系统发育重要通路,如Wnt、Insulin等通路,均在此生物学过程中发生了明显的变化。提示神经干细胞的分化过程是一个多基因通路综合变化的复杂网络。
1 材料与方法
1.1 实验动物
SPF级12周龄ICR孕鼠[由北京大学医学部动物中心提供,合格证号:SCXK(京)2006-0008]。
1.2 神经干细胞培养及诱导分化
参考本研究前期已发表文献[4]。
1.3 流式细胞法分析、分选神经干细胞、神经元细胞及星形胶质细胞
实验相关抗体(BD公司):CD15(#560127)、CD24(#553262)、CD44(#560568)和 CD184(#558644)。
神经干细胞分化7 d后,分别使用细胞表面标志物组合分选,获得了 CD24+/15low的神经元及CD184+/CD44+/CD24-/CD15-的星形胶质细胞。细胞消化、多重抗体标记及流式分析分选步骤按照公司提供标准实验方案进行。
1.4 Arraystar基因芯片筛查
本实验委托上海康成生物工程有限公司进行芯片杂交反应及芯片数据的初步整合分析。实验所使用芯片类型为NEW Mouse LncRNA Array V2.0(8x60K),其中包括31 423个 LncRNAs和25 376个编码基因的筛查。
1.5 生物信息学分析
编码基因功能注释:DAVID 6.7(http://david.abcc.ncifcrf.gov/);KEGG PATHWAY Database(http://www.genome.jp/kegg/pathway.html)。
芯片表达数据聚类分析:Cluster 3.0。
2 结果
2.1 编码基因在不同分化细胞类群中的变化特点
与NSC相比,分化7 d的神经元或星形胶质细胞中,表达水平改变(2倍以上变化率)的mRNAs的总数依次为4 407和2 874个;其中在神经元中表达上调的基因有2 751个,在星形胶质细胞上调的有1 494个;在神经元中下调有1 656个,星形胶质细胞中下调1 380个。同时,在上调的基因群中发现神经元和星形胶质细胞共变的有189个;下调基因中二者共变的有288个。
本研究着重分析了芯片中重要的神经干细胞、神经元及星形胶质细胞标记分子的表达变化情况(图1)。
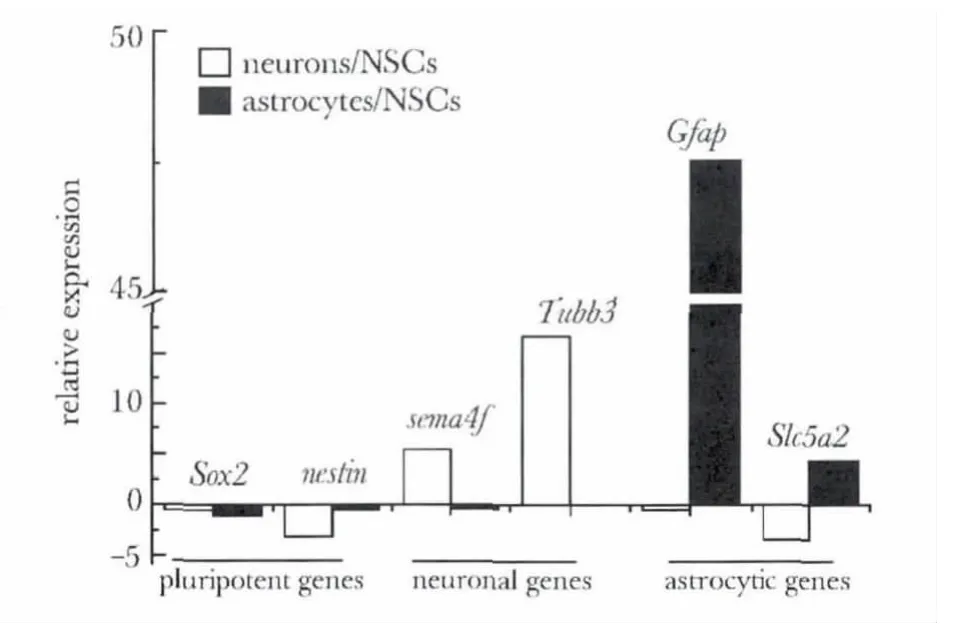
图1 芯片中NSCs特定分化型细胞中星形胶质细胞、神经元标记分子的表达Fig 1 The histograms are displayed marker genes of NSCs,neurons and astrocytes are specifically expressed in corresponding cell types
通过对图1中NSCs干性维持标记分子(Sox2、Nestin)在分化前后细胞内表达水平的比较可以看出,随着NSCs分化进程的深入,干性标记分子的表达持续下降;神经元标记分子(Sema4f、Tubb3、Grid1)在神经元和NSCs及星形胶质细胞中存在明显的表达差异;同样,星形胶质细胞的标记分子(Stat3、Gfap)在星形胶质细胞中出现了明显的上调,而在NSCs及神经元中则维持很低的水平。
2.2 Wnt、Insulin通路活性分别在神经分化、胶质分化中特异性增强
本研究进一步通过基因调控通路分析(pathway analysis)的分析方法发现,一些比较明确的基因调控通路NSCs与神经元/星形胶质细胞之间、神经元与星形胶质细胞之间存在显著差异(图2,3)。
在星形胶质细胞中,经典Wnt通路上的多个基因表达活性与NSCs相比明显增强:Fzd1(NM_021457;7.14倍)、Fzd2(NM_020510;2.5倍)Fzd6(NM_001162494;2.14倍)、Fzd7(NM_008057;3.18倍)、Fzd8(NM_008058;10.12 倍)、Gbp2(NM_010260;2.04倍)、Apc2(NM_011789;2.44 倍)、Map3k7(NM_172688,Tak1;2.01 倍)、Jun(NM_010591;5.85倍)。而非经典Wnt(PCP)通路中与NSCs相比明显表达增强的有:Vangl2(Stbm,NM_033509;2.45 倍)、Mapk8ip3(NM_001163448,3.0倍;NM_013931,2.21 倍;NM_001163447,2.9 倍)。钙离子依赖的Wnt通路中明显表达增强的有:Plcb1(NM_001145830;2024倍)、Camk2a(NM_009792;2.79倍)。
其次,在分化的神经元中,Insulin通路上节点基因的特异增强也是一个显著的特点:Irs2(NM_001081212;3.16倍)、Socs1(NM_009896;5.68倍)、Socs3(NM_007707;15.27 倍)、Socs4(NM_080843;4.18倍)、Socs5(NM_019654;2.04倍)、Foxo1(NM_019739;2.38 倍)、Pik3r1(P13K,NM_001077495;2.14倍)、Phka2(NM_001177879;2.75 倍)、Phkg1(NM_011079;9.83倍)、Eif4e(NM_007917;2.95倍)、Grb2(NM_008163;2.91倍)、Hras1(NM_008284;2.35倍)、Araf(NM_001159645;2.83倍)、Braf(NM_139294;2.24 倍)、Mapk1(NM_001038663;2.01倍)。
2.3 P53通路活性在神经分化、胶质分化中共同下调
与上述Wnt、Insulin通路不同,NSCs分化为神经元和星形胶质细胞的过程中,P53通路上一些节点基因的表达则呈现下调的特征。与NSCs相比,星形胶质细胞(图4)中P53通路上的Trp53(NM_001127233;0.14 倍)、Gtse1(P99,NM_013882;0.15倍)、Pmaip1(Noxa,NM_021451;0.31 倍)、Perp(NM_022032;0.28倍)、Igfbp3(NM_008343;0.37倍)、Igf1(NM_184052;0.16 倍)、Sesn2(NM_144907;0.12倍)、Ccng1(NM_009831;0.18倍)表达均明显下调。

图2 Wnt通路上一些节点基因在星形胶质细胞中特异性表达上调Fig 2 In the Wnt pathway multiple genes are active during the NSCs differentiated to astrocytes

图3 Insulin通路上一些节点基因在神经元中特异性表达上调Fig 3 In the insulin pathway,multiple genes are active during the NSCs differentiated to neurons
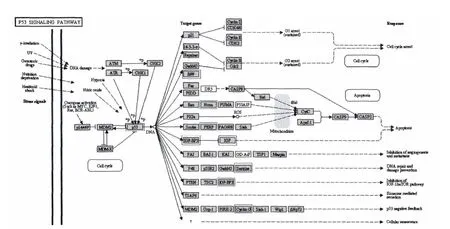
图4 P53通路上一些节点基因在星形胶质细胞中特异性表达下调Fig 4 In the P53 pathway,multiple genes are silenced during the astrocytic differentiation of NSCs
在神经元中(图5),P53通路中以下节点基因均有明显下调:Trp53(NM_001127233;0.24倍)、Gtse1(NM_013882;0.15倍)、Igfbp3(NM_008343;0.06倍)、Ccnd1(NM_007631;0.13)、Cdk1(NM_007659;0.01)、Igf1(NM_184052;0.09 倍)、Sesn2(NM_144907;0.15倍)。

图5 P53通路上一些节点基因在神经元中特异性表达下调Fig 5 In the P53 pathway,multiple genes are silenced during the neuronal differentiation of NSCs
3 讨论
NSCs的分化过程可以由细胞内在的自编程特性再加上胞外的诱导信号共同推动,发育基因的有序开、关表达促进了特定细胞类型限制性的命运决定[5-7]。本研究发现的一批神经系统发育相关基因随NSCs的定向分化呈现细胞特异性变化,提示它们在NSCs细胞命运决定事件中发挥着重要作用,如在神经元和星形胶质细胞之间协同变化基因可能与启动NSC分化行为有关,而二者之间相异部分的变化可能与NSCs的不同分化方向有关。
通过生物信息学分析,本研究归纳出一些重要信号通路上的节点基因在NSCs定向分化过程中出现细胞类群特异性的变化谱式。如P53作为重要的抑癌基因已经得到了广泛的研究,但是其作为NSCs自我更新、定向分化重要调控基因的功能研究是近期神经干细胞研究领域的新的热点问题。在体条件下,P53的失活导致NSCs自我干性维持能力的降低,从而引起NSCs的分化[8]。本研究观察到P53通路的活性变化可能与NSCs的自我增殖特性相关,P53通路的抑制可能是 NSCs分化的必要条件。
在NSCs定向分化至神经元与胶质细胞的过程中,Insulin和Wnt通路的特异性活化可能促进了NSCs向神经元、胶质细胞的分化,并参与了不同细胞类群身份确定的调控。胰岛素作为一种多功能的蛋白质激素,除了经典的代谢调节作用外,还具有重要的促生长作用[9-11]。体外培养的NSCs神经球给与胰岛素可出现自我增殖加快的特点;而胰岛素信号通路的激活可影响NSCs神经细胞分化的效率[10-12]。另外,敲低miR-106b-25簇可以降低NSCs的自我增殖能力[13]。由于 miR-106b-25簇在胰岛素/胰岛素样生长因子1(insulin/insulin-like growth factor-1,IGF)信号通路上存在一系列的靶基因,其中FoxO3作为转录因子影响着成体干细胞的干性及分化,并可以结合到miR-106b-25的转录调控区域,从而影响着该簇miRNAs的转录活性,由此胰岛素信号通路与miR-106b-25簇之间就形成了一个正反馈环路。本研究观察到分化神经元中胰岛素信号通路上包括FoxO3在内的多个节点基因被连续激活,提示该通路的激活是影响NSCs神经分化的重要因素;同时也提示该通路可能通过一些正负反馈的形式与其他重要调控方式,如非编码RNA的调控产生联系,共同决定了NSCs的细胞命运。
[1]Peters A,Jones EG.Cellular components of the cerebral cortex[M].New York:Plenum,1984:337-360
[2]Finlay BL,Darlington RB.Linked regularities in the development and evolution of mammalian brains[J].Science,1995,268:1578-1584.
[3]Temple S.The development of neural stem cells[J].Nature,2001,414:112-117.
[4]赵祥宇,舒鹏程,张靖,等.小鼠脑皮质神经干细胞体外培养及miRNAs影响其分化能力[J].基础医学与临床,2011,31:630-635.
[5]Desai AR,McConnell SK.Progressive restriction in fate potential by neural progenitors during cerebral cortical development[J].Development,2000,127:2863-2872.
[6]Rajan P,McKay RD.Multiple routes to astrocytic differentiation in the CNS[J].J Neurosci,1998,18:3620-3629.
[7]Johe KK,Hazel TG,Muller T,et al.Single factors direct the differentiation of stem cells from the fetal and adult central nervous system[J].Genes Dev,1996,10:3129-3140.
[8]Liu H,Jia D,Li A,et al.P53 regulates neural stem cell proliferation and differentiation via BMP-Smad1 signaling and Id1[J].Stem Cells Dev,2013,22:913-927.
[9]Rafalski VA,Brunet A.Energy metabolism in adult neural stem cell fate[J].Prog Neurobiol,2011,93:182-203.
[10]Androutsellis TA,Rueger MA,Mkhikian H,et al.Signaling pathways controlling neural stem cells slow progressive brain disease [J].Cold Spring Harb Symp Quant Biol,2008,73:403-410.
[11]Berthoud HR,Bereiter DA,Trimble ER,et al.Cephalic phase,reflex insulin secretion.Neuroanatomical and physiological characterization [J].Diabetologia,1981,20 Suppl:393-401.
[12]Desai M,Li T,Ross MG.Hypothalamic neurosphere progenitor cells in low birth-weight rat newborns:neurotrophic effects of leptin and insulin[J].Brain Res,2011,1378:29-42.
[13]Brett JO,Renault VM,Rafalski VA,et al.The microRNA cluster miR-106b~25 regulates adult neural stem/progenitor cell proliferation and neuronal differentiation[J].Aging,2011,3:108-124.
