萱草优良单株花茎离体快繁1)
2014-03-05张洁茹刘晓嘉陈丽飞赵春莉顾德峰
张洁茹 刘晓嘉 陈丽飞 赵春莉 董 然 顾德峰
(吉林农业大学,长春,130118)
萱草(Hemerocallis spp.)作为百合科萱草属的极具经济价值和广阔前景的宿根花卉[1-2],越来越受到人们的青睐。但由于其自然分蘖繁殖的速度慢,远不能满足城市绿化日益增长的需求,而利用组培快繁技术可以极大地提高萱草的繁殖倍数,加快繁殖速度,实现规模化生产。目前,国内关于萱草组培快繁的研究诸多,主要是对国外引进的萱草新品种进行组培快繁的研究[3-6],而对萱草品种杂交后选育的优良单株再进行离体快繁无性系研究少见报道[7];并且很多研究中,多数以花茎作为外植体,但由于萱草整株花茎很长又有分蘖,具体哪个部位启动效果好,并未做出细节上的研究。因萱草品种间差异大,不同品种的诱导途径、所需的激素种类及浓度存在差异性,所以针对每一品种系统地展开组培快繁的研究。
为能充分利用我国优质的萱草种质资源、降低由国外引种产生的高额成本,本试验以北京引进的、资源有限的2 个萱草新品种和自行杂交后代优选出的2 个萱草单株为试材,通过萱草花茎诱导愈伤组织和不定芽的途径对4 个萱草材料分别建立有效的离体快繁体系,并对花茎不同部位的启动效果做了较详尽的研究,还比较了4 个萱草材料在启动培养、增殖培养中的差异性,以期为不同萱草品种的工厂化育苗提供技术支撑,弥补品种单一的空缺,为我国的园林景观多添新彩;并且还可以建立具有自主品种产权的萱草新品种,为下一步品种审定及品种推广奠定基础。
1 材料与方法
以北京引进的萱草新品种及吉林农业大学萱草试验田经多年栽培选育出的萱草杂交后代优良单株为试材。选用的4 个萱草材料,分别编号为WNF(无名粉)、L - 1(绿色眼睛)、RBH、CC627,其中WNF 和L-1 为北京引进的新品种:花为粉红色系、花冠大,直径约14 cm;RBH 和CC627 为选育出的优良单株:植株矮化、花茎高约25 cm、花单瓣双色。本试验于天气晴朗的清晨,截取抽葶20 cm、未开花、生长健壮、无病虫害的萱草花茎作为外植体。
外植体灭菌:将抽葶20 cm 的萱草花茎分为上、中、下3 个部位,即距花托1.5 ~3.5 cm 处为花茎分枝处的“Y”型茎段,作为花茎上部;距花托3. 5 ~10.0 cm 处分节部位作为花茎中部;距花托>10.0 cm 分节部位作为花茎下部。将取回的材料根据上、中、下部位分别剪切成2.0 ~2.5 cm 的小段(图1中A、B)。因其幼嫩程度不同,对花茎上、中、下部位分别采用不同的方法灭菌,即花茎上部用75%酒精浸泡10 s 后再用0.1% HgCl2浸泡13 min;花茎中部用75%酒精浸泡20 s 后再用0.1% HgCl2浸泡14 min;花茎下部用75%酒精浸泡30 s 后再用0.1% HgCl2浸泡15 min,最终无菌水冲洗6 ~7 次,备用。
启动培养:将灭菌完毕的外植体分别接种于不同激素质量浓度配比的启动培养基上(表1),每次处理100 瓶,每瓶1 个外植体,3 次重复。接种后观察萌动时间、愈伤着生位置、愈伤类型等,30 d 后统计启动率,以期筛选出4 个萱草材料的最佳取材部位、最适启动培养基。启动率=(萌动的外植体数/接种的无污染外植体数)×100%;出愈率=(形成愈伤组织的外植体数/接种的无污染外植体数)×100%;不定芽分化率=(愈伤组织分化不定芽的外植体数/形成愈伤组织的外植体数)×100%;出芽率=(直接诱导出不定芽的外植体/接种的无污染外植体数)×100%,见表2所示。
继代增殖培养:将分化不定芽的愈伤组织分切成0.5 cm×0.5 cm 小块(图1中J)和直接诱导出的不定芽(图1中K)接种于不同激素质量浓度配比的增殖培养基上(表3),每次处理5 瓶,每瓶10 丛,1丛3 个芽,3 次重复。30 d 后统计不定芽的增殖率及系数,以期筛选出4 个萱草材料各自的最适增殖培养基。增殖率=(增殖的不定芽愈伤块/接种总块数)×100%;增殖系数=增殖瓶数/接种总瓶数。
数据分析:试验数据均用Excel 2003 和DPS v7.05 统计软件进行统计分析。
培养条件:试验所用基础培养基为MS 培养基,添加蔗糖30 g/L、卡拉胶8 g/L,pH=5.8,培养温度为(23±2)℃,光照强度为2 000 lx,光照时间为14 h/d。
2 结果与分析
2.1 不同激素质量浓度配比对外植体启动效果的影响
接种30 d 后,在不加任何激素的Q1 处理下,4个萱草材料启动率均为0,可见适宜外源激素添加对启动培养的重要性。NAA 质量浓度的高低对4个萱草材料的启动效果无显著影响,而6 -BA 和2,4-D 质量浓度的高低对4 个萱草材料的启动效果存在显著差异。其中WNF、L -I 表现出一致性,适合二者的培养基6 -BA 质量浓度均为1.0 mg/L,随质量浓度的不断增加,启动率逐渐降低,只在添加1.0 mg/L 2,4-D 的Q3 处理下启动率最大,分别为45.00%和37.60%;CC627 随6 -BA 质量浓度增加,启动率先升高后降低,当6-BA 质量浓度为2.0 mg/L、添加1.0 mg/L 2,4 -D 的Q5 处理下启动率达到最大值62.53%;RBH 在添加2,4 -D 的培养基中均未出现萌动现象,而在未添加2,4 -D,6 -BA 质量浓度为3.0 mg/L 的Q12 处理下启动率达到最大值28.30%。
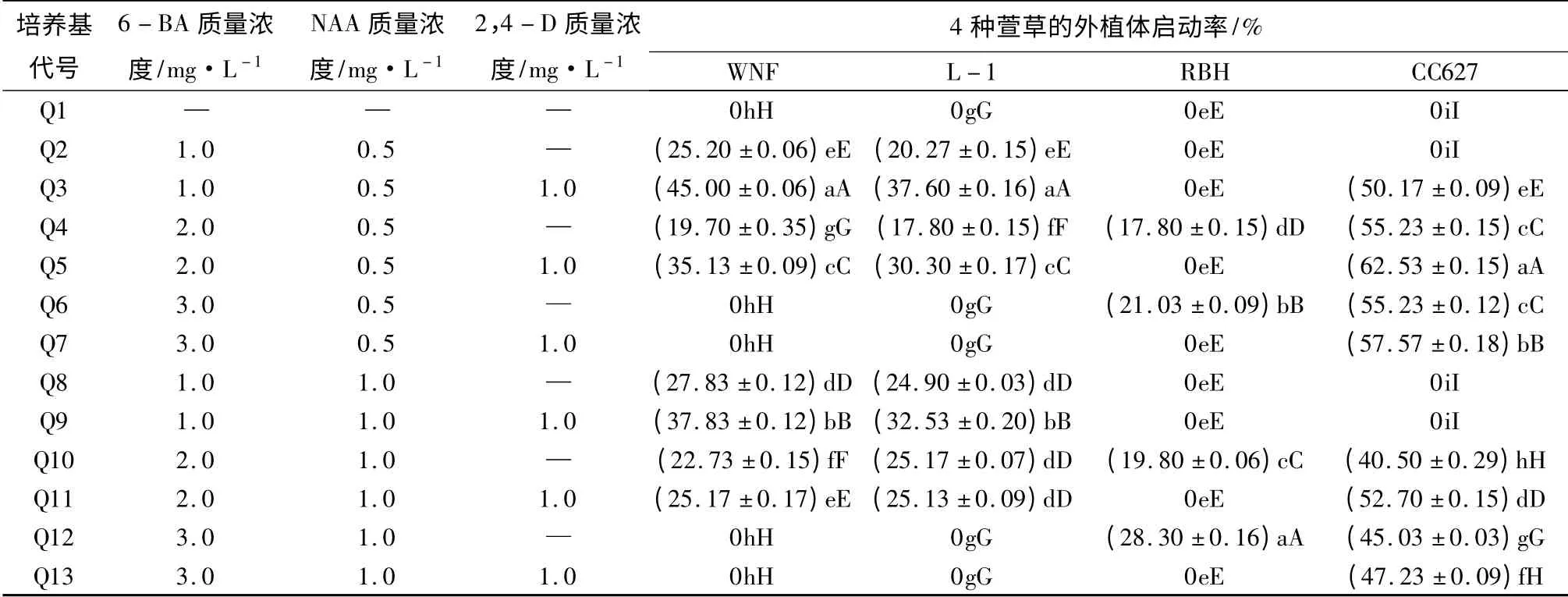
表1 不同激素组合中外植体的启动状况
启动培养中发现,以花茎为外植体出现间接和直接不定芽发生型[8]两种途径。不同激素质量浓度配比下诱导的愈伤组织类型多样,其中两类较优质的愈伤组织为:①乳白或黄色,质地紧实,表面凹凸不平,有颗粒感,剖开无褐化(图1中E);②绿色,质地较软,表面凹凸不平,有黄白色小芽点(图1中F)。当6 -BA 与NAA 配比时易诱导出①号愈伤组织,而在6 -BA、NAA 和2,4 -D 三者共同作用下易诱导出②号愈伤组织;并且在添加2,4 -D 诱导出的愈伤组织较不添加2,4 -D 诱导出的愈伤组织质地疏松,分化不定芽的速度快、数量多,可见2,4 -D是影响愈伤组织诱导的一个重要因素。综合考虑,WNF 和L -1 最适启动培养基为MS +6 - BA1.0 mg/L+NAA0.5 mg/L+2,4 -D1.0 mg/L;RBH 最适启动培养基为MS +6 -BA3.0 mg/L +NAA1.0 mg/L;CC627 最适启动培养基为MS+6-BA2.0 mg/L+NAA0.5 mg/L+2,4 -D1.0 mg/L。
2.2 外植体取材部位对启动效果的影响
接种1 周后,外植体均有不同程度的翻卷,其中上部“Y”型茎段分叉处及切口与培养基接触部位(图1中C、D)、中部茎段分节处及切口与培养基接触部位均略有白色瘤状突起。随培养时间增加,白色瘤状突起逐渐变大,5 周后,“Y”型茎段分叉处及切口处的瘤状突起形成团状愈伤组织;中部茎段分节处的瘤状突起直接形成不定芽(图1中H、I)、切口处形成团状愈伤组织,而下部茎段无萌动现象。
由表2显示,花茎上部只呈现间接不定芽发生途径,而中部呈现间接和直接不定芽发生两种途径。不同萱草材料、不同部位愈伤和不定芽诱导率差异较大,其中CC627 花茎上、中部出愈率最高,分别达到86.30%和65.73%,而RBH 出愈率最低,仅为36.56%和20.30%。CC627 花茎上、中部不定芽分化率分别高达91.30%和58.30%,RBH 花茎上部愈伤分化率最低为52.47%,而中部愈伤组织无分化现象。4 个萱草材料均只在花茎中部直接诱导出不定芽,其中RBH 出芽率最高为48.57%,而CC627出芽率最低为32.87%。综合考虑,花茎上部愈伤组织形成与分化能力较花茎中部强,但花茎中部直接诱导出不定芽的能力较强,省略了脱分化环节,可以大大的缩短繁育周期,故花茎上部和中部为萱草离体快繁的最佳外植体。
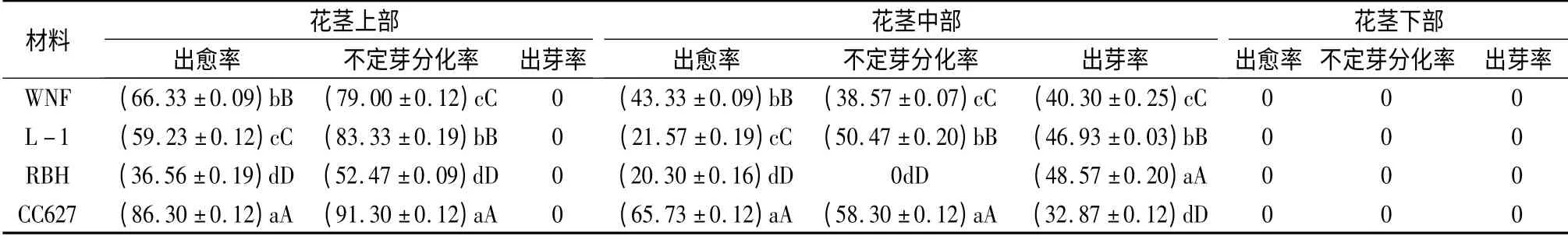
表2 外植体不同取材部位的启动状况 %
2.3 不同质量浓度激素配比对增殖状况的影响
由表3显示,(1)WNF 和L-1 呈现出一致的趋势,NAA 质量浓度为0.1 mg/L 或0.2 mg/L 时,细胞分类素KT 添加与否,对WNF 和L -1 的增殖率差异显著。当单独添加6 -BA2.0 mg/L 与0.1 mg/L或0.2 mg/L NAA 配比时,WNF 在增殖率上无显著差异,但比较增殖系数,添加0.2 mg/L NAA 在P<0.05 水平上显著差异于添加0.1 mg/L NAA;而L-1 增殖率在P <0. 01 水平上存在极显著差异。(2)当确定NAA 质量浓度后,RBH 的增殖率随细胞分裂素质量浓度升高而不断增大,但当细胞分裂素质量浓度(6 -BA +KT)为4.0 mg/L 时,增殖率明显下降。在Z4 处理下添加(6 -BA +KT)3.0 mg/L与Z5 处理下单独添加6 -BA3.0 mg/L 虽不存在显著差异,但Z4 处理的增殖率明显低于Z5 处理,并且Z4 处理下易出现增殖苗不整齐现象。当6 -BA3.0 mg/L,NAA0.2 mg/L 时,RBH 增殖率和增殖系数均达到最大,分别为95.17%和3.28。(3)CC627 增殖能力极强,只要细胞分裂素在1.0 ~3.0 mg/L 时,无论单独添加6 -BA 或6 -BA 与KT 共同作用,增殖率均为100%,比较增殖系数,Z8 处理下的增殖系数在P <0.05 水平下显著差异于其它各处理。4 个萱草材料的增殖状况不尽相同,综合考虑,WNF 和L-1 最适增殖培养基为MS + 6 - BA2. 0 mg/L +NAA0.2 mg/L;RBH 最适增殖培养基为MS +6 -BA3.0 mg/L +NAA0.2 mg/L;CC627 最适增殖培养基为MS+6 -BA1.0 mg/L+KT1.0 mg/L+NAA0.2 mg/L。
3 结论与讨论
以抽葶20cm 的萱草花茎为外植体进行启动培养,研究发现同一花茎上、中、下不同部位在诱导途径、启动效果上存在差异性。其中,花茎下部未见启动,花茎上部和中部启动能力强,视为最佳外植体,这与倪新等[9]研究有一些出入;并且花茎上部呈现间接不定芽发生途径,中部呈现间接和直接不定芽发生两种途径,即花茎上部在分叉处和切口接触培养基处先形成愈伤再分化产生不定芽,这与高凤[5]、兰丽婷[10]、毕晓颖[11]的研究结果一致;花茎中部在分节处和切口接触培养基处也可先形成愈伤再分化产生不定芽,但愈伤量少于花茎上部分叉处,不过花茎中部还可以在分节处直接诱导出不定芽。这可能是由于花茎上部较中部存在更多的幼嫩组织,而幼嫩组织更有利于形成大量的愈伤组织。而花茎中部存在的组织正好处于幼嫩组织和成熟组织之间,一部分幼嫩组织可形成少量的愈伤组织,另一部分较成熟的组织可不经过愈伤组织阶段直接从外植体上产生不定芽。
启动培养中发现,花茎分叉处、分节处及切口处3 个不同位置均可形成较好愈伤组织(①号和②号),这主要与不同激素质量浓度的组合有关,而与愈伤着生位置无太大关系。其中,6 -BA 和2,4 -D质量浓度的高低显著影响启动率的高低,而NAA 质量浓度的高低对其无显著影响,这一结果与兰丽婷等[10]的研究相同。而过高质量浓度的6 -BA(质量浓度大于3.0 mg/L 时)易产生水渍状愈伤和畸形不定芽(图1中G),故应控制其用量;添加一定量的2,4 -D 对愈伤组织的疏松程度及分化有着一定影响,但应与其它生长素类物质配合使用效果才明显,这与宋雪莲[12]、杨丽莉[13]、时颂[14]的研究一致。
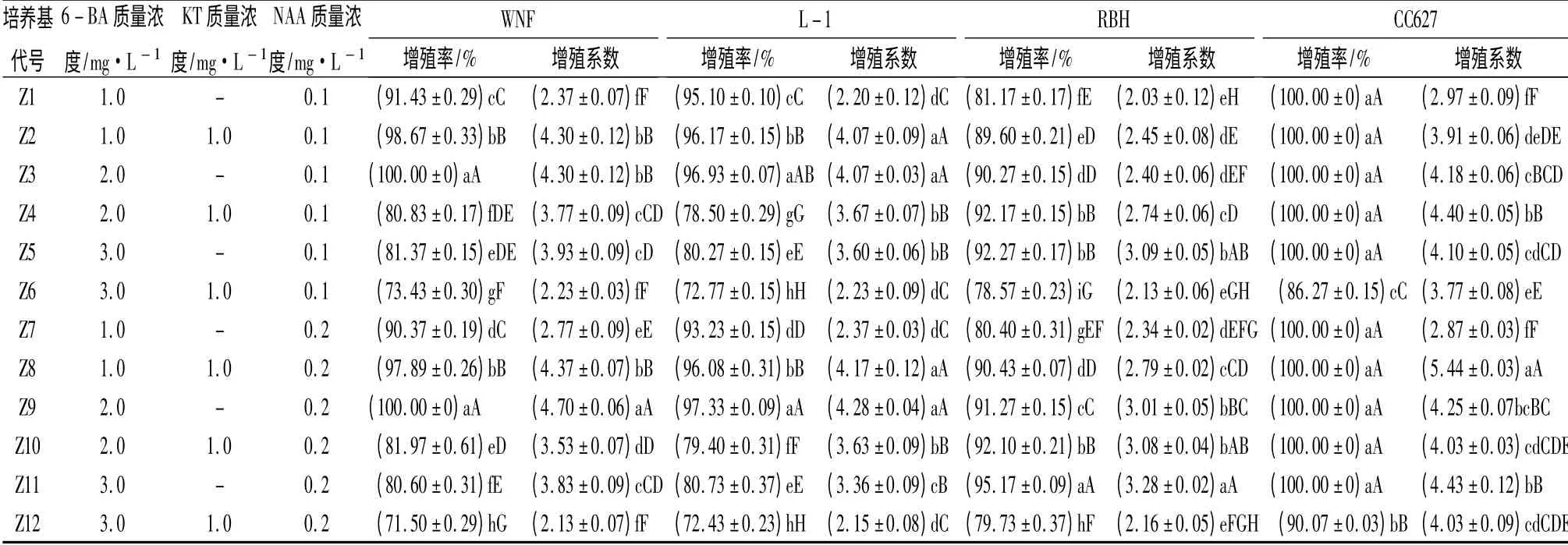
表3 4 种萱草在不同培养基中不定芽增殖状况

图1 萱草外植体处理、启动培养、增殖培养
激素配比是试管苗增殖的关键,细胞分裂素起主导作用[15-16],增殖培养中发现,KT 与6 -BA 相互作用配合低质量浓度的NAA 对萱草不定芽增殖有一定影响,但要视不同品种而定,CC627 在KT 与6 -BA 相互作用下呈现出较好的增殖效果,而RBH却呈现出增殖苗长势不一致的现象。这可能与KT、6 -BA 二者促进不定芽形成的效力不同及不同植株体内所含内源激素的差异性有关。
4 个萱草材料在启动培养、增殖培养中差异显著,其中CC627 无论启动还是增殖培养均呈现出较强的优势,而RBH 在启动与增殖培养中较其它3 个材料均处于劣势,但其花茎中部直接诱导不定芽的能力最强。这可能与激素质量浓度配比和品种基因型有关[12],表明不同品种的生长适应性存在一定的差异。
[1] 费砚良.宿根花卉[M].北京:中国林业出版社,1993.
[2] Tomkins J P,Wood T C,Bames L S,et al. Evaluation of genetic variation in the daylily (Hemerocallis spp.)using AFLP markers[J]. Theoretical and Applied Genetics,2001,102(4):489-496.
[3] 李艳梅,王桂兰,陈超,等.大花萱草新品种“红运”快繁体系的建立[J].河南农业科学,2006(8):120 -122.
[4] 吕秀立,施季森,吕光明,等.“双玫瑰”萱草的离体培养和快速繁殖[J].杂草科学,2009(1):31 -33.
[5] 高凤,王雪,张婷婷,等.萱草引进新品种“Forgotten Dreams”的组织培养技术[J].江苏农业科学,2012,40(8):60 -62.
[6] 杨丽莉,张晓,杨睿,等.大花萱草‘莎蔓’的组织培养技术研究[J].北方园艺,2012(19):134 -137.
[7] 储博彦,尹新彦,赵玉芬.萱草新品种“粉红宝”和“金红星”的选育[J].北方园艺,2013(8):63 -65.
[8] 巩振辉,申书兴.植物组织培养[M]. 北京:化工工业出版社,2007:52.
[9] 倪新,马毓. 多倍体萱草的组织培养及繁殖[J]. 园艺学报,1984,11(3):202 -205.
[10] 兰丽婷,李冲,任爽英,等. 萱草新品种组培再生体系的建立[J].东北林业大学学报,2011,39(4):14 -17.
[11] 毕晓颖,王宁.萱草花茎离体培养与快速繁殖[J]. 东北林业大学学报,2012,40(11):56 -60.
[12] 宋雪莲,董然,赵和祥,等. 五种新品种多倍体萱草离体快繁技术研究[J].北方园艺,2011(7):127 -129.
[13] 杨丽莉,张晓,晋凡生,等. 激素对萱草组织培养参数的影响[J].山西农业科学,2012,40(8):815 -818.
[14] 时颂,李青,赵霜,等. 不同切花菊品种及处理对愈伤组织诱导和分化的影响[J].东北林业大学学报,2013,41(1):77 -81.
[15] 王汉海,程贯召,杜延飞.大花萱草新品种“金娃娃”的组织培养和快速繁殖[J]. 植物生理学通迅,2002,38(5):458 -460.
[16] 谭文澄,戴策刚.观赏植物组织培养技术[M]. 北京:中国林业出版社,1999.
