复合诱变选育细菌纤维素耐酸性高产菌株的研究
2014-03-04张银冰
张银冰
(广东轻工职业技术学院,广东广州510300)
复合诱变选育细菌纤维素耐酸性高产菌株的研究
张银冰*
(广东轻工职业技术学院,广东广州510300)
首先用紫外线对出发菌株的菌体进行诱变,然后再用硫酸二乙酯对突变株进行诱变,最后经筛选获得耐酸突变株。该突变株在pH值为3.1以下生长时,产纤维素水平为9.2 g/L,比突变株U31提高了12.2%,比出发菌株提高了31.43%。对突变株UE26进行传代和稳定性试验,结果表明该菌株具有遗传稳定性,适宜作为研究细菌纤维素的高产菌株。
复合诱变;细菌纤维素;紫外线;硫酸二乙酯
由细菌生产的纤维素称为细菌纤维素,也称微生物纤维素。细菌纤维素有许多独特的性质,如细菌纤维素是一种“纯纤维素”,具有高化学纯度和高结晶度;细菌纤维素的弹性模量为一般植物纤维的数倍至十倍以上,并且抗张强度高;细菌纤维素有很强的持水能力、有较高的生物适应性和良好的生物可降解性。因为细菌纤维素在纯度、吸水性、物力和机械性能等方面有着优良性能,所以人们十分重视它在各个领域的应用研究,尤其是在食品、新型伤口包扎材料、人造皮肤、声音振动膜、高强度纸、纺织纤维等领域,并在其他许多领域也显示出十分广泛的商业化应用潜力。
在细菌纤维素发酵生产中,为了获取片状成型的细菌纤维素凝胶膜,需进行浅盘静态发酵,而浅盘静态发酵的最大缺点是容易发生杂菌污染,急需解决。降低浅盘静态发酵的初始pH值,可有效地控制杂菌污染。但是,醋酸菌的最适pH值范围为5.4~6.3,当浅盘静态发酵的初始pH值降低至3.5以下时,不利于醋酸菌生成及细菌纤维素合成。因此,需选育耐酸性高产细菌纤维素的菌株,使其在初始pH3.5以下能够正常进行细菌纤维素发酵。
1 材料与方法
1.1 材料与主要仪器设备
木醋杆菌Acetobater xylinum YD0705,海南亿德食品有限公司提供;硫酸二乙酯,上海启迪化工有限公司;营养琼脂、椰子水、酵母膏、氯化氨、硫酸镁、磷酸二氢钾均为市购。
HWY211恒温震荡培养箱、干燥箱、紫外灯、恒温水浴箱、250 mL三角瓶、显微镜、试管(带塞)、血球计数板、培养皿、移液管、电子天平、灭菌锅、涂布棒、酒精灯、接种环、玻璃棒、烧杯、量筒、分馏装置、电炉、PH计、温度计、酒精计、胶头滴管、洗耳球、玻片、棉塞、胶塞、测微尺、锥形瓶、纱布、铁架台。
1.2 试验方法
1.2.1 培养基的配置
斜面培养基:椰子水400 mL,营养琼脂13.2 g,自然pH,分装试管中,121℃灭菌20 min。
富集培养基:椰子水300 mL,氯化氨1.2 g,硫酸镁0.15 g,磷酸二氢钾0.45 g,自然pH,分装2瓶,121℃灭菌20 min。
种子培养基:椰子水150mL,菠萝皮汁150mL,氯化氨1.2g,硫酸镁0.15 g,磷酸二氢钾0.45 g,自然pH,分装2瓶,121℃灭菌20 min。
发酵培养基:菠萝皮汁120 mL,酵母膏2 g,蔗糖15 g,氯化氨1.2 g,硫酸镁0.15 g,磷酸二氢钾0.45 g,pH4.5,分装2瓶,121℃灭菌20 min。
1.2.2 诱变流程
木醋杆菌→摇瓶培养→菌悬液制备→紫外线诱变→酸性平板初筛→发酵复筛→斜面→菌悬液制备→酸性二乙酯诱变→酸性平板初筛→发酵复筛→斜面→传代稳定性试验和菌种特征考察→菌种保藏。
1.2.3 斜面培养
斜面培养基接种后,30℃恒温培养3 d。
1.2.4 平板培养
平板培养基接种后,30℃恒温培养3 d。
1.2.5 摇瓶培养
将100 mL富集培养基装入250 mL三角瓶中,用8层纱布包扎瓶口,灭菌后冷却至30℃,接入菌种,恒温30℃、120℃转震荡培养16 h。
1.2.6 发酵
在无菌操作的环境下,将种子液摇匀倒进20 mL量筒(已经灭菌),然后迅速倒入装有100 mL培养基的锥形瓶中,然后在30℃恒温条件下培养7 d后收集纤维素。
1.2.7 菌悬液的制备
取1.2.5所得的培养液,于4 000 r/min离心10 min,弃去上清液,用无菌的pH7.0磷酸缓冲液离心洗涤菌体2次,再将菌体转入装有玻璃珠的无菌三角瓶中,以适量的pH7.0磷酸缓冲液与菌体混合,充分振荡,制成菌悬液,通过菌体计数,调节为106cfu/mL。
1.2.8 木醋杆菌菌悬液的紫外线诱变
诱变箱的紫外灯位15 W,照射距离为21 cm,波长253.7 nm,照射前开启紫外灯预热20 min,使紫外线强度稳定。取1.2.7制备的菌悬液放入带磁力搅拌棒的无菌培养皿中,每个培养皿20 mL,照射时间分别为:30 s、60 s、90 s、120 s、150 s。照射后,取0.1 mL涂布在培养基pH分别为7.0、6.5、6.0、5.5、5.0、4.5、4.0、3.5、3.0的平板30℃恒温培养24 h。以未经紫外线处理的菌悬液为对照,测定不同照射时间的致死率。以处理时间为横坐标,致死率为纵坐标,做致死曲线。
1.2.9 菌体的DES诱变
分别取20 mL的木醋杆菌的菌悬液置于6个250 mL的三角瓶中,添加硫酸二乙酯,使其体积浓度达到0.5%,然后在30℃,100 r/min分别处理1 min、2 min、3 min、4 min、5 min、6 min,振荡培养结束后立即加入质量浓度25%的硫代硫酸钠5 mL,以终止反应。然后将菌悬液稀释,稀释度分别为10-3、10-4、10-5,每个稀释度涂3个平板,以上操作均在红灯下进行,平板用黑布包好,在30℃培养48 h。以未加DES但经同样处理的作为对照组,以处理时间为横坐标,致死率为纵坐标,做致死曲线。
1.2.10 发酵初筛
从经过诱变的培养液中随机挑取15株单菌落转接到pH为3.5的斜面富集培养基上,再将活化后的菌种接种到盛有100 mL液体发酵培养基的250mL的三角瓶中,每株2瓶,30℃恒温培养7 d,至于摇床上发酵,选取高产斜面进行复筛。出发菌株同时进行发酵试验,以便比较。
1.2.11 发酵复筛
初筛后的诱变菌株和对照组一起,转入液体发酵培养基中进行复筛。比较其产量,挑出耐酸高产菌株。
1.2.12 稳定性试验
将选育所的突变株传代10次,测定这10次纤维素产量,确定诱变菌株产量是否稳定。只有纤维素产量稳定的诱变菌株才是试验得到的理想高产菌株。
1.2.13 致死率的测定
将诱变处理的菌悬液进行适当稀释,涂布平板,培养后进行菌落计数,以未经诱变处理的菌悬液做对照,计算致死率:
致死率=(1-诱变后活菌数/诱变前活菌数)×100%
1.2.14 纤维素产量的测定
细菌纤维素持水性极强,以湿重衡量其产量误差较大,需采用干纤维素绝对产量和干纤维素产出水平进行比较,干纤维素产出水平是每升培养液含油的干纤维素质量,其单位为g/L。测定方法为:取出浮在表面的细菌纤维素,用大量水冲洗,去除细菌纤维素表面的培养基等杂质,再将其浸泡于0.1 mol/L的NaOH溶液中,100℃煮沸20 min,去除残留在内部的菌体和培养基。然后,用蒸馏水洗涤、浸泡,使浸泡水pH值达到7.0~7.2,置于105℃干燥至恒重,称重可得纤维素干重。
2 结果与讨论
2.1 紫外线对菌悬液的诱变条件
菌悬液用紫外线诱变处理,不同时间下的致死率如图1所示。图1表明,紫外线照射时间越长,致死率越高;当紫外线照射时间为90 s时,致死率为78.2%。大量文献认为,较低致死率下进行诱变处理,其正突变率更高,目前倾向于选择致死率为70%~80%的诱变剂量,故本试验选择90s作为紫外线诱变时间。

图1 紫外诱变的致死曲线
2.2 紫外线对菌体的诱变结果
采用紫外线处理过的菌体诱变培养之后,采用酸性平板预筛,其耐酸情况如图2所示。
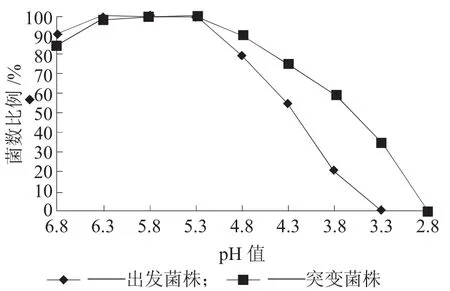
图2 出发菌株和突变菌株U在酸性平板上的分布
从图2可以看出,出发菌株和突变菌株在酸性平板上生长,其菌数随pH值的降低而减少。当平板培养基pH值低于3.3时,平板上几乎看不到出发菌株,而突变菌株在pH值低于2.8 h才不生长。因此,经过紫外诱变能够大幅度提高突变株的耐酸性。
通过将pH值为3.5的平板上的菌落采用富集培养基进行培养与观察,从中挑出菌落较大的80铢突变株,与出发菌株同时进行发酵试验,从中筛选出10株产纤维素较高的突变株,其产纤维素情况如图3所示。从图3可以看出,在pH值为3.5的富集培养基中进行发酵,由于出发菌株耐酸性能较差,其生长速度和产纤维素较低,产纤维素水平仅为7.1 g/L;而10株突变菌株的耐酸性能较强,产纤维素水平都高于出发菌株,其中突变株U31产纤维素水平最高,达到8.3 g/L,比出发菌株提高了16.9%,故选为进一步诱变处理的菌株。
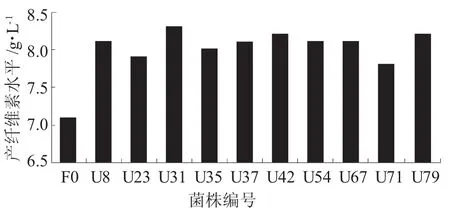
图3 出发株与突变株U在发酵实验中的产纤维素水平
2.3 DES对菌体的诱变条件
以突变株U6制备菌悬液,然后采用DES诱变处理,不同时间下的致死率如图4所示。图4表明,体积浓度0.5%硫酸二乙酯对菌体有致死作用,且处理时间越长,致死率越高。目前倾向于选择致死率为70%~80%的诱变剂量。在本试验中,处理时间为3 min时致死率为79%,故选为诱变时间,有利于获得更高的正突变率。
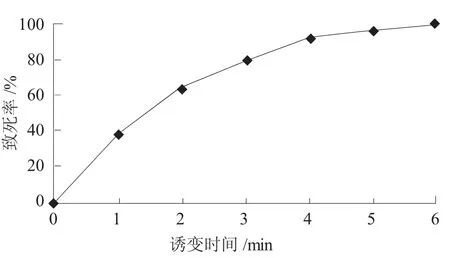
图4 DES诱变致死曲线
2.4 DES对菌体的诱变结果
采用DES处理过的突变株U6经过诱变后培养之后,采用酸性平板预筛,其耐酸情况如图5所示。

图5 突变株U与突变株E在酸性平板上的分布
从图5可以看出,经DES诱变后,可进一步提高菌株的耐酸性能,所得突变株E在酸性平板上的生长情况比突变株U6更好。通过将PH值为3.1的酸性平板上的菌落用富集培养基进行培养和观察,从平板上挑出菌落较大的80株突变株,与出发菌株F0和突变株U31同时进行发酵试验。从中筛选出10株产纤维素较高的突变株,其产纤维素情况如图6所示。
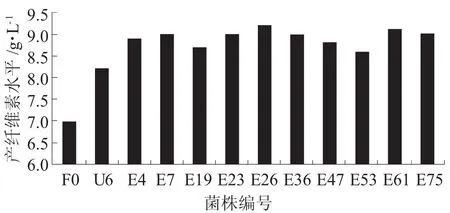
图6 出发株、突变株U与突变株E的产纤维素水平
从图6可以看出,在pH值为3.1的富集培养基中进行发酵,由于出发菌株耐酸性能较差,其生长速度和产纤维素略有下降,产纤维素水平仅为7.0 g/L;而10株突变菌株的耐酸性能较强,产纤维素水平都高于出发菌株和突变株U31,其中突变株E26产纤维素水平最高,达到9.2 g/L,比突变株U提高了12.2%,故选为进一步试验的菌株。
2.5 突变株的遗传稳定性
将筛选所得的突变株UE26在传代10次,每代都在每代都在pH值为3.1以下的培养基中进行发酵试验,其发酵产纤维素水平稳定,可作为发酵生产试验菌株。
3 结论
本研究结果表明,采用传统的紫外诱变育种方法选育细菌维素高产菌株是很有效的方法,经紫外诱变得到的突变株可在pH值为3.5以下生长,该突变株产纤维素水平比出发菌株F0提高了16.9%。在紫外诱变的基础上,利用硫酸二乙酯进行复合诱变,可进一步提高产纤维素水平,比突变株E31提高了12.2%;比出发菌株提高了31.43%,传代和稳定性良好,适宜作为研究细菌纤维素的高产菌株。为了应用于生产,还需进一步对该菌株进行发酵培养基以及发酵工艺的优化试验。
[1]潘颖,朱平.细菌纤维素的理化特性及其应用开发[J].合成纤维,2007(9):6-10.
[2]马承铸.生物有机纳米材料-细菌纤维素[J].精细与专用化学品,2001(18):14-16.
[3]KRYSTYNOWICZ A,CZAJA W,WIKTOROWSKA JEZIERSKA A,et al.Factors affecting the yield and properties of bacterial cellulose[J].Journal of Industrial microbiology&Biotechnology,2002,29(4):189-195.
[4]刘四新,李枚秋,方仲根.椰子纳塔发酵条件研究[J].食品与发酵工业,1999,25(l):36-39.
[5]KENJI T,MASASHI F,JISUKE H.Synthesis of Acetobacter xylinum bacterial cellulose composite and its meth strength and biodegradability[J].Mokuzai Gakkaishi,1995,41(8):749-757.
[6]张继东.木醋杆菌发酵产细菌纤维素的研究[D].南京:南京理工大学,2004:1-46.
[7]东秀珠,蔡妙英等.常见细菌系统鉴定手册[M].第一版.北京:科学出版社,2001.
[8]施巧琴.工业微生物育种学[M].北京:科学出版社,2004.
[9]蒋咏梅,章文贤,施巧琴,等.豆凝乳酶产生菌的筛选及诱变育种[J].福建师范大学学报:自然科学版,2000.16(1):89-93.
Study on the selection ofhigh-yield and acid resistance by complex mutation ofbacterialcellulose
ZHANGYin-bing
(Guangdong industry technical college,Guangdong Guangzhou 510300,China)
The initial mutant population was generated bydiethyl sulfate(DES)treat,and then the protoplast ofmutant was subjected to the ultraviolet radiation,finally,an improved population with acid resistance was successfully screened.Its maximum acid resistance pH was 3.1,the maximal cellulose was reached 9.2 g/L,compared mutant U31 improved by12.2%,there were an 31.43%increase on the base ofthe existing strains.The mutations UE26 batches and stabilitytest,the results showthat the strain has the genetic stability,suitable as high-yield strains ofbacterial cellulose.
complex mutation;bacterial cellulose;ultraviolet;ethyl sulfate
TS261.1+3
A
1673-6044(2014)02-0042-04
10.3969/j.issn.1673-6044.2014.02.015
*张银冰,女,1979年出生,2009年毕业于华南理工大学生物工程专业,讲师。
2014-03-21
