牙膏磨擦剂二氧化硅制备条件的优化
2014-03-04苏二强高春苹董晋湘
苏二强,高春苹,董晋湘
(太原理工大学精细化工研究所,山西 太原 030024)
牙膏对于人们日常的口腔卫生的护理来说是必不可少的。牙膏是由磨擦剂、湿润剂、表面活性剂、黏合剂、香料、甜味剂及其他功能组分(如抗龋齿成分、抗敏感成分等)构成的。其中,牙膏磨擦剂能够通过祛除因日常饮食而积聚的噬菌斑,从而达到预防牙龈疾病的效果。并且,牙膏磨擦剂还能有效清除牙齿上的污渍,使牙齿更加洁白[1-2]。
常用的牙膏磨擦剂包括:碳酸盐类、磷酸盐类、二氧化硅类和其他类(包含氧化铝、黏土等)。SiO2作为牙膏磨擦剂具有以下几个优点:一是在牙膏体系中SiO2展现出化学惰性,只吸收很少量的功能组分,使得其与牙膏体系中其他组成物相容性非常良好;二是在以NaF或者Na2PO3F为氟源的牙膏体系中,SiO2表现出良好的化学惰性,使得氟离子具有很强的生物活性,可以更加有效的防止龋齿;三是SiO2是唯一在牙膏中可做透明基质的磨料。这些特点使得其在牙膏磨料中使用量越来越大[2-3]。
工业上生产牙膏用二氧化硅一般是以硅酸钠和硫酸为原料采用沉淀法合成SiO2,其主要过程可以简单的划分为:形成初级颗粒阶段、聚合直至凝胶阶段以及破碎重组压缩阶段。所形成的凝胶的特性(如初级颗粒尺寸、聚合度以及初级颗粒间的相互作用)与所合成SiO2的性能密切相关,而所形成的凝胶的特性与反应条件又密切相关[4]。但是,却很少有人报道比较细致的合成规律对 SiO2性能的影响;再者,在反应过程中,添加电解质以及添加不同种类的电解质对产品会带来哪些影响,也没有人做过相对系统的研究。
因此,基于这两点,作者首先研究了硅酸钠浓度、合成温度以及陈化时间对SiO2性能的影响;之后,在此基础上,选取Na2SO4、NaCl两种电解质,考察了两种电解质以及不同浓度下的电解质对产品性能的影响。
1 实验过程及表征
1.1 实验过程
1.1.1 原料
液体硅酸钠,n(SiO2)/n(Na2O)=3.3,山东青岛泡花碱有限公司;硫酸,质量分数98%;Na2SO4,质量分数≥99%,国营上海试剂厂;NaCl,质量分数≥99.5%,国药集团化学试剂有限公司。
1.1.2 仪器设备
烧杯、搅拌装置、恒温水浴、减压抽滤装置以及恒温干燥箱。
1.1.3 制备工艺流程
二氧化硅制备流程见图1。
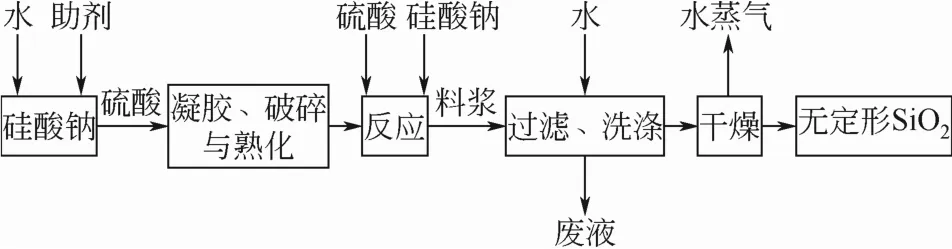
图1 沉淀法制备二氧化硅工艺流程图
1.1.4 反应过程
(1)釜底液配制 向反应器内加入定量的特定浓度的硅酸钠溶液以及电解质(Na2SO4或者NaCl),之后搅拌均匀。然后,在持续搅拌的条件下,将混合液升温至 65~95℃。待釜底液达到预定的温度后,以一定流速向反应器内添加浓度c硫酸=1.23mol/L的硫酸溶液,直至混合液出现凝胶。随后,停止添加硫酸溶液,在持续搅拌的条件下,熟化30min。
(2)添加物料 将硅酸钠溶液(浓度 c硅酸钠= 0.70mol/L)和硫酸溶液(浓度c硫酸=1.23mol/L)以反应式配比分别以一定流速同时添加到反应器内,在持续搅拌下反应 40~90m in,在此过程中保持反应釜内温度、pH值恒定不变。
(3)酸化和陈化 停止添加硅酸钠溶液之后,继续向反应釜内添加硫酸溶液,直至混合液的 pH值为2~4,保持温度,持续搅拌30m in。
(4)过滤洗涤 将反应后的料浆放入离心机中过滤、脱水,再用水洗涤直至脱除液pH值在7左右。
(5)干燥 洗涤之后,为了保持二氧化硅的结构,滤饼应该快速干燥去除水分。因此,干燥时滤饼层应较薄为宜,干燥时间30~60min。
(6)粉碎 使用球磨机进行粉碎,粉碎时间为6h。
1.2 表征方法
用紫外可见分光光度计(上海精密科学仪器有限公司 UV765)测试样品的透光率。用X射线衍射仪(日本理学公司M iniflex Ⅱ)测试样品的XRD。用傅里叶变换红外光谱仪(日本岛津公司IRA ffinity-1)测试样品的红外光谱图。用电子显微镜(日本日立公司 TM 3000)观察样品的形貌。样品的105℃挥发物、pH值、吸油值、折光率以及表观密度等指标按照QB/T 2346—2007进行表征。用过硬颗粒测定仪(北京中西远大科技有限公司,M 31/192564)测试样品中所含过硬颗粒。经过105℃恒温脱水处理1h后,用重量法测试样品中的SiO2含量。
2 结果与讨论
合成 SiO2的反应过程可以简单的分为形成低聚物、达到临界凝胶浓度、形成凝胶以及机械破碎重组四步。简而言之,硅酸单体(H4SiO4)通过缩合形成低聚物;低聚物通过再进一步直至达到临界凝胶浓度;达到临界凝胶浓度之后,聚合物之间进一步缩合从而形成凝胶状物质;随后,再通过外在机械力的破坏,使得形成的凝胶破碎,破碎的凝胶再进一步重组压缩形成胶体碎片。所形成的凝胶的特征对最终合成的SiO2的性能影响很大。而形成的凝胶与反应条件密切相关[4]。因此,我们通过改变釜底液硅酸钠浓度、合成温度、陈化时间以及添加电解质这些反应条件,研究这些反应条件对 SiO2性能的影响。
2.1 硅酸钠浓度的影响
釜底液中硅酸钠的浓度对凝胶速率、凝胶程度以及最终SiO2的平均粒径都有较大影响[5]。因此,在添加物料浓度c硅酸钠=0.70mol/L、c硫酸=1.23mol/L的条件下,保持合成温度为85℃,熟化时间30min,陈化时间为 30min,仅改变釜底液中硅酸钠溶液浓度,研究了合成规律。以表观密度和透光率对合成样品进行了特性测试,其结果如图2所示。
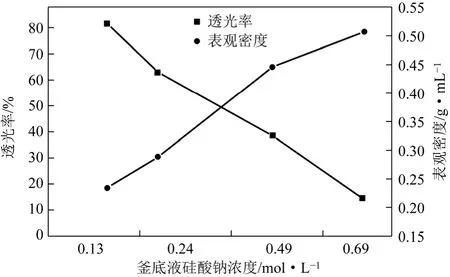
图2 改变釜底液硅酸钠浓度对SiO2性能的影响
从图2可以看出,随着釜底液中硅酸钠浓度的增大,表观密度也随之增大。在釜底液硅酸钠浓度为0.13mol/L时,表观密度为0.235g/m L;而在浓度为0.69mol/L时,表观密度已经达到0.507g/m L,比浓度为0.13mol/L时的表观密度增加一倍还多,由此可见,釜底液硅酸钠浓度对最终SiO2的表观密度影响很大。相反地,透光率却随着釜底液中硅酸钠浓度的增大而急剧降低,当釜底液硅酸钠浓度为0.69mol/L时,透光率仅仅能达到蒸馏水的14.05%;而在浓度为0.13mol/L时,透光率能达到81.37%。这可能与表观密度有一定的关联,表观密度较大时,在山梨醇水溶液中的分散性就不够良好,从而导致了透光率的下降。所以,当釜底液硅酸钠浓度c=0.13mol/L时,所合成的SiO2具有较为良好的透光率和较低的表观密度。
2.2 合成温度的影响
从2.1节可以看出在釜底液硅酸钠浓度较低的情况下,合成的样品的透光率比较好并且表观密度也相对较低。因此,在此基础上,在添加物料浓度c硅酸钠=0.70mol/L、c硫酸=1.23mol/L 的条件下,保持釜底液c硅酸钠=0.13mol/L,熟化时间30min,陈化时间为 30m in,仅改变合成温度,研究了合成规律。以表观密度和透光率对合成样品进行了特性测试,其结果如图3所示。
从图3可以看出,随着温度的增加,表观密度有一定增加,与增加釜底液硅酸钠浓度相比其增加的幅度并不十分明显;随着温度的降低,所制得的SiO2的透光率有了一定幅度的提高,从初始95℃的79%增加到65℃的89%。可见,降低合成温度有利于样品表观密度的降低以及透光率的提高。但是如果合成温度过低,所形成的凝胶状物质无法得到有效均匀的破碎而形成均一黏稠状液体,并且会增加反应时间对整个合成工艺来说也是不利的。
2.3 陈化时间的影响
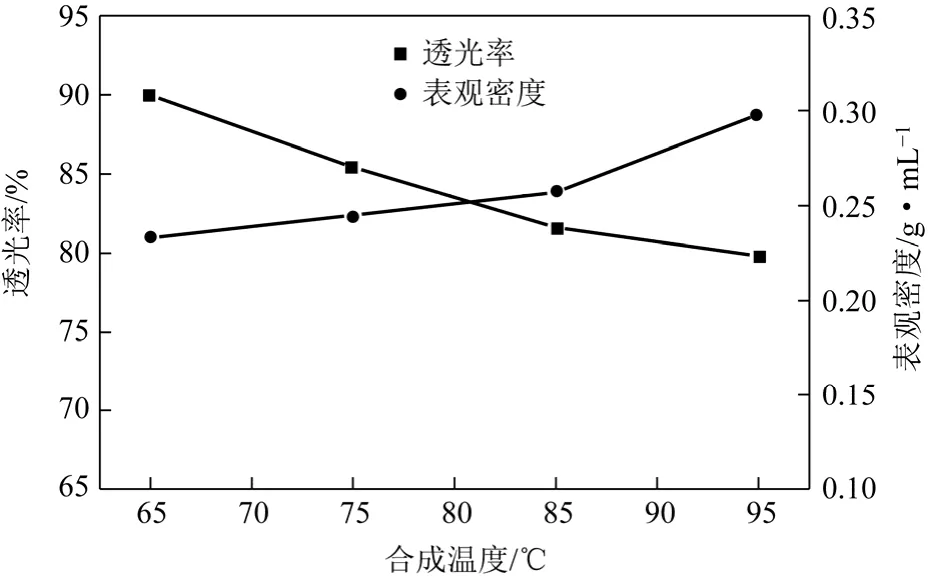
图3 合成温度对SiO2性能的影响
从2.2节可以看出,在合成温度为65℃、釜底液硅酸钠浓度为0.13mol/L时,所合成的样品的性能较为良好。因此,在添加物料浓度 c硅酸钠= 0.70mol/L、c硫酸=1.23mol/L 的条件下,保持合成温度为 65℃,釜底液 c硅酸钠=0.13mol/L,熟化时间30m in,仅改变陈化时间,研究了合成规律。以表观密度和透光率对合成样品进行了特性测试,其结果如图4所示。
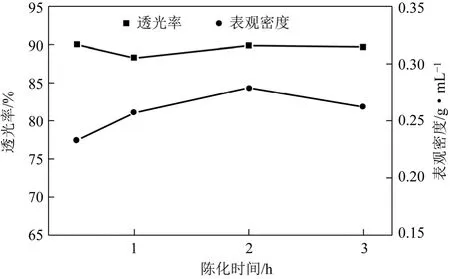
图4 陈化时间对SiO2性能的影响
从图4可以看出,表观密度随着陈化时间的增加,有一定增加,但并不是特别的明显,表观密度都在0.22~0.28g/m L;透光率也没有大的变化,都在87%~90%。由此可见,陈化时间对样品的透光率的影响并不明显。
根据前面所做的数据,可以总结出:随着釜底液浓度的减小,样品的透光率随之增大;随着温度的降低,透光率也有一定的提高,但是如果合成温度过低,所形成的凝胶状物质不能够破碎成黏稠状液体,无法进一步反应;增加陈化时间,对样品的表观密度和透光率基本上没有影响。
2.4 添加电解质的影响
在2.1~2.3节对影响样品SiO2性能的因素做了基本研究,得出在合成温度为65℃下,釜底液硅酸钠浓度0.13mol/L的条件下,合成的样品的性能较为良好。为了进一步改善提高SiO2的性能,研究了在釜底液中添加电解质对产品性能的影响。对于所添加的电解质,特别选取Na2SO4、NaCl两种电解质作为釜底液的添加剂。选取 Na2SO4的原因是:Na2SO4是反应产物的副产物,可以利用产物降低原料成本,再者可以不引入新的离子;选取 NaCl的原因是:NaCl是强电解质,只引入一种新的阴离子,并且其价格也相对低廉。
因此,在添加物料浓度c硅酸钠=0.70mol/L、c硫酸= 1.23mol/L 的条件下,保持合成温度为65℃,釜底液c硅酸钠=0.13mol/L,熟化时间30m in,陈化时间为30m in,仅改变添加电解质浓度研究了合成规律。以表观密度和透光率对合成样品进行了特性测试,其结果如图5所示。
从图5可以看出,在65℃合成条件下合成的样品,其透光率都在88%~90%,添加电解质后并没有使 SiO2的透光率得到提升,同时也没有使其降低。可见,在 65℃条件下添加电解质对SiO2的透光率基本上没有影响。
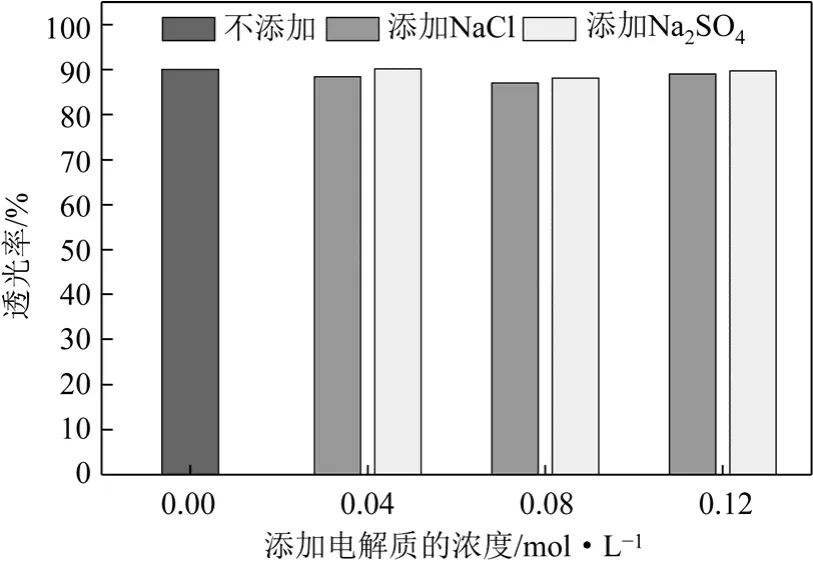
图5 在65℃合成条件下的SiO2的透光率的对比
实验结果并没有达到实验预期目的。进一步的分析认为,可能是由于合成温度偏低,所添加阴离子的作用没有得到发挥。因此,在添加物料浓度c硅酸钠=0.70mol/L、c硫酸=1.23mol/L的条件下,保持合成温度为 85℃,釜底液 c硅酸钠=0.13mol/L,熟化时间为 30min,陈化时间为 30min,仅改变添加电解质浓度研究了合成规律。以表观密度和透光率对合成样品进行了特性测试,其结果如图6所示。
从图6可以看出,在85℃合成条件下,无论是添加NaCl,还是Na2SO4,所制得的SiO2的透光率都得到不错的改善。就添加 NaCl而言,在所添加0.04~0.12mol/L内,SiO2的透光率都达到了92%以上。就添加Na2SO4而言,在所添加0.04~0.12mol/L内,二氧化硅的透光率都达到了84%以上。在浓度为0.08mol/L时,透光率达到97%,随后又稍有降低。在添加浓度为0.04~0.12mol/L的范围内,添加NaCl所制得的样品的透光率提高的幅度更高,更加稳定。
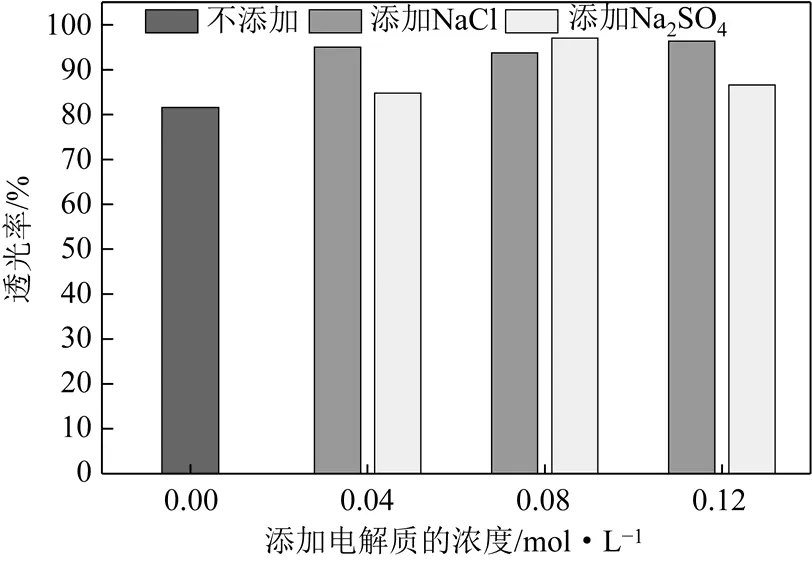
图6 在85℃合成条件下的SiO2的透光率的对比
在65℃与85℃合成条件下的SiO2的透光率的相比:在65℃下的样品,在添加电解质前后基本上没有差别;在85℃下的样品,在添加电解质之后,都有一定的提高。造成这种现象的原因可能是:在相对高的温度下,电解质能够更加有效的参与到硅酸的聚合中,并对产品SiO2产生较为良好的改善。
与透光率相比,在 65℃与 85℃合成条件下的SiO2的表观密度基本上没有大的差别,它们的表观密度都在0.23~0.31g/m L。
2.5 基本性能
为了进一步研究添加电解质对合成样品基本性能的影响,结合2.1~2.4中的研究结果,特别选取表1中所示6个样品,并且分别命名为样品1~样品6。
2.5.1 样品的鉴定
图7为两组6个样品的 XRD 图,对样品进行XRD分析的主要目的是表征样品是否为晶体。从图中可以看出,各样品均为无定形物质。
图8为两组6个样品的红外光谱图,对样品进行红外分析的主要目的是考察样品中主要的官能团。由图可见,其红外光谱图与文献报道一致[6]。由此,可以推断样品的主要成分是SiO2·n H2O。
2.5.2 样品的形貌
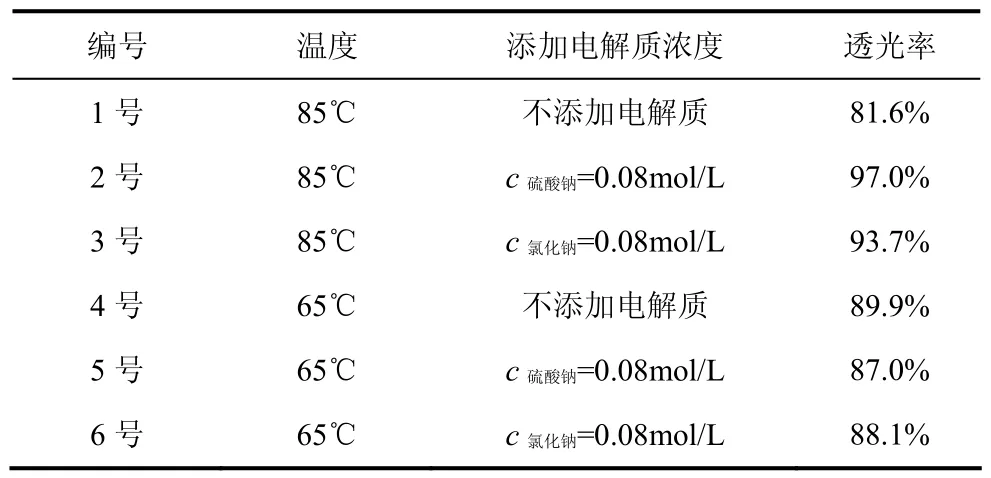
表1 所选样品及其编号
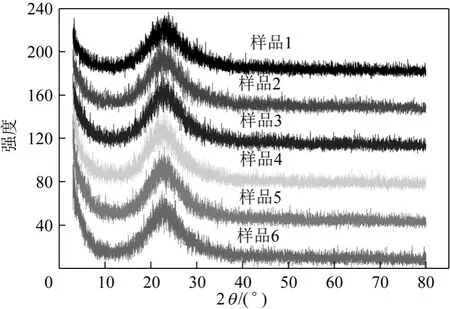
图7 样品XRD对比图
图9为6个样品的电镜图,对样品进行电镜分析的主要目的是考察样品的形貌。从图9中可以看出:6个样品均为无定形状,都没有过大的颗粒,并且粒径都在15μm以下。
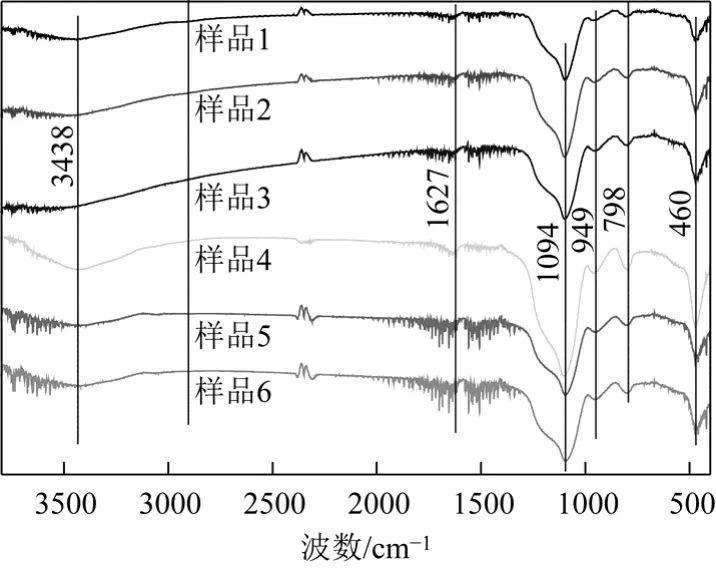
图8 样品红外对比图
2.5.3 样品性能的测定
从表2可以看出,6个样品的SiO2含量、105℃挥发物、pH值、吸油值以及折光率之间相差不大,都符合QB/T 2346—2007,可以用作牙膏磨擦剂。
2.5.4 样品的磨擦性能测试
将6个样品按照表3膏体配方依次复配为膏体1~膏体6后,使用过硬颗粒测定仪按照GB 8372—2008中的玻片划痕法测试。测试后,其结果如表4所示。
从表4可以看出,6个膏体所测试的玻片上均没有划痕,所以6个样品中均不含过硬颗粒。
3 结 论
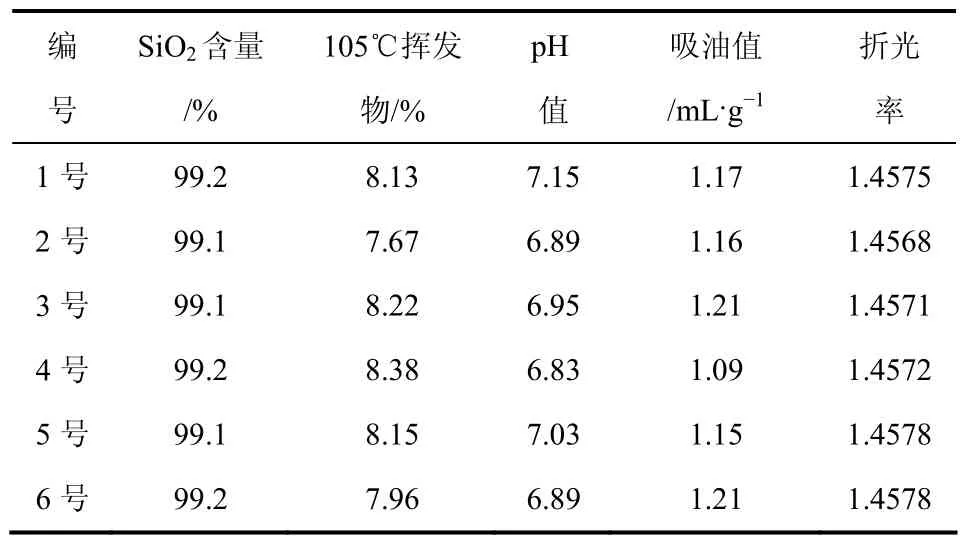
表2 6个样品的性能对比
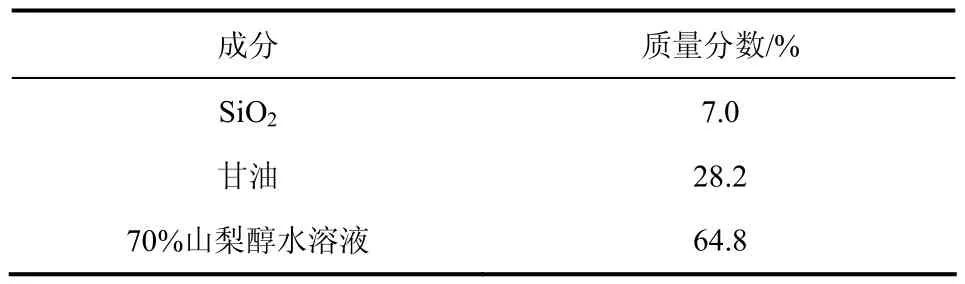
表3 膏体配方[7]
(1)影响SiO2性能的基本因素:随着釜底液水玻璃浓度的减小,样品的透光率随之增大,表观密度却相应的降低;随着反应合成温度的降低,透光率会有一定的提高,但如果温度过低,所形成的凝胶状物质无法进一步破碎成黏稠状液体,无法进一步反应;增加陈化时间,对样品的表观密度和透光率基本上没有影响。

图9 2000倍下样品的电镜对比图

表4 玻片划痕法测试结果
(2)在 65℃条件下,在釜底液中添加电解质NaCl或者Na2SO4后,所制得的SiO2的透光率基本上没有大的变化;而在85℃条件下,在釜底液中添加电解质NaCl或者Na2SO4后,所制得的SiO2的透光率得到了一定的提高。
(3)所合成的样品均为无定形 SiO2,可以用作牙膏磨擦剂。
[1] Lippert F.An introduction to toothpaste-its purpose,history and ingredients[J].Monogr.Oral Sci.Basel,Karger,2013,23:1-14.
[2] Stamm J W.Multi-function toothpastes for better oral health:A behavioural perspective[J].International Dental Journal,2007,57(s5):351-363.
[3] Hattab F N.The state of fluorides in toothpastes[J].Journal of Dentistry,1989,17(2):47-54.
[4] Schlomach J,Kind M.Investigations on the sem i-batch precipitation of silica[J].Journal of Colloid and Interface Science,2004,277(2):316-326.
[5] Bałdyga J,Jasińska M,Jodko K,et al.Precipitation of amorphous colloidal silica from aqueous solutions——Aggregation problem[J].Chemical Engineering Science,2012,77:207-216.
[6] 陈和生,孙振亚,邵景昌.八种不同来源二氧化硅的红外光谱特征研究[J].硅酸盐通报,2011,30(4):934-937.
[7] A ldcroft D,New ton J R,Quinn J P,et al.Silicas:US,4956167[P].1989-03-22.
