基于果糖与葡萄糖不同混合比例的丙酮丁醇发酵
2014-03-04吴又多付友思齐高相陈丽杰白凤武
吴又多,付友思,齐高相,陈丽杰,白凤武,2
(1 大连理工大学生命科学与技术学院,辽宁 大连 116024;2 上海交通大学生命科学技术学院,上海 200240)
能源是推动社会经济可持续发展的关键,随着传统石油资源的逐渐枯竭以及原油价格的不断上涨,探索新型可再生能源已成为当前生物质能源领域的研究热点[1-3],丁醇作为新一代可再生生物燃料极具发展潜力[4-6]。传统丁醇发酵工艺主要以粮食作物玉米或糖蜜作为原料,生产成本超过总成本的60%,较低的经济适用性及丁醇产量严重制约了其工业发展[7-8],亟待来源更为丰富且更为廉价的非粮生物质原料,并优化发酵条件[9-13],以期建立经济型生物丁醇发酵制造工艺[1,7,14-15]。
果聚糖作为自然界中含量较为丰富的碳水化合物资源之一,广泛存在于菊芋、菊苣、大丽花等植物中。其中,菊芋是近年来广为利用的一种廉价非粮生物质物料,富含果糖资源且具有较高的生物质产量[16-17],具有明显的作物抗逆特性,其块茎水解液中葡萄糖与果糖成分比例接近1∶4。事实上,果糖基物料用于丁醇发酵的研究报道相对较少,Marchal等[18]利用 Clostridium acetobutylicum IFP904发酵经菊粉酶水解过的菊粉,丙酮和丁醇的总溶剂产量达到 23~24g/L。陈丽杰等[19]利用 C.acetobutylicum L7发酵菊芋水解液,丁醇浓度达到了11.21g/L。这主要是因为在以葡萄糖及果糖混合体系为底物模拟菊芋物料进行的丁醇发酵中,存在着果糖利用率较低及丁醇代谢合成能力不足等关键问题[20]。本文对基于果糖与葡萄糖不同混合比例的丁醇发酵性能进行了研究,结果表明二者混合比例能够影响果糖利用能力,为探究葡萄糖与果糖的代谢利用提供了重要的实验依据,也为果糖基物料的高效生物转化生产丁醇提供重要的理论参考及技术支持。
1 材料与方法
1.1 菌种
所使用菌株系本实验室驯化保存的丙酮丁醇梭状芽孢杆菌C.acetobutulicum L7。
1.2 方法
1.2.1 培养基
活化培养基[21](g/L):葡萄糖 20, 胰蛋白胨30, 酵母粉 10。
种子培养基(g/L):混合糖(果糖与葡萄糖)55,乙酸铵 2.76,K2HPO40.5,KH2PO40.5,MgSO4·7H2O 0.2,MnSO4·H2O 0.01,FeSO4·7H2O 0.01,对氨基苯甲酸0.01,生物素0.01,酵母粉2。
发酵培养基[22](g/L):混合糖(果糖与葡萄糖)55,乙酸铵 2.76,K2HPO40.5,KH2PO40.5,MgSO4·7H2O 0.2,MnSO4·H2O 0.01,FeSO4·7H2O 0.01,对氨基苯甲酸0.01,生物素0.01,酵母粉2。
葡萄糖及果糖混合比例依次由1∶2、2∶3、3∶2提高至3∶1,上述培养基接种前均在121℃蒸汽灭菌15min。
1.2.2 培养方法
菌种活化培养:活化培养基预先置于厌氧操作箱(Thermo Scientific,Forma Anaerobic System)过夜除氧,将冷冻保藏的菌种温育后以 5%(体积分数,下同)接种量接种于20m L活化培养基中,自然初始pH值,37.5℃厌氧培养18~20h。
种子扩大培养:种子培养基预先置于厌氧操作箱过夜除氧,将充分活化的菌种以10%)接种量接种于100m L种子培养基中,自然初始pH值,37.5℃厌氧培养18~20h。
发酵培养:预先向发酵罐(1.5BG-4-3000,Shanghai Baoxing Engineering,China)通入无菌高纯N2至15min,以保证其厌氧发酵体系,将扩大培养的菌种以10%接种量接种于1.1L发酵培养基中,在37.5℃,150r/min,初始pH值5.5条件下进行发酵。
1.2.3 分析方法
生物量测定,取200µL发酵液,在酶标仪上测定其在 620nm 处吸光度(OD620),菌体浓度= 0.8009×OD620g/L;葡萄糖浓度采用葡萄糖分析仪(Biosensor SBA-50,Institute of Biology,Shandong Academy of Sciences,Shandong,China)进行定量测定,总还原糖浓度测定采用DNS法[23]进行测定,果糖浓度即为总还原糖浓度与葡萄糖浓度之差;发酵液中丙酮、乙醇及丁醇组分浓度采用气相色谱(Agilent 6890A GC)进行定量测定,色谱分离条件:毛细管色谱柱Agilent HP-INNOWAX (30m×0.25mm×0.50µm),柱温100℃,进样口温度250℃,FID 检测器温度300℃,H2流速40m L/min,空气流速400m L/min,载气N2流速 30m L/m in,进样量0.2µL,分流比 50∶1,内标物为异丁醇。发酵液中乙酸和丁酸组分浓度采用高效液相色谱(Waters 1525 HPLC)进行定量测定,色谱分离条件:有机酸分析柱 Aminex HPX-87H (300mm×7.8mm;Bio-Rad,Hercules),流动相0.005 mol/L H2SO4,流速0.5m L/min,进样量20µL,柱温50℃,检测波长 210nm,示差折光检测器温度 50℃。色谱柱:Am inex HPX-87H 有机酸分析柱(300 mm×7.8mm,Bio-Rad,Hercules),流动相0.005mol/L H2SO4,流速0.5m L/m in,进样量20µL,柱温50℃,检测波长210nm,二极管矩阵检测器温度50℃。
2 结果与讨论
2.1 果糖与葡萄糖不同混合比例下的丁醇发酵
前期研究工作分别以55g/L不同底物(葡萄糖、果糖、混合糖及菊芋水解液)进行了批次丁醇发酵,发酵结果如表1所示。以单一葡萄糖为底物的丁醇发酵周期最短,丁醇产量最高达到了11.2g/L,丁醇及总溶剂产率分别为0.255g/(L·h)与0.427g/(L·h),转化率分别达到了0.204g/g与0.342g/g,而以单一果糖为底物的丁醇发酵周期长达124h,发酵效率相对较低,丁醇及总溶剂产率分别为 0.083g/(L·h)与0.133g/(L·h),转化率分别为0.188g/g与0.300g/g,表明丙酮丁醇梭菌对果糖代谢速率较低,但发酵终点丁醇产量仍可达到10.3g/L。然而在以混合糖(葡萄糖∶果糖=1∶4)模拟菊芋物料为底物的丁醇发酵中,尽管发酵周期缩短至 76h,但终点果糖残余浓度高达 23.3g/L,丁醇与总溶剂产量仅为 5.5g/L及9.0g/L,糖转化率及溶剂产率极低,且发酵过程中菌体代谢利用果糖能力不足,严重制约了发酵效率,而这一结果同以菊芋水解液为底物的丁醇发酵结果极其相似。因此探究果糖与葡萄糖二者混合比例对丁醇发酵性能的影响,有效降低发酵终点残糖浓度,提高果糖利用率,为菊芋实际物料的高效利用具有非常重要的科研及现实意义。
2.1.1 葡萄糖与果糖混合比例为1∶2的丁醇发酵
当葡萄糖与果糖混合比例为 1∶2时,如图1所示,发酵周期为 68h,相对于混合糖模拟菊芋物料发酵过程缩短了8h,发酵终点丁醇及总溶剂产量达到了 9.7g/L与 16.0g/L,分别提高了 76.4%与 77.8%,终点残糖浓度仅为 2.1g/L,有机酸浓度为5.6g/L且在发酵中后期无明显重吸收过程。发酵至24h葡萄糖消耗殆尽,而果糖发酵至12h开始进行代谢利用,前期葡萄糖阻遏效应较为明显,而伴随着葡萄糖进一步消耗,果糖可被缓慢协同利用。菌体达到最大浓度OD620为2.4,随后菌体浓度OD620开始出现短暂下降。发酵28~44h果糖代谢与溶剂代谢近乎停滞,而发酵至56h左右,菌体细胞呈现出明显的二次生长状态,表明菌体代谢活性得到恢复,此后果糖得到迅速利用,相应的菌体浓度OD620再次回升至2.4,与此同时,丁醇等主要溶剂开始迅速积累。以上实验结果表明,适当提高葡萄糖/果糖比例能够保证发酵后期菌体细胞的代谢活性,进而有利于对果糖的代谢利用,有效降低发酵终点果糖浓度,丁醇等溶剂代谢合成得以顺利进行。
2.1.2 葡萄糖与果糖混合比例为2∶3的丁醇发酵
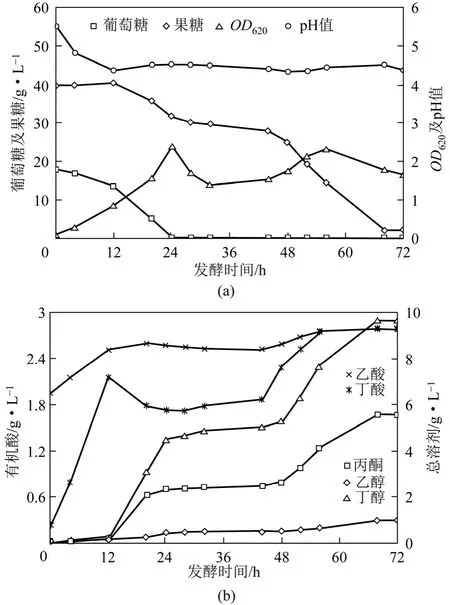
图1 葡萄糖与果糖混合比例为1∶2的丁醇发酵
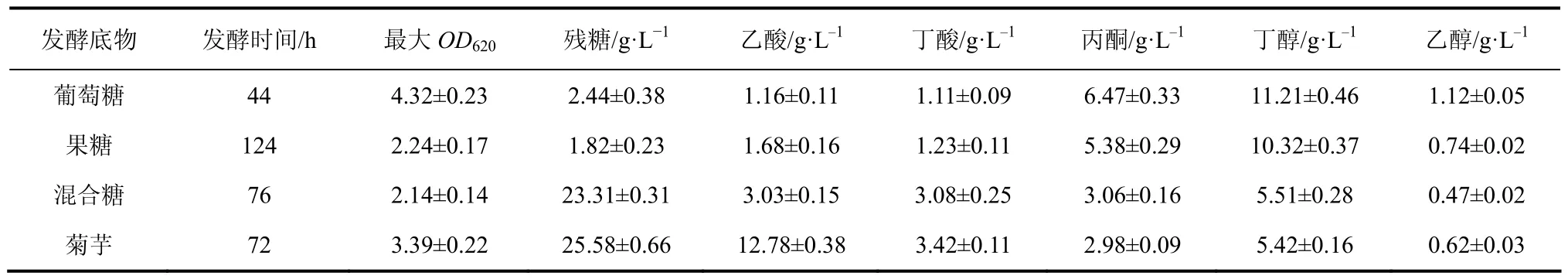
表1 不同发酵底物条件下的丙酮丁醇发酵结果
当葡萄糖与果糖混合比例提高至2∶3时,发酵至28h时葡萄糖消耗殆尽,而发酵至16h时果糖代谢利用开始缓慢进行,此时菌体浓度最大OD620提高至3.5,发酵周期缩短至52h,丁醇及总溶剂产量有所下降,分别为 8.0g/L与 12.4g/L,此外,发酵终点有机酸浓度较高,见图2。值得注意的是,发酵至32h左右时进入了短暂的二次生长状态,但果糖代谢利用活性依然较低,发酵终点果糖浓度高达14.7g/L。以上实验结果表明,进一步提高葡萄糖/果糖比例至2∶3后,菌体细胞活性虽然有所恢复,但对果糖的代谢利用能力仍显不足。
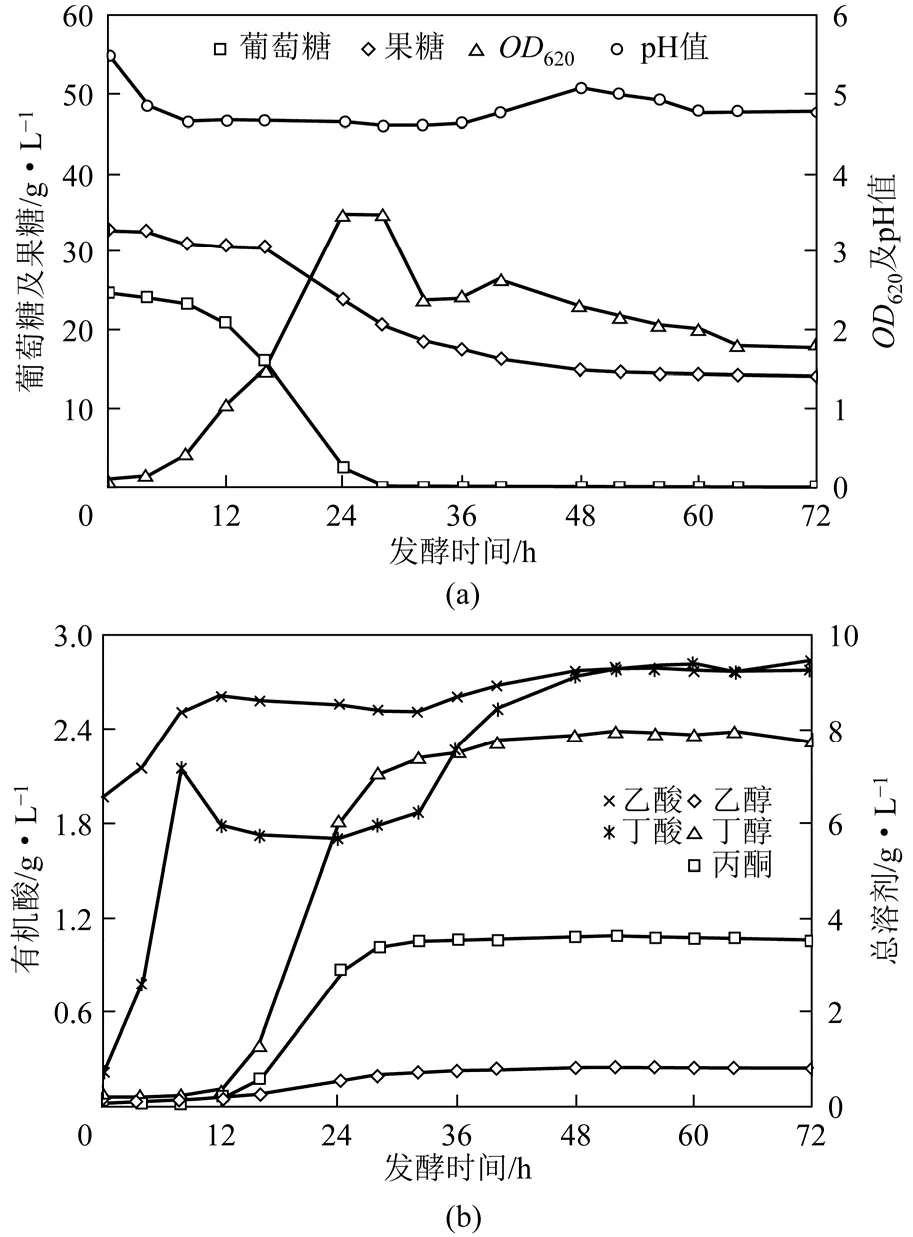
图2 葡萄糖与果糖混合比例为2∶3的丁醇发酵
2.1.3 葡萄糖与果糖混合比例为3∶2的丁醇发酵
当底物糖中葡萄糖比例进一步提高,发酵周期再次缩短至48h,至24h葡萄糖消耗殆尽,而果糖代谢依然从发酵至16h开始,此前同样出现了明显的葡萄糖阻遏效应。在此过程中菌体达到最大OD620为4.2,随后快速下降直至发酵终点,发酵后期过程中并未出现二次生长状态。最终丁醇及总溶剂产量分别达到 9.0g/L及 15.0g/L,残糖浓度下降至 7.9g/L,但果糖利用率有所降低,见图3。此外有机酸浓度降至2.9g/L,而发酵过程中有机酸含量亦有所下降,说明进一步提高葡萄糖/果糖比例至3∶2一定程度上缓解了有机酸积累现象,但对于发酵中后期果糖的代谢利用活性并没有有效提高。
2.1.4 葡萄糖与果糖混合比例为3∶1的丁醇发酵
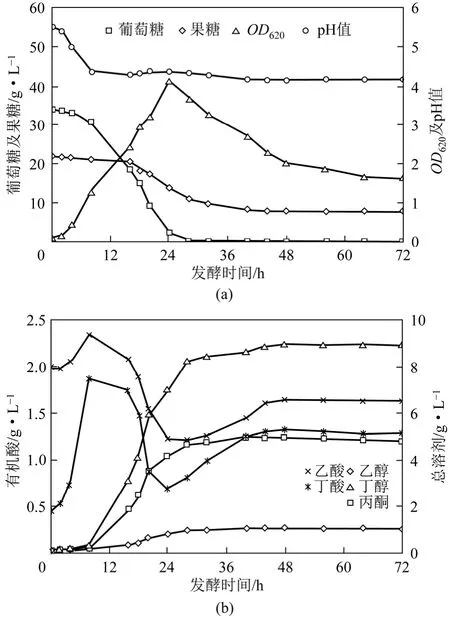
图3 葡萄糖与果糖混合比例为3∶2的丁醇发酵
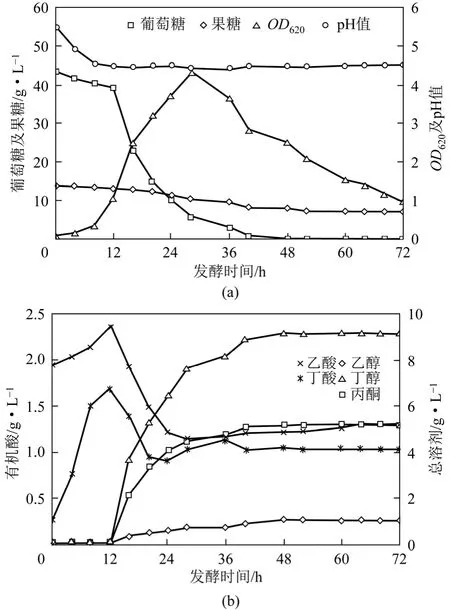
图4 葡萄糖与果糖混合比例为3∶1的丁醇发酵
当葡萄糖与果糖混合比例最终提高至3∶1时,试验结果见图4。发酵时间为48h,此时葡萄糖基本消耗殆尽,发酵至 28h,菌体浓度达到最大 OD620为4.3,已接近以单一葡萄糖为底物的发酵水平。发酵终点丁醇及总溶剂产量分别达到 9.2g/L及15.5g/L,有机酸浓度降至2.3g/L,果糖残余浓度为8.6g/L,果糖利用率下降。以上实验结果表明,当葡萄糖/果糖比例进一步提高至3∶1时,菌体细胞主要以葡萄糖为发酵底物,且发酵后期并未出现利用果糖的二次生长状态,相反发酵全程果糖代谢利用极其缓慢,葡萄糖阻遏效应明显,最终导致菌体细胞代谢果糖生产丁醇能力不足。
2.2 葡萄糖与果糖不同混合比例对果糖利用效率及丁醇产量的影响
前期研究发现,菊芋水解液中葡萄糖与果糖组成比例接近1∶4,且在分别以菊芋水解液及葡萄糖/果糖混合糖模拟物料为底物的批次丁醇发酵过程中,存在发酵提前终止,果糖利用率较低,丁醇等溶剂产量较低等技术问题。研究工作随后改变混合糖模拟体系中葡萄糖与果糖比例探究其对丁醇发酵性能的影响,结果如表2所示,随着葡萄糖与果糖混合比例的提高,虽然细胞生长、葡萄糖代谢利用及溶剂代谢合成能力明显增强,但是果糖利用效率并没有相应随之不断提高。其中,当葡萄糖/果糖混合比例为1∶2时,果糖利用率最佳,终点果糖利用效率高达95.0%,这一结果与该条件下发酵过程中出现的二次生长状态相一致,表明果糖能量代谢相对活跃,这对后续溶剂代谢合成的顺利进行至关重要。与此同时,而随着葡萄糖/果糖混合比例的继续提高直至3∶1时,发酵性能已接近以葡萄糖为底物的丁醇发酵,尽管丁醇等溶剂合成速率提升,但果糖利用率反而明显下降,此时发酵过程中溶剂代谢主要来源于底物葡萄糖。这些结果表明,适当提高葡萄糖/果糖混合比例将有利于菌体细胞对果糖的代谢利用。
事实上,依赖于磷酸烯醇式丙酮酸的磷酸转移酶系统(PTS)是严格厌氧菌和兼性厌氧菌吸收糖类的主要机制,C.acetobutylicum中的磷酸转移酶系统与Clostridium pasteurianum、 Bacillus subtilis及Escherichia coli中PTS系统相似[24],糖类在被转运吸收的同时也要经过磷酸化[25-27],葡萄糖、果糖等六碳糖必须通过磷酸转移酶系统的磷酸化进入菌体内[28]。另一方面,Hutkins等[29]在C.acetobutylicum中发现,菌体转运葡萄糖和果糖的磷酸转移酶系统不同,它们的区别就在于催化葡萄糖磷酸化的酶为葡萄糖激酶,而催化果糖转运并磷酸化为果糖-6-P的酶为特异性的果糖激酶[30]。在本研究中,在不同葡萄糖/果糖混合比例下,批次丁醇发酵前期葡萄糖对果糖利用主要表现出一定的阻遏效应,但是在葡萄糖消耗殆尽前仍有较短的协同利用阶段。在此前提下,发酵后期果糖代谢利用能力具有明显差异性,如在葡萄糖/果糖比例为1∶2条件下,菌体细胞出现典型的二次生长状态,在葡萄糖消耗殆尽后菌体细胞对果糖代谢利用能力得到增强,最终提高了果糖利用效率,但是相关调控机制尚不明确。
3 结 论
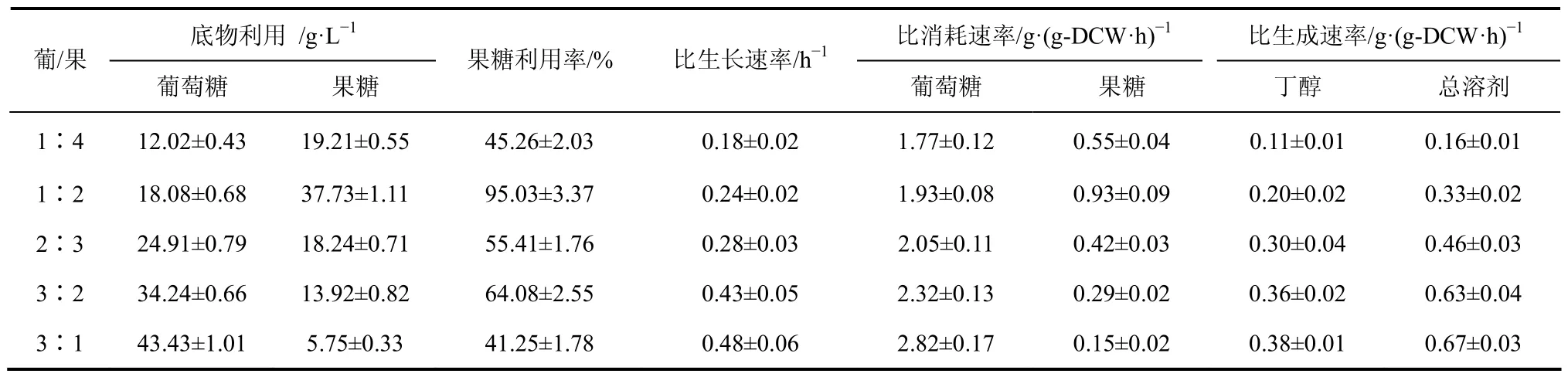
表2 葡萄糖与果糖不同混合比例对丁醇发酵性能的影响
以混合糖模拟菊芋物料为底物的丁醇发酵存在果糖利用效率及丁醇产量较低等问题,严重影响了发酵效率。对于C.acetobutylicum来说,虽然葡萄糖与果糖均利用均依赖磷酸转移酶系统(PTS)进行,但是二者仍有不同,且在细胞内吸收代谢速率具有较大差异,在本实验中,针对不同葡萄糖/果糖比例的丁醇发酵,发酵前期葡萄糖表现一定的阻遏效应,尽管二者一定程度上亦能同步利用,直至葡萄糖消耗殆尽前,果糖代谢利用相对缓慢。本实验进一步通过提高葡萄糖与果糖的混合比例,有效地缩短了发酵周期,由76h缩短至48h,同时菌体最大生物量大幅度提高,OD620由2.1提高至4.3。值得注意的是,当葡萄糖与果糖比例为1∶2时,后期果糖利用阶段菌体细胞呈现出典型的二次生长状态,能量代谢活性相对增强,对于后续果糖代谢利用及溶剂合成具有重要促进作用,在保证果糖利用的同时,发酵终点残糖有效降低,丁醇等溶剂代谢得到顺利进行。最终果糖利用效率达到95.03%,而丁醇及总溶剂产量也分别达到了9.7g/L与16.0g/L,有效地提高了丁醇发酵效率。相反,当进一步提高葡萄糖/果糖比例时,葡萄糖消耗殆尽后,果糖代谢利用能力依旧不足,发酵终点果糖残糖浓度较高,丁醇等溶剂产量有所下降。以上研究结果为探究葡萄糖及果糖代谢利用机制提供了重要的理论依据,也为菊芋物料或混合糖模拟物料发酵生产丁醇奠定了坚实的基础。
[1] Swana J,Yang Y,Behnam M,et al.An analysis of net energy production and feedstock availability for biobutanol and bioethanol[J].Bioresour.Technol.,2011,102(2):2112-2117.
[2] Karakashev D, Thomsen A B, Angelidaki I.Anaerobic biotechnological approaches for production of liquid energy carriers from biomass[J].Biotechnol.Lett.,2007,29(7):1005-1012.
[3] Jarboe L R,Zhang X,Wang X,et al.Metabolic engineering for production of biorenewable fuels and chem icals:Contributions of synthetic biology[J].J.Biomed.Biotechnol.,2010,2010:761042.
[4] Jang,Y S,Malaviya A,Cho C,et al.Butanol production from renewable biomass by clostridia[J].Bioresour.Technol.,2012,123:653-663.
[5] Kumar M,Gayen K.Developments in biobutanol production:New insights[J].Appl.Energ.,2011,88(6):1999-2012.
[6] Tracy B P,Jones S W,Fast A G,et al.Clostridia:The importance of their exceptional substrate and metabolite diversity for biofuel and biorefinery applications[J].Curr.Opin.Biotechnol.,2012,23(3):364-381.
[7] García V,Päkkilä J,Ojamo H,et al.Challenges in biobutanol production:How to improve the efficiency?[J] Renew Sust.Energ.Rev.,2011,15(2):964-980.
[8] Ezeji T,M ilne C,Price N D,et al.Achievements and perspectives to overcome the poor solvent resistance in acetone and butanol-producing m icroorganisms[J].Appl.Microbiol.Biotechnol.,2010,85(6):1697-1712.
[9] 潘微,熊莲,彭万峰,等.玉米浆干粉在葡萄糖和木糖混合丙酮丁醇发酵中的应用[J].化工进展,2011,30(12):2699-2703.
[10] 李锋,温顺华,黄庶冰,等.响应面法优化甘露醇产丁醇的发酵条件[J].化工进展,2013,32(7):1629-1634.
[11] 夏子义,倪晔,孙志浩,等.利用Clostridium saccharobutylicum DSM 13864 连续发酵生产丁醇[J].化工进展,2013,32(1):156-160.
[12] 刘钺,张宏武,陈波,等.纤维素水解液中木糖发酵制丁醇[J].化工进展,2013,32(11):2701-2706.
[13] Wu Y D,Xue C,Chen L J,et al.Effect of zinc supplementation on acetone-butanol-ethanol fermentation by Clostridium acetobutylicum[J].J.Biotechnol.,2013.165(1):18-21.
[14] Patakova P,Linhova M,Rychtera M,et al.Novel and neglectedissues of acetone-butanol-ethanol (ABE) fermentation by clostridia:Clostridium metabolic diversity,tools for process mapping and continuous fermentation systems[J].Biotechnol.Adv.,2013.31(1):58-61.
[15] Ezeji T C,Qureshi N,Blaschek H P.M icrobial production of a biofuel(acetone-butanol-ethanol) in a continuous bioreactor:Impact of bleed and simultaneous product removal[J].Bioprocess Biosyst.Eng.,2013,36(1):109-116.
[16] Niness K R.Inulin and oligofructose:What are they?[J] J.Nutr.,1999,129(7):1402-1406.
[17] Bacon J S,Edelman J.The carbohydrates of the Jerusalem artichoke and other composite[J].Biochem.J.,1951,48(1):114-126.
[18] Marchal R,Blanchet D,Vandecasteele J.Industrial optim ization of acetone-butanol fermentation:A study of the utilization of Jerusalem artichokes[J].Appl.Microbiol.Biotechnol.,1985,23(2):92-98.
[19] 陈丽杰,辛程勋,邓攀,等.丙酮丁醇梭菌发酵菊芋汁生产丁醇[J].生物工程学报,2010,26(7):991-996.
[20] 邓攀,陈丽杰,辛程勋,等.果糖及葡萄糖混合物为底物的丙酮丁醇发酵[J].生物工程学报,2011,27(10):1448-1456.
[21] Annous B,H.Blaschek.Regulation and localization of amylolytic enzymes in Clostridium acetobutylicum ATCC 824[J].Appl.Environ.Microbiol.,1990,56(8):2559-2561.
[22] Monot F,Martin J R,Petitdemange H,et al.Acetone and butanol production by Clostridium acetobutylicum in a synthetic medium[J].Appl.Environ.Microbiol.,1982,44(6):1318-1324.
[23] M iller G L.Use of dinitrosalicylic acid reagent for determ ination of reducing sugar[J].Anal.Chem.,1959,31(3):426-428.
[24] M itchell W J,Shaw J E,Andrews L.Properties of the glucose phosphotransferase system of Clostridium acetobutylicum NCIB 8052[J].Appl.Environ.Microbiol.,1991,57(9):2534-2539.
[25] M itchell W J, Tangney M.Carbohydrate uptake by the phosphotransferase system and other mechanisms[M]//Dürre P,editor.Handbook on Clostridia.CRC Press,2005:165-185.
[26] Meadow N D, Fox D K, Roseman S.The bacterial phosphoenol-pyruvate:Glycose phosphotransferase system[J].Annu.Rev.Biochem.,1990,59(1):497-542.
[27] Reizer J,Saier M H,Deutscher J,et al.The phosphoenolpyruvate:Sugar phosphotransferase system in gram-positive bacteria:Properties,mechanism,and regulation[J].Crit.Rev.Microbiol.,1988,15(4):297-338.
[28] Saier Jr M H.Bacterial phosphoenolpyruvate: Sugar phosphotransferase systems:Structural,functional,and evolutionary interrelationships[J].Bacteriol.Rev.,1977,41(4):856-71.
[29] Hutkins R W,Kashket E R.Phosphotransferase activity in Clostridium acetobutylicum from acidogenic and solventogenic phases of grow th[J].Appl.Environ.Microbiol.,1986,51(5):1121-1123.
[30] Tangney M,Rousse C,Yazdanian M,et al.Note:Sucrose transport and metabolism in Clostridium beijerinckii NCIMB 8052[J].J.Appl.Microbiol.,1998,84(5):914-919.
