氨氯地平对糖尿病大鼠心肌梗死后骨髓内皮祖细胞动员及血管新生的改善作用*
2014-03-03董莉孙佳音康丽娜罗倩孙峰顾明霞印小荣徐标
董莉,孙佳音,康丽娜,罗倩,孙峰,顾明霞,印小荣,徐标
基础与实验研究
氨氯地平对糖尿病大鼠心肌梗死后骨髓内皮祖细胞动员及血管新生的改善作用*
董莉,孙佳音,康丽娜,罗倩,孙峰,顾明霞,印小荣,徐标
目的:观察氨氯地平对糖尿病大鼠心肌梗死(心梗)后骨髓内皮祖细胞(EPC)动员和血管新生障碍的改善作用以及对心功能的影响,并探讨其可能的分子机制。
糖尿病;心肌梗死;内皮祖细胞;血管新生;氨氯地平
(Chinese Circulation Journal, 2014,29:718.)
糖尿病患者易患心肌梗死(心梗)、缺血性脑卒中、下肢动脉闭塞等血管并发症,而且发生缺血事件后预后较差,在很大程度与糖尿病血管内皮修复能力降低以及血管新生障碍有关[1]。研究显示,缺血组织的血管新生及侧支形成不仅依赖于原位血管的芽生与重塑,骨髓起源的内皮祖细胞(EPC)也在缺血后反应性的血管新生中发挥重要作用[2]。然而糖尿病患者与糖尿病大鼠血循环中EPC数量减少并且存在功能缺陷[3,4]。糖尿病伴心肌缺血时,血管新生及侧支循环形成减少,导致心梗面积扩大,心功能减退[5]。新近有研究报道,氨氯地平可以减轻冠心病患者心肌缺血后再灌注损伤[6],具体机制目前尚不明了。本研究利用大鼠急性心梗模型,观察氨氯地平是否可以改善糖尿病大鼠心肌缺血诱导的血管新生以及心梗后心功能,并探讨其可能的分子机制。
1 材料与方法
糖尿病模型的建立:2012-04至2012-12选取180~200 g SPF级雄性Sprague-Dawley大鼠(南京大学模式动物研究所)60只,随机分为糖尿病大鼠(n=40), 给予高脂饲料(上海斯莱克实验动物有限公司)饲养四周后,腹腔注射30 mg/kg链脲佐菌素(美国Sigma公司)一次,第3 d后测血糖、血脂及血浆胰岛素水平,并计算胰岛素敏感指数。空腹血糖>10 mmol/L或餐后血糖>16.7 mmol/L即为糖尿病模型建立成功,此后继续高脂饲料喂养四周;非糖尿病大鼠(n=20) 为正常饮食饲养。
心肌梗死模型的建立和分组:参见文献[7,8],建立大鼠心梗模型,具体方法如下:40只糖尿病大鼠麻醉后,气管插管,呼吸机辅助通气。左胸开口,结扎冠状动脉(冠脉)左前降支,超声心动图及肉眼观察证实心梗模型建立成功。术后将糖尿病大鼠随机分成对照组(n=20),每日予以0.5%羧甲基纤维素钠溶剂1 ml灌胃,继续高脂喂养四周;治疗组(n=20)每日予以氨氯地平2 mg/kg(美国辉瑞公司)灌胃。
外周血早期内皮祖细胞检测:参照文献[9],定义外周血中骨髓起源的早期EPCs 为不表达或弱表达造血细胞表面标记CD45,同时表达原始的造血—血管干细胞表面标记CD133和内皮细胞特异性表面标记血管内皮生长因子受体-2(VEGFR-2)/激酶插入受体(KDR)的细胞群。于术前及术后不同时间点(第1、3、5、7、14、28 d)采血,采用Histopaque-10831(天津灏洋生物制品科技有限公司),密度梯度离心法获取大鼠外周血单个核细胞。依次加入异硫氰酸荧光素标记的小鼠抗大鼠CD45(美国Invitrogen公司),兔抗大鼠CD133(英国Abcam公司)和生物素标记的小鼠抗大鼠血管内皮生长因子(VEGFR-2/ KDR,美国Novus Biologicals公司),3种大鼠早期EPC单克隆抗体,4℃避光孵育20 min,红细胞裂解液(美国Biolegend公司)避光孵育10 min后,采用FACS Calibur 流式细胞仪(美国BD公司)检测,用Cell Quest软件(美国BIO-RAD公司)分析外周血单个核细胞中CD45-/low+/CD133+/KDR+早期EPC比例。
血浆血管内皮生长因子水平测定:于术前及术后不同时间点(第1、3、5、7、14、28 d)采血,酶联免疫吸附法测定血浆中VEGF水平, 操作按照检测试剂盒(英国Abcam公司)说明书进行。
心功能检测:40只糖尿病大鼠给药治疗四周后,应用彩色多普勒超声诊断仪(探头频率10 MHz,美国GE公司)检测糖尿病大鼠心梗后心功能。糖尿病大鼠麻醉后,将探头放置在胸骨左缘3~4肋间,指向左上方显示左心室长轴断面,测量左心室舒张末期内径和左心室收缩末期内径,舒张末期及收缩末期室间隔厚度,舒张末期及收缩末期左心室后壁厚度,左心室短轴缩短率和左心室射血分数等参数。
心肌梗死周围区毛细血管密度测定:应用CD31染色法检测治疗四周后心梗周围区组织微血管密度。心脏超声检查后处死大鼠,取出心脏制成5 μm冰冻切片。冰冻切片用4%多聚甲醛固定15 min后,加入小鼠抗大鼠CD31多克隆抗体(1:200,美国BD公司),4 ℃过夜孵育。充分洗涤后加入荧光二抗,常温孵育2 h,4 ',6-二脒基-2-苯基吲哚(DAPI,0.5 mg/ml,美国Sigma-Aldrich公司)染核后采用荧光显微镜计数心梗周围区毛细血管密度。心脏内新生血管内皮细胞与CD31抗体结合,呈现红色荧光(Alexa Fluor 594),DAPI非特异性与细胞核结合呈现蓝色荧光。
蛋白质印迹法检测骨髓细胞信号分子蛋白表达水平:糖尿病心梗大鼠给药治疗一周后处死,以外科手法暴露大鼠股骨及胫腓骨,用大量磷酸盐缓冲液 (0.01 mmol/L,PH 7.2~7.4)反复冲洗骨髓,将冲洗液用200目纱网过滤后离心,获取骨髓细胞。用含蛋白酶及磷酸酶抑制剂的蛋白裂解液提取细胞膜总蛋白,凝胶电泳,湿性电转法转膜。转移蛋白膜条以5%脱脂奶粉封闭2 h后,分别与小鼠抗大鼠蛋白激酶B(protein kinase B,Akt,1:2 000)及其相应磷酸化产物(p-Akt,1:2 000),内皮型一氧化氮合酶(eNOS,1:1000)及其相应磷酸化产物(p-eNOS,1:500,美国BD公司),兔抗大鼠基质金属蛋白酶-9(MMP-9,英国Abcam公司),兔抗大鼠β-肌动蛋白(β-actin,1:2000,美国Santa Cruz公司)等多克隆抗体,4 ℃孵育过夜。洗膜后加入辣根过氧化物酶标记的相应二抗,室温孵育2 h。免疫反应结束后以增强的化学发光法显影、洗片,用Quantity One图象分析软件(美国BIO-RAD公司)分析,将待测蛋白条带与同一泳道β-actin条带光密度比值作为结果,并以p-Akt/Akt和 p-eNOS/ eNOS光密度比值作为相应蛋白活化水平。
统计学分析:应用SPASS17. 0 软件进行统计学分析,计量数据用均数±标准差表示,组间均数比较采用t检验,P<0.05为差异有统计学意义。
2 结果
60只大鼠基本生理情况:与非糖尿病大鼠相比,糖尿病大鼠饲养五周后体重增长显著[(435.4±36.1)g 比 (376.9±23.1) g],差异有统计学意义(P<0.05)。糖尿病大鼠给予小剂量链脲佐菌素腹腔注射一周后,其空腹血糖、餐后血糖、总胆固醇、甘油三酯及空腹胰岛素水平均显著高于非糖尿病大鼠,胰岛素敏感指数下降,差异均有统计学意义(P<0.01)。表1
表1 糖尿病与非糖尿病大鼠不同饲养方式饲养五周后基本生理情况

表1 糖尿病与非糖尿病大鼠不同饲养方式饲养五周后基本生理情况
注:与非糖尿病大鼠相比*P<0.05 **P<0.01。 △:注射小剂量链脲菌素1 周后,体重除外
非糖尿病大鼠 (n=20) 糖尿病大鼠△(n=40)体重 (g) 376.9±23.1 435.4±36.1*空腹血糖 (mmol/L) 4.15±0.53 16.12±2.69**餐后血糖 (mmol/L) 10.16±1.27 29.66±3.23**总胆固醇 (mmol/L) 1.54±0.28 2.27±0.82**甘油三酯 (mmol/L) 0.76±0.18 2.43±1.54**空腹胰岛素 (mIU/L) 35.31±4.22 72.42±9.64**胰岛素敏感指数 - 4.94±0.73 -7.63±0.77**
对照组和治疗组不同时间点外周血内皮祖细胞水平的变化:对照组外周血CD45-/low+/CD133+/ KDR+EPC水平术后第5 d出现峰值(55±10/106单核细胞),治疗组第7 d 出现峰值(112±30/106单核细胞),且较对照组升高,随后两组CD45-/low+/ CD133+/KDR+EPC水平均迅速下降;治疗组糖尿病大鼠外周血CD45-/low+/CD133+/KDR+EPC水平术后第3 、5、7 d和第14 d较对照组同时间点均增高,差异均有统计学意义(P<0.05~0.01)。图1A

图1 糖尿病大鼠心肌梗死前后不同时间点外周血内皮祖细胞及血管内皮生长因子水平变化(n=20 )
对照组和治疗组不同时间点血管内皮生长因子水平的变化:对照组糖尿病大鼠血浆VEGF水平在心梗后第5d达到峰值[(3.68±0.98) ng/L],治疗组在第7d达到峰值[(5.63±1.33)ng/L],且较对照组升高,随后两组均逐渐下降。治疗组糖尿病大鼠血浆VEGF水平在心梗后第5、7 d较对照组同时间点均升高,差异均有统计学意义(P<0.05~0.01)。图1B
蛋白质印迹检测两组用药后骨髓细胞信号分子蛋白表达水平的变化:两组糖尿病心梗大鼠给药7 d 后,治疗组骨髓中EPC动员相关信号分子Akt、eNOS的活化水平较对照组均显著增加[p-Akt/ Akt:(1.80±0.15) 比(1.10±0.15);p-eNOS/eNOS:(0.92±0.12)比(0.53±0.10);MMP-9的蛋白表达水平:(1.08±0.0.06)比(0.68±0.090)] ,较对照组显著增加,差异均有统计学意义P<0.01。图2
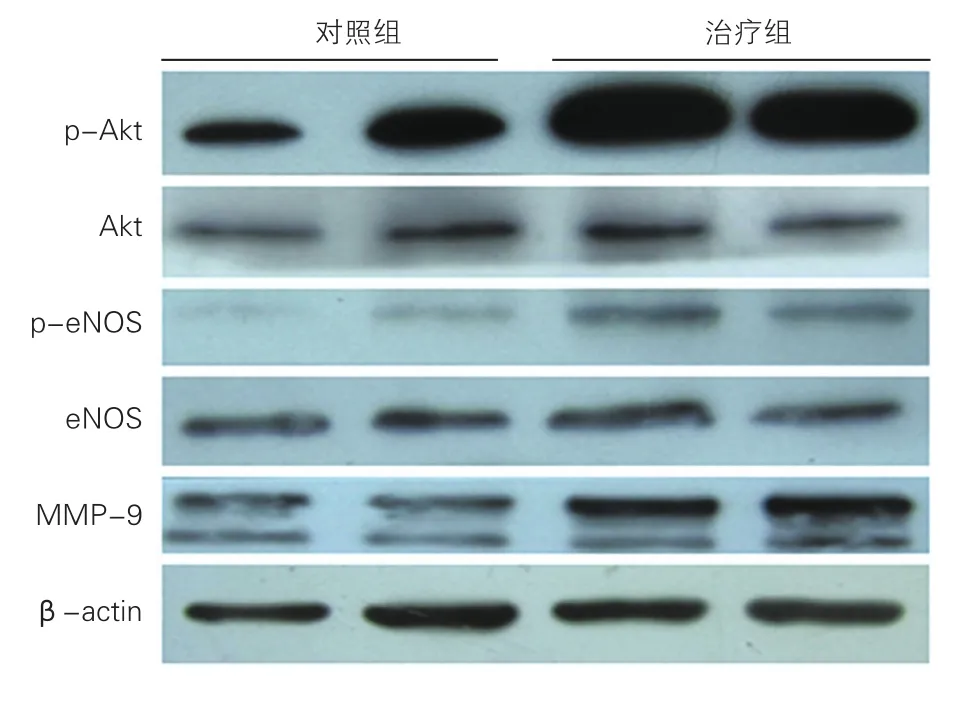
图2 两组糖尿病心肌梗死大鼠治疗一周后骨髓中蛋白激酶B、内皮型一氧化氮合酶以及基质金属蛋白酶-9蛋白表达的免疫印迹图。(n=20)
CD31染色法检测治疗四周后两组糖尿病大鼠心梗周围区组织微血管密度的改变:治疗组心梗周围区毛细血管密度较对照组显著增加[(72.36±5.02)比(58.06±4.27)],差异有统计学意义(P<0.05)。 图3
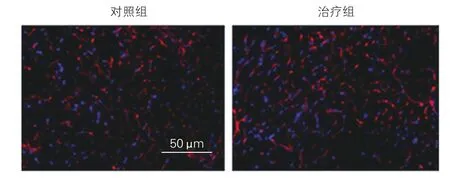
图3 CD31染色法检测治疗四周后两组糖尿病大鼠心梗周围区组织微血管密度的改变
两组糖尿病大鼠心梗后心功能的比较: 与对照组比较,治疗组糖尿病大鼠心梗四周后左心室收缩末期内径减小,收缩末期室间隔厚度明显增加,左心室射血分数和短轴缩短率均升高,差异均有统计学意义(P<0.05~0.01)。表2
表2 两组糖尿病心梗大鼠治疗四周后心脏结构及功能超声指标
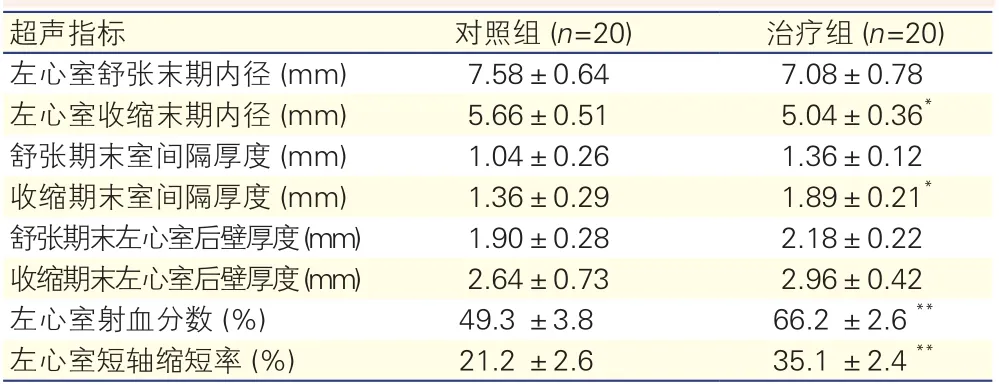
表2 两组糖尿病心梗大鼠治疗四周后心脏结构及功能超声指标
注:与对照组相比*P<0.05 **P<0.01
超声指标 对照组 (n=20) 治疗组 (n=20)左心室舒张末期内径 (mm) 7.58±0.64 7.08±0.78左心室收缩末期内径 (mm) 5.66±0.51 5.04±0.36*舒张期末室间隔厚度 (mm) 1.04±0.26 1.36±0.12收缩期末室间隔厚度 (mm) 1.36±0.29 1.89±0.21*舒张期末左心室后壁厚度 (mm) 1.90±0.28 2.18±0.22收缩期末左心室后壁厚度 (mm) 2.64±0.73 2.96±0.42左心室射血分数 (%) 49.3 ±3.8 66.2 ±2.6**左心室短轴缩短率 (%) 21.2 ±2.6 35.1 ±2.4**
3讨论
本研究采用高脂饲料联合小剂量链脲佐菌素建立糖尿病大鼠实验模型。高脂饮食饲养后,大鼠体重明显增加,继之以小剂量链脲佐菌素损伤胰岛功能,大鼠呈现空腹及餐后血糖升高,伴血浆胰岛素水平升高,而胰岛素敏感指数下降,能够模拟临床上伴有胰岛素抵抗的2型糖尿病状态。另外,高脂饲养大鼠呈现血浆总胆固醇及甘油三酯水平升高,结扎冠脉左前降支建立急性心梗模型,能够模拟临床上冠脉粥样硬化性心脏病伴急性心肌缺血状况。在本研究中,我们证实了氨氯地平可以改善糖尿病大鼠缺血诱导的骨髓来源EPC动员障碍,这种作用伴随EPC动员相关的VEGF/Akt/eNOS/ MMP-9 信号通路活化增强。此外,氨氯地平治疗促进心梗周围区组织血管新生,改善糖尿病大鼠心梗后心功能。
循环中的EPC主要来源于骨髓。组织缺血缺氧发生后,损伤部位生成增加的缺氧诱导因子1α刺激VEGF的表达与释放[10]。在骨髓组织中,VEGF与骨髓细胞表面受体结合后激活磷脂酰肌醇3-激酶/Akt/eNOS途径,导致NO的合成与释放增加[11]。NO促进骨髓中MMP-9表达增加、活性增强,后者促进EPC在骨髓内募集并向外周血迁移[12]。动员至外周血的EPC特异性地归巢到缺血组织,通过分化增殖、迁移整合等机制参与新生血管的形成,改善缺血组织的血循环[13]。然而糖尿病时增强的氧化应激和高血糖本身可阻碍上述信号通路级联激活,导致组织缺血损伤后EPC动员以及血管新生障碍[14]。有研究报导,氨氯地平可通过阻断eNOS与质膜小窝蛋白的抑制性结合,促进VEGF诱导的NO释放,从而改善血管内皮功能[15]。本实验中,我们观察到糖尿病心梗大鼠服用氨氯地平治疗7d后,循环中EPC水平显著升高、伴随VEGF释放增加,同时骨髓中p-Akt、p-eNOS及MMP-9的表达亦明显升高,推测氨氯地平通过改善VEGF/Akt /eNOS/MMP-9信号通路的活化,促进骨髓中EPC释放至外周血,进而参与缺血组织的血管新生。
冠脉闭塞发生后,代偿性的侧支血管生成决定了心肌缺血及心功能受损的严重程度。而冠心病患者循环中EPCs数量及功能下降与血管内皮依赖性舒张功能障碍相关。氨氯地平以前被证实有利于减轻小鼠心肌梗死后的左心室重构并改善心梗后心功能[16]。本研究发现糖尿病心肌梗死大鼠应用氨氯地平治疗四周后,心梗周围区毛细血管密度明显增加;同时,作为反映左心室收缩功能的指标,左心室射血分数及左心室短轴缩短率较对照组有显著改善,提示氨氯地平治疗促进糖尿病大鼠心肌缺血后代偿性血管新生,从而改善左心室收缩功能。此外,治疗组大鼠心梗后左心室收缩末期内径较对照组明显降低,伴收缩期末室间隔厚度增加,表明氨氯地平亦可减轻糖尿病大鼠心梗后失代偿性心室扩张,抑制心肌重构,最终改善心功能。因此氨氯地平促进缺血区血管新生及侧支形成可以起到自动恢复血运重建的作用,从而影响冠心病的病情程度及预后,这对合并有急性心梗的糖尿病患者来说是很有潜力的治疗方式。
[1] Kolluru GK, Bir SC, Kevil CG. Endothelial dysfunction and diabetes: effects on angiogenesis, vascular remodeling, and wound healing. Int J Vasc Med, 2012, 2012:918267.
[2] Thal MA, Krishnamurthy P, Mackie AR, et al. Enhanced angiogenic and cardiomyocyte differentiation capacity of epigenetically reprogrammed mouse and human endothelial progenitor cells augments their efficacy for ischemic myocardial repair. Circ Res, 2012, 111: 180-190.
[3] Fadini GP, Miorin M, Facco M, et al. Circulating endothelial progenitor cells are reduced in peripheral vascular complications of type 2 diabetes mellitus. J Am Coll Cardiol, 2005, 45: 1449-1457.
[4] 董莉, 徐标, 康丽娜, 等. 胰岛素改善糖尿病小鼠骨髓内皮祖细胞动员障碍研究. 中国循环杂志, 2011, 26: 145-148.
[5] Lamblin N, Fertin M, de Groote P, et al. Cardiac remodeling and heart failure after a first anterior myocardial infarction in patients with diabetes mellitus. J Cardiovasc Med, 2012, 13: 353-359.
[6] Khan NA, Chattopadhyay P, Abid M, et al. Protective effects of amlodipine on mitochondrial injury in ischemic reperfused rat heart. Environ. Biol, 2012, 33: 591-595.
[7] Zhang J, Ding L, Zhao Y, et al. Collagen-targeting vascular endothelial growth factor improves cardiac performance after myocardial infarction. Circulation, 2009, 119: 1776-1784.
[8] 黄继汉, 黄晓晖, 陈志扬, 等. 药理试验中动物间和动物与人体间的等效剂量换算. 中国临床药理学与治疗学, 2004, 9: 1069-1072.
[9] Khakoo AY, Finkel T. Endothelial progenitor cells. Annu Rev Med, 2005, 56: 79-101.
[10] Poynter JA, Manukyan MC, Wang Y, et al. Systemic pretreatment with dimethyloxalylglycine increases myocardial HIF-1α and VEGF production and improves functional recovery after acute ischemia/ reperfusion. Surgery, 2011, 150: 278-283.
[11] Aicher A, Heeschen C, Mildner-Rihm C, et al. Essential role of endothelial nitric oxide synthase for mobilization of stem and progenitor cells. Nature Medicine, 2003, 9: 1370- 1376.
[12] Liu ZJ, Velazquez OC. Hyperoxia, endothelial progenitor cell mobilization, and diabetic wound healing. Antioxid Redox Signal, 2008, 10: 1869-1882.
[13] Jeon O, Song SJ, Bhang SH, et al. Additive effect of endothelial progenitor cell mobilization and bone marrow mononuclear cell transplantation on angiogenesis in mouse ischemic limbs. J Biomed Sci, 2007, 14: 323-330.
[14] Krankel N, Adams V, Linke A, et al. Hyperglycemia reduces survival and impairs function of circulating blood-derived progenitor cells. Arterioscler Thromb Vasc Biol, 2005, 25: 698-703.
[15] Sharma A, Trane A, Yu C, et al. Amlodipine increases endothelial nitric oxide release by modulating binding of native eNOS protein complex to caveolin-1. Eur J Pharmacol, 2011, 659: 206-212.
[16] Ogino A, Takemura G, Kanamori H, et al. Amlodipine inhibits granulation tissue cell apoptosis through reducing calcineurin activity to attenuate postinfarction cardiac remodeling. Am J Physiol Heart Circ Physiol, 2007, 293: H2271-2280.
Amlodipine Improves Endothelial Progenitor Cell Mobilization and Neo-vascularization in Experimental Diabetic Rats After Myocardial Infarction
DONG Li, SUN Jia-yin, KANG Li-na, LUO Qian, SUN Feng, GU Ming-xia, YIN Xiao-rong, XU Biao.
Department of Cardiology, Hospital of Nanjing Municipal Authorities, Nanjing (210018), Jiangsu, China
DONG Li, Email: dongli_nju@163.com
Objective: To observe the effect of amlodipine on bone marrow endothelial progenitor cell (EPC) mobilization, neo-vascularization and cardiac function in diabetic rats after myocardial infarction (MI) with the possible mechanisms.Methods: A total of 60 male SD rats were divided into 2 groups. Normal group, n=20. Diabetic group, n=40, the rats were fed with high fat diet (HFD) for 4 weeks and then received streptozotocin followed by left anterior descending coronary artery ligation to establish MI model, those rats were further divided into 2 sub-groups: Control group, the rats received sodium carboxymethylcellulose 1 ml/day with HFD and Treatment group, the rats received amlodipine 2 mg/kg/day with HFD, n=20 in each sub-group, all animals were treated for 4 weeks. The EPC level in peripheral blood CD45-/low+/CD133+/KDR+at before and 1, 3, 5, 7, 14, 28 days after operation were examined by fl ow cytometry, plasma vascular endothelial growth factor (VEGF) level was measured by ELISA, capillary density in MI area was determined by CD31 staining, EPC related protein expressions were detected by western blot analysis and the cardiacfunction was evaluated by echocardiography.Results: EPC in CD45-/low+/CD133+/KDR+in Treatment group at 7 days after operation was increased than Control group at 5 days after operation (112 ± 30/106) vs (55 ± 10/106), plasma VEGF in Treatment group was higher than Control group (5.63 ± 1.33) ng/L vs (3.68 ± 0.98) ng/L; Treatment group presented increased expressions of protein kinase B, endothelial nitric oxide synthase (eNOS) and matrix metallopeptidase-9, increased capillary density in MI area, higher LVEF and left ventricular fractional shorting, all P<0.05-0.01.Conclusion: Amlodipine improves EPC mobilization, neo-vascularization and cardiac function in diabetic-MI rats, it may be related to VEGF/eNOS cascade activation.
Diabetes; Myocardial infarction; Endothelial progenitor cell; Neovascularization; Amlodipine
2013-10-23)
(助理编辑:曹洪红)
南京市科技发展计划项目(2011ZD016)
210018 江苏省,南京市市级机关医院 心内科(董莉、罗倩、孙峰、顾明霞、印小荣);南京大学医学院附属鼓楼医院 心内科(孙佳音、康丽娜、徐标)
董莉 副主任医师 博士 主要从事心血管疾病发病机制的研究 Email:dongli_nju@163.com 通讯作者:董莉
R541
A
1000-3614(2014)09-0718-05
10.3969/j.issn.1000-3614.2014.09.016
方法:180~200g SPF级雄性Sprague-Dawley大鼠60只随机分为两部分:糖尿病大鼠(n=40) 给予高脂饲料饲养四周后,腹腔注射30 mg/kg链脲佐菌素;非糖尿病大鼠(n=20) 为正常饮食饲养。40只糖尿病大鼠结扎冠状动脉左前降支造成急性心梗模型。术后将大鼠随机分成对照组(n=20),每日予以0.5%羧甲基纤维素钠溶剂1ml灌胃,治疗组(n=20)每日予以氨氯地平2 mg/kg灌胃,继续高脂喂养四周。流式细胞术检测术前及术后不同时间点(第1、3、5、7、14和28 d)外周血CD45-/low+/CD133+/KDR+早期EPC数量,酶联免疫吸附法检测血浆血管内皮生长因子(VEGF)水平。CD31免疫荧光染色法评估心梗周围区血管新生情况。超声心动图评估心功能。免疫印迹法测定骨髓细胞中EPC动员相关信号通路蛋白的表达。
结果:外周血CD45-/low+/CD133+/KDR+EPC水平术后峰值治疗组(第7 d,112±30/106单核细胞)较对照组(第5 d,55±10/106单核细胞)升高;血浆VEGF水平在心梗后峰值治疗组[第7 d ,(5.63±1.33)ng/L]较对照组[第5 d,(3.68±0.98) ng/L]升高;骨髓细胞蛋白激酶B与内皮型一氧化氮合酶的活化水平及基质金属蛋白酶-9的表达增加;心梗周围区新生毛细血管密度治疗组大鼠较对照组显著增加,左心室射血分数及左心室短轴缩短率明显提高。上述比较差异均有统计学意义(P<0.05~0.01)。
结论:氨氯地平治疗改善糖尿病大鼠缺血诱导的骨髓EPC动员障碍,缺血区血管新生以及心梗后心功能。这种作用可能通过改善VEGF/内皮型一氧化氮合酶信号通路活化而介导。
