某规模化猪场母猪猪瘟抗体和病原检测与分析
2014-03-02张苏强林炜明戴爱玲杨小燕
张苏强林炜明戴爱玲杨小燕*
(1.福建省龙岩市农业学校 福建龙岩 364000;2.龙岩学院生命科学学院,福建省预防兽医学与兽医生物技术高校重点实验室 福建龙岩 364000)
某规模化猪场母猪猪瘟抗体和病原检测与分析
张苏强1林炜明2戴爱玲2杨小燕2*
(1.福建省龙岩市农业学校 福建龙岩 364000;2.龙岩学院生命科学学院,福建省预防兽医学与兽医生物技术高校重点实验室 福建龙岩 364000)
为了探讨母猪的猪瘟疫苗免疫情况和猪瘟病毒之间的关系,本研究采用阻断ELISA技术和RT-PCR技术,对某规模化猪场随机采取57头母猪的血清样品和扁桃体样品进行了猪瘟抗体水平和猪瘟病毒检测。结果表明:猪瘟抗体阳性率为74.07%,抗体离散度为41.79%,表明猪瘟抗体阳性率刚达到国家规定的标准,抗体离散度偏高。猪瘟抗体和猪瘟病毒之间存在一定关系,无论猪瘟疫苗免疫是否合格,均有可能感染猪瘟野毒,猪瘟抗体阴性组,以及抗体阻断率大于90%组中的猪瘟病毒阳性率较高。
猪瘟抗体 猪瘟病毒 免疫效果
*通讯作者:杨小燕,女,教授,主要从事动物传染病学研究。
E-mail:lyyxy1988@126.com。
猪瘟(classical swine fever,CSF)是由猪瘟病毒引起的猪的一种急性、热性、高度接触性传染病。猪是该病唯一的自然宿主,不同品种、年龄和性别的猪均可感染。该病最主要的传染源是患猪和带毒猪。易感猪与患猪的直接接触是该病的主要传播方式。感染猪在发病前即可从口、鼻及泪腺分泌物和尿、粪中排毒,并延伸整个病程[1]。虽然我国采用猪瘟弱毒疫苗进行免疫接种,在很大程度上控制了猪瘟的流行和发生,但近年来,慢性猪瘟和非典型猪瘟在各地仍时有发生,猪瘟仍然是当前规模化猪场需防控的重点传染病[2]。为了解猪场母猪猪瘟疫苗免疫情况和猪瘟病毒感染情况,试验随机采取某规模化猪场57头母猪的血清样品和扁桃体样品进行猪瘟抗体水平和猪瘟病毒RT-PCR检测,分析猪瘟疫苗免疫合格率的状况,以及猪瘟抗体水平和感染猪瘟野毒之间的关系,为规模化猪场控制猪瘟提供科学依据。
1 材料与方法
1.1 材料 随机采取某规模化猪场57头母猪猪瘟疫苗免疫1个月以上的血清样品和扁桃体样品;CSFV抗体检测试剂盒购于 IDEXX公司;Trizol RNA提取试剂购于Invitrogen公司;Taq DNA聚合酶、M-MLV反转录酶和dNTP购于TaKaRa公司;猪瘟病毒引物由上海生工生物工程技术服务有限公司合成,扩增片段大小为272 bp。
1.2 仪器 96孔酶标仪购于Thermo公司;冰箱购于海尔公司;高速冷冻离心机购于Thermo公司;梯度PCR仪购于Thermal公司;电泳仪购于北京市六一仪器厂;紫外线凝胶成像仪购于BIO-RAD公司。
1.3 ELISA检测猪瘟抗体水平 采用ELISA技术对血清样品进行猪瘟抗体水平的检测,具体操作步骤参照试剂盒说明书进行。结果判断如下:抗体阻断率≥40%,表示抗体阳性;阻断率≤30%,表示抗体阴性;阻断率在30%~40%,应在数日后再对该动物重新检测。猪群猪瘟抗体阻断率﹥40%达到100%,或者﹥50%达到85%,离散度﹤25%,表示猪群免疫状况很好;离散度在25%~40%表示免疫效果一般。
1.4 RT-PCR检测猪瘟病毒 RNA提取方法参照Trizol RNA提取试剂盒说明书进行。反转录体系为25 uL,其中含RNA溶液16 uL,随机引物1.4 uL,5× M-MLV buffer 4 uL,dNTP 2 uL,无菌水1 uL,MMLV反转录酶1 uL。PCR反应体系为25 uL,其中含无菌水16 uL,10×PCR buffer 2.5 uL,dNTP Mixture 2 uL,引物1.2 uL,cDNA 3 uL,Taq DNA聚合酶0.2 uL。反应条件为94℃预变性4 min;94℃变性45 s;56℃退火45 s;72℃延伸1 min,35个循环。72℃再延伸10 min。PCR反应结束后,取5 uL PCR产物加入1 uL 6×Loading Buffer,用1%琼脂糖凝胶进行电泳。最后用紫外线凝胶成像系统进行分析。
2 结果与分析
2.1 猪瘟抗体水平检测 随机采取某规模化猪场57头母猪猪瘟疫苗免疫1个月以上的血清样品,采用阻断ELISA技术对猪瘟抗体水平进行了检测。结果表明,猪瘟抗体阳性率为74.07%,抗体离散度为41.79%,平均抗体阻断率为54.38。按照国家猪瘟强制免疫抗体阳性率应在70%以上才能判定为群体免疫效果合格的标准[3],该场的猪瘟抗体阳性率刚能达到标准,但抗体离散度偏高。
2.2 猪瘟病原检测 采用RT-PCR技术对该场随机采取的57头母猪血清样品和扁桃体样品进行猪瘟病毒检测,若呈病毒阳性将出现大小为272 bp的一条特异性条带。结果表明,有4头母猪已感染猪瘟病毒,猪瘟病毒阳性率为7%。猪群中有极少部分外表看似健康的猪存在隐性感染猪瘟病毒。
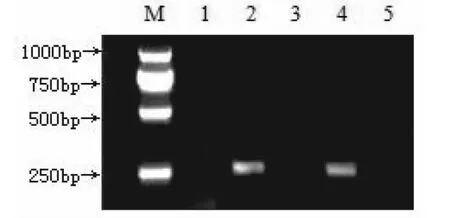
图1 RT-PCR产物凝胶电泳图
2.3 猪瘟抗体和病原之间的关系 采用阻断ELISA和RT-PCR技术对该场随机采取的57头母猪的血清样品和扁桃体样品进行了猪瘟抗体水平和猪瘟病毒检测,分析猪瘟抗体水平和感染猪瘟野毒之间的关系。结果表明,当猪瘟抗体阻断率为≤30%时(猪瘟抗体阴性),猪瘟病毒阳性率为14.3%;当猪瘟抗体阻断率在30%~90%时,猪瘟病毒阳性率为2%;猪瘟抗体阻断率大于90%时,猪瘟病毒阳性率为66.7%。可见,无论猪瘟疫苗免疫是否合格,猪群均有可能感染猪瘟病毒。猪瘟抗体阴性组,以及抗体阻断率大于90%组中的猪瘟病毒阳性率较高。
3 讨论
1)近年来,虽然规模化猪场典型急性猪瘟大面积流行已少见,但非典型猪瘟仍然普遍存在,种猪群带毒是造成我国猪瘟长期持续存在及流行恶性循环的主要根源。猪瘟疫苗无论在过去、现在还是将来,对控制猪瘟具有重要意义,但在疫苗接种面越来越广,防疫密度越来越高,免疫剂量加大和免疫次数增加的情况下,仍未能有效控制猪瘟的发生,而且,近年来不少猪场存在猪群免疫反应低下现象[4]。本试验中,对该规模化猪场母猪的猪瘟抗体水平进行检测,结果显示猪瘟疫苗的免疫效果一般,猪瘟抗体阳性率刚达到国家猪瘟强制免疫抗体合格率应保存在70%以上的要求[3]。抗体离散度依然偏高,猪群中个体之间的猪瘟抗体水平存在较大差异。
2)在规模化猪场实施以净化种猪为主的猪瘟综合防控措施是当前有效控制猪瘟的重要手段。目前,净化猪瘟的方法主要有抗体检测方法和病原检测方法。抗体检测方法即通过对猪群进行猪瘟抗体水平的检测,对首次猪瘟抗体检测不合格的所有猪只加强免疫猪瘟疫苗1次,4周后再次采血检测,对猪瘟抗体检测再次不合格的猪只进行淘汰。修金生等研究表明,淘汰加强免疫后猪瘟抗体水平不合格的种猪后,可以显著提高猪场母猪繁殖性能和小猪的生产性能[5]。病原检测方法即通过对猪群进行猪瘟病毒检测,淘汰阳性带毒猪,阴性猪进行加强免疫。周绪斌等通过采集活体的扁桃体,运用猪瘟免疫荧光技术检测猪瘟的方法净化猪瘟,经过2~3次净化,猪瘟阳性率下降至3%以下[6]。本试验采用ELISA技术和RT-PCR技术探讨猪瘟抗体水平和感染猪瘟野毒之间的关系。发现当猪瘟抗体阴性时,猪瘟病毒阳性率为14.3%,阻断率在30%~90%时,阳性率为2%,说明母猪当猪瘟抗体阴性时猪瘟病毒阳性率更高。一些研究也表明猪瘟病毒的隐性感染或持续性感染会干扰猪瘟疫苗的免疫效果,从而影响猪体的免疫保护力[7]。猪瘟病毒通过调节机体重要的共刺激分子和细胞因子的分泌,下调树突状细胞的成熟,使病毒逃逸宿主防御机制[8]。本试验也表明猪瘟免疫抗体水平合格也会感染猪瘟病毒,但感染率较低。覃绍敏等通过荧光抗体技术和ELISA方法也发现无论猪瘟免疫抗体水平是否合格,均有可能感染猪瘟野毒,感染率随着阻断率的升高而降低[9]。因此,在实际中猪瘟抗体水平只能体现猪群的免疫状况,并不能根据抗体水平高低来判断母猪是否感染猪瘟病毒。本研究还发现,猪瘟抗体阻断率大于90%时,猪瘟病毒阳性率最高。夏燕华等研究表明CSF抗体水平过高能抑制IFN启动子的活化,直接影响机体抗病毒的功能,是病毒建立持续感染的重要原因[10]。
3)以上结果表明,猪瘟抗体阴性组,以及抗体阻断率大于90%组中的猪瘟病毒阳性率较高,其结果为有效控制猪瘟提供重要科学依据。母猪感染猪瘟病毒后引起猪瘟抗体水平的变化是一个复杂的过程,在今后的研究中仍有待进一步探讨。
[1] 陈溥言.兽医传染病学[M].北京:中国农业出版社,2006:210-212.
[2] 涂宜强,简永利,白宇,等.浙江部分地区猪瘟流行现状的调查与分析[J].浙江农业学报,2013,25(4):728-732.
[3] 农业部.农医发(2013)8号:农业部关于印发《2013年国家动物疫病强制免疫计划》的通知[EB/OL].http://www. moa.gov.cn/zwllm/tzgg/tz/201303/t20130307_3248256. html.
[4] 赵永美,夏田,牛木存,等.云南部分规模化种猪猪瘟疫苗接种效果检测及分析[J].云南农业大学学报,2013,28(5):755-757.
[5] 修金生,吴顺意,周伦江,等.淘汰猪瘟抗体不合格种猪对母猪繁殖性能和仔猪生产性能的影响研究[J].中国农学通报,2010,26(20):1-6.
[6] 周绪斌,赵亚荣,许秀梅,等.规模化猪场猪瘟的净化与防制[J].养猪,2006(3):44-46.
[7] 胡永明,赵明秋,陈立军,等.猪瘟病毒感染对猪外周血T淋巴细胞亚群及TNF-α和IFN-γ的影响[J].中国预防兽医学报,2011,33(2):126-129.
[8] CHEN L J,DONG X Y,SHEN H Y,et al.Classical swine fever virus suppressed maturation and modulates functions of monocyte-derived dendritic cells without activating nuclear factor kappa B[J].Research in Veterinary science,2012,93(1):529-537.
[9] 覃绍敏,马玲,吴健敏,等.某规模化猪场猪瘟抗体水平及其野毒感染的检测与分析[J].黑龙江畜牧兽医,2011(9):92-94.
[10] 夏燕华,赵天生.猪瘟病毒对IFN-β启动子活化[J].南昌大学学报,2012,36(4):394-397.
The detection of CSF antibody and CSFV in a certain scale pig farm
Zhang Suqiang1Lin Weiming2Dai Ailing2Yang Xiaoyan2*
(1.Longyan Agricultural School,Fujian 364000;2.College of Life Sciences of Longyan University,Key Laboratory of Preventive Veterinary Medicine and Veterinary Biotechnology,Longyan,Fujian 364000)
To investigation the relationships between CSF antibody and CSFV,blood samples and tonsils were randomly collected from 57 sows in a certain scale pig farm.CSF antibody levels and CSFV were confirmed by ELISA and RT-PCR.The positive rate of CSF antibody was 74.7%and coefficient of variation of antibody was 41.79%.It indicated that the positive rate of CSF antibody just reached state specified standards.There were relationships between the CSF antibody level and CSFV.Sows may be infected with CSFV regardless of CSF antibody level.The positive rate of CSF antibody was high in CSF antibody-negative group and antibody blocking rate(more than 90%)group.
CSF antibody CSFV immunity effect
A
1003-4331(2014)01-0001-03
福建省科技计划重点项目(2013N0026)、龙岩市科技计划项目(2011LY18)资助。
张苏强,男,高级讲师。
