拟南芥AtLCR23基因组织表达分析
2014-03-02*
*
(1湖南农业大学生物科学技术学院,长沙410128;2湖南农业大学农学院,长沙410128)
拟南芥AtLCR23基因组织表达分析
易力雄1,郭磊2,周雅智1,刘春林2,阮颖1*
(1湖南农业大学生物科学技术学院,长沙410128;2湖南农业大学农学院,长沙410128)
AtLCR23是拟南芥LCR基因家族中一个功能未知基因。目前有限的研究表明,拟南芥LCR家族中部分蛋白参与了植物防御机制。本研究通过半定量RT-PCR检测,AtLCR23主要在开放的花和幼嫩果荚中表达。构建pAtLCR23::AtLCR23:GUS融合表达载体,并对转基因植株进行组织化学染色,结果表明:AtLCR23基因特异性表达于已授粉的花和幼嫩果荚的柱头,结合生物信息学分析,推测AtLCR23的功能可能与花粉识别相关。
拟南芥;AtLCR23;基因表达;RT-PCR;GUS染色
在拟南芥(Arabidopsis thaliana)中,LCR基因家族有86个成员,其家族蛋白通常含有一段信号肽序列,一般都属于分泌蛋白,且分子量较小,都不超过12 kDa[1]。多序列比对结果表明除都含有8个高度保守的半胱氨酸外,家族成员的同源性较低。LCR基因家族除LCR27和LCR71外,其他基因都在靠近5′端有一段长约75~275 bp的内含子序列[1]。据现有研究表明,拟南芥LCR基因家族包含一类DEFL(Defensin -like)蛋白,称为类防御蛋白,这一类蛋白与抗病原菌相关,又称为抗微生物肽[2]。DEFL蛋白是一种分布很广的蛋白,据统计,自然界的每一个物种体内都存在15~50个不同的防御蛋白[3,4]。在拟南芥中现在已经分离出了317个DEFL蛋白,其中有明确的注释且能表达完整的cDNA获得EST序列的蛋白占20%,确定具有防御功能的蛋白只有15个[5],其中有11个就属于LCR基因家族。
此外,LCR基因家族中还包含一些编码PCP蛋白(Pollen coat protein)的成员。PCP蛋白是一种富含半胱氨酸的小分子量花粉外包壁蛋白,能与SLG和SLR1相互作用,使成熟的花粉可以粘着在柱头上顺利完成花粉管的萌发以及受精[6],避免了自交不亲和现象(self-incompatibility,SI)。孢子体自交不亲和性(sporophytic self-incompatibility,SSI)普遍存在于十字花科芸薹属植物中,通常是不亲和的花粉在柱头表面萌发受到了抑制[7]。分子水平上由S -位点复等位基因控制,当花药中编码的基因是SCR(S locus cysteine-rich protein)或SP11家族,同时柱头中编码的基因是SRK(S locus receptor kinase)家族时,自花授粉后会发生SSI现象[8]。拟南芥LCR基因家族中,包括AtLCR23在内大部分成员都编码了SLR1-BP(S locus-related glycoprotein 1 binding pollen coat protein domain)蛋白结构域,该结构域可以特异性识别SSI现象中与S-位点非连锁功能分子SLR1。SLR1(S locus-related glycoprotein 1)是一种大量存在于柱头乳突细胞中的分泌蛋白。Takayama等通过实验发现,反义SLR1转基因植物中当柱头SLR1含量下降时其花粉的粘着力也大大下降[9]。
但是,目前对LCR基因家族的功能研究总体仍不清楚,特别是拟南芥LCR基因的时空表达模式缺乏相关的研究和描述。为了研究AtLCR23基因组织表达定位,笔者通过RT-PCR检测与构建GUS融合表达载体pAtLCR23::AtLCR23:GUS,转化拟南芥哥伦比亚野生型(Col),并对转化植株进行GUS化学染色,确定了该基因的时空表达模式,为下一步功能研究提供线索。
1 材料与方法
1.1 材料
拟南芥(Arabidopsis thaliana)哥伦比亚生态型(Col),大肠杆菌(Escherichia coli)DH5α,根癌农杆菌(Agrobacterium tumefaciens)GV3101,表达载体pBI101、pMD-19,由湖南农业大学植物发育与表观遗传调控实验室提供。
1.2 方法
1.2.1 植物培养条件
将拟南芥Col种子播种于装有蛭石的小钵中,用1/10MS营养液灌浇浸透,保鲜膜封口,避光4℃处理约3 d,转移至光照培养室揭膜,生长条件是22~25℃,长日照(16 h光/8 h暗),定期浇灌营养液。1.2.2 RT-PCR检测AtLCR23在拟南芥不同组织中的表达
通过查询TAIR网站(http://www.arabidopsis. org/)AtLCR23基因cDNA序列,利用Primer Premier 5软件设计RT-PCR检测引物RTLCR23-F/RTL CR23R。引物序列分别为:
RTLCR23-F:5′-ATGGCCAACATATCATG GTCTCATTTTC-3′
RTLCR23R:5′-TTAACAATTATAAGTACACA CACAATTAGGAGT-3′
待拟南芥生长40~50 d,分别取Col野生型的根、茎、叶、花芽、花、开花后生长2、4、6、8 d的果荚,采用Trizol法[10]提取各个组织的总RNA,反转录成cDNA。用设计好的RT-PCR引物RTLCR23-F/RTLCR23R进行PCR检测,预期目的片段大小为234 bp。
1.2.3 pAtLCR23::AtLCR23:GUS表达载体构建
从TAIR网站查询到AtLCR23基因上游启动子区域序列及基因组全长序列,去除终止密码子(-976~+370 bp),设计扩增引物PLCR23-F/PL CR23-R,并在上下游引物5′端分别加上Xba I和BamH I酶切位点,PCR扩增预期扩增的目的片段大小为1 346 bp。克隆引物序列为:

TATTATTAGCCTTAAT-3′(下划线标记为Xba I酶切位点)

TATAAGTACACACACAATTAGGAGT-3′(下划线标记为BamH I酶切位点)
CTAB法[11]提取拟南芥叶片总DNA,以总DNA为模板,用引物PLCR23-F/PLCR23-R进行PCR扩增,回收目的片段,连接到TAKARA公司pMD-19载体上,通过热激法转化感受态大肠杆菌DH5α,PCR检测出阳性克隆送于测序。用Xba I、BamH I对测序正确的pMD-19-PLCR23和pBI101进行双酶切,回收目的片段和目的载体。T4连接酶16℃过夜连接。
1.2.4 拟南芥转化与GUS染色
提取质粒通过冻融法[12]将构建好的载体pAtL CR23::AtLCR23:GUS转化到根癌农杆菌GV3101中,进行菌落PCR鉴定和双酶切验证。挑选出阳性菌落放置于加有庆大霉素(30 mg/L)、卡那霉素(50mg/L)、利福平(100 mg/L)的YEB培养液中活化扩大。采用浸花法[13]转化Col野生型拟南芥。收集T0代种子播种于含有卡那霉素筛选浓度为30 mg/L的MS固体培养基上,长日照培养2周后将抗性苗移至含有营养液的蛭石中正常生长。
设计载体检测引物pBI101-F/pBI101-R,其中下游引物pBI101-R设计在载体GUS基因区域,预期片段大小为1 426 bp。引物序列分别为:
pBI101-F:5′-TGCACACTCTATTATTAGCCT TAAT-3′
pBI101-R:5′-CCGCATAATTACGAATATCT GCATC-3′
用CTAB法提取抗性植株叶片的总DNA,以总DNA为模板,用检测引物pBI101-F/pBI101-R进行PCR检测。
选取检测结果为阳性的植株进行GUS化学染色[14]处理,同时取相同生长状况的Col野生型拟南芥做对照。取新鲜组织,放于90%丙酮溶液中15 min,冰上操作。去除丙酮溶液,用超纯水洗涤1次,将组织转移到GUS染液中,500~700 mmHg真空抽气10 min,37℃染色3~6 h,染色后去除GUS染液,用70%乙醇37℃脱色5~10 h后观察。
2 结果与分析
2.1 AtLCR23基因在拟南芥不同组织中的表达情况
分别从Col野生型拟南芥的根、茎、叶、花芽、花和开花后生长2、4、6、8 d的果荚中提取总RNA,反转录成cDNA,以拟南芥ACTIN2为内参,通过RTPCR检测AtLCR23基因的表达情况。结果显示:AtL CR23在拟南芥正在开放的花中有较高的表达,在开花后生长2、4 d的果荚中有较弱的表达,在其他组织器官中都没有检测到基因转录产物,说明AtL CR23基因主要在已授粉的花中和幼嫩的果荚中特异性表达(图1)。

图1 拟南芥不同组织中AtLCR23基因的表达结果Fig.1 Expression of AtLCR23 gene in different tissues of Arabidopsis
2.2 GUS表达载体的构建及转化鉴定
为进一步确定AtLCR23基因时空表达模式,利用PCR克隆了AtLCR23基因上游启动子区域序列及基因组全长序列,连接到中间载体pMD-19送去测序。利用Xba I和BamH I双酶切pMD-19-PL CR23阳性克隆和pBI101,将目的片段连接到带有报告基因GUS的pBI101载体上,构建成了pAtL CR23::AtLCR23:GUS融合表达载体(图2)。为了验证载体的正确性,对pAtLCR23::AtLCR23:GUS进行Xba I和BamH I双酶切(图3)。结果显示:目的片段与预期结果相符,表明GUS表达载体构建成功。

图2 pAtLCR23::AtLCR23:GUS表达载体示意图Fig.2 Schematic diagram of pAtLCR23::AtLCR23:GUS

图3 pAtLCR23::AtLCR23:GUS表达载体双酶切检测Fig.3 Identification of pAtLCR23::AtLCR23:GUS vector by restriction enzyme digestion
注:M.Mark;1~2.pAtLCR23::AtLCR23:GUS经Xba I和BamH I双酶切;3.未酶切对照。
将构建好的pAtLCR23::AtLCR23:GUS表达载体通过农杆菌介导的浸花法转化Col野生型拟南芥,获取带有抗卡那霉素抗性的植株(图4)。移至蛭石中正常生长,并提取叶片总DNA,用检测引物pBI101-F/pBI101-R进行PCR检测(图5)。结果显示:转基因植株基因组序列中导入了目的片段。
图4 阳性植株筛选Fig.4 Screening of positive transformantskanam ycin-resistant seed lings
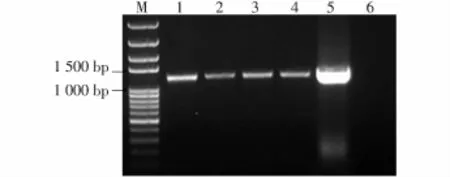
图5 GUS转化子检测Fig.5 Identification of GUS transformants
2.3 GUS染色定位AtLCR23基因表达
将筛选到的pAtLCR23::AtLCR23:GUS转基因植株进行GUS组织化学染色处理,分别选取生长5 d的幼苗整株染色,待植株生长约35 d取整个花序染色,以及开花后生长2、4、8 d果荚染色,同时以相同生长状态下的Col野生型拟南芥做为对照,结果如图6所示。从图6-A可以观察到在拟南芥营养生长阶段,AtLCR23基因在生长5 d的幼苗中各个组织中都没有表达,而在拟南芥生殖生长阶段的花中,且只在已经授粉的花的柱头有表达(图6-C),而在未授粉的花芽中没有表达(图6-C)。在成熟的花中主要在柱头表达,在花丝和花药中有微量的表达(图6-E)。此外还在开花后生长2、4 d的果荚(图6-I、M)柱头上有表达(图6-K、O),在生长8 d果荚中没有检测到表达(图6-Q、S)。综上所述,经GUS组织化学染色后,AtLCR23基因主要在授粉后成熟雌蕊的柱头上表达。
3 讨论
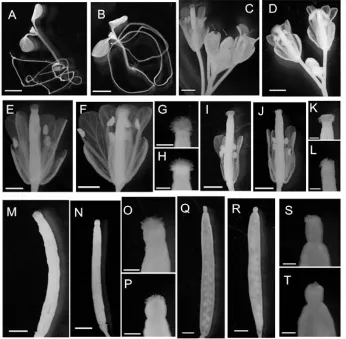
图6 pAtLCR23::AtLCR23:GUS在拟南芥各个组织中的表达情况Fig.6 Expression of pAtLCR23::AtLCR23:GUS in different tissues of Arabidopsis
自交不亲和性(self-incompatibility,SI)是植物特异性识别并抵制自身产生的花粉或亲缘关系较近的花粉,从而促进异花授粉的一种生殖隔离现象,由S位点复等位基因控制。现在研究比较清楚的是孢子体自交不亲和(简称SSI)现象,多发生于十字花科芸薹属中[15]。S-位点上的基因高度多样化,当花粉和雌蕊心皮上是同一个S-位点蛋白相互识别时就会引发自交不亲和反应,现在已经分离出3类与S-位点连锁的基因:位于雌蕊柱头中的SLG和SRK,以及位于花粉外包壁中的SCR/SP11[16]。此外调控SSI现象还有一些与S位点非连锁的功能分子,其中SLR1是由S基因家族编码的一种分泌型蛋白,大量存在雌蕊柱头乳突细胞中,其功能是参与花粉识别柱头时所需粘着力大小相关,且SLR的一级结构与雌蕊S基因编码的分泌型柱头特异识别糖蛋白SLG十分相似。在Takayama[9]等研究中发现并纯化出两种与SLR1特异性识别的结合蛋白SLR1-BP1、SLR1-BP2。而在LCR基因家族中,包括AtLCR23基因在内,绝大部分基因都编码了SLR1-BP蛋白结构域。笔者在本研究中通过RT-PCR检测到AtLCR23主要在已授粉花和幼嫩果荚中有表达,而后构建了GUS融合表达载体,转化并进行GUS化学染色,观察到AtLCR23具体在已授粉花的柱头及花丝花药中和发育前期果荚的柱头上有表达,进一步验证了前面RT-PCR的结果。综上所述,本研究鉴定出了AtLCR23组织表达模式,推测AtLCR23的功能可能与花粉识别机制相关,为进一步揭示LCR基因家族功能提供参考线索。
[1] Vincent V,Christine M,Christian D,et al.Two large Arabidopsis thaliana gene families are homologous to the Brassica gene superfamily that encodes pollen coat proteins and themale component of the self-incompatibility response[J].Plant Molecular Biology,2001,16:17-34.
[2] Kevin ATS,Michelle AG,Timothy DP,et al.Genome organization ofmore than 300 defensin-like genes in Arabidopsis[J].Plant Physiology,2005,138:600-610.
[3] Beutler B.Innate immunity:an overview[J].Mol Immunol,2004,40:854-859.
[4] Bulet P,Stocklin R,Menin L.Anti-microbial peptides:from invertebrates to vertebrates[J].Rev Immunol,2004,198:169-184.
[5] Thomma BP,Cammue BP,Thevissen K.Plant defensins[J].Planta,2002,216:193-202.
[6] Doughty J,Wong H,Dickinson HG.Cysteine-rich pollen coat proteins(PCPs)and their interactions with stigmatic33S(incompatibility)and S-related proteins in Brassica:putative roles in SI and pollination[J].Ann Bot,2000,85:161-169.
[7] Murase K,Shiba H,Lwan M,et a1.Membrane-anchored protein kinase involved in Brassica self-incompatibility signaling[J].Science,2004,303:l5l6-15l9.
[8] Doughty J,Dixon S,Hiscock SJ,et al.A defensin-like Brassica pollen coat protein that binds the S locus glycoprotein is the product of gametophytic gene expression[J].Plant Cell,1998,10:1333-1347.
[9] Takayama S,Shiba H,Iwano M,et al.Isolation and characterization of pollen coat proteins of Brassica campestris that interactwith S locus-related glycoprotein 1 involved in pollen-stigma adhesion[J].Proc Natl Acad Sci USA,2009,97:3765-3770.
[10]李 敏,杨 双,阮燕晔,等.拟南芥T-DNA插入突变体atsuc3的PCR鉴定[J].植物生理学通讯,2006,42(1):91-94.
[11]杨立匡,杨 晶.5种常见植物DNA提取效率的比较[J].生物学通讯,2012,47(9):44-46.
[12]张边江,陈全战.质粒导入不同农杆菌冻融法的讨论[J].湖北农业科学,2007,46(3):329-331.
[13]王爱荣,吴智芳,张丽丽,等.影响拟南芥转化效率和激活标签丢失的因素分析[J].福建农林大学学报,2006,35(3):298-303.
[14]Gallagher SR.GUS Protocols:Using the GUSGene as A Reporter of Gene Expression[M].New York:Aeademic Perss,1992.103-113.
[15]吴华清,张绍铃,李 晓,等.植物自交不亲和性的分子生物学进展[J].南京农业大学学报,2006,29(4):119-126.
[16]Nunes MDS,Santos RAM,Ferreira SM,et a1.Variability patterns and positively selected sites at the gametophytic self-incompatibility pollen SFB gene in a wild self-incompatible Pmnus spinosa(Rosaceae)populationl[J]. New Phytol,2006,172:577-587.
Expression Analysis of AtLCR23 Gene in Arabidopsis thaliana
YILi-xiong1,GUO Lei2,ZHOU Ya-zhi1,LIU Chun-lin2,RUAN Ying1*
(1 College of Bioscience and Biotechnology,Hunan Agricultural University,Changsha,Hunan 410128,China;
2 College of Agronomy,Hunan Agricultural University,Changsha,Hunan 410128,China)
AtLCR23 is a function unknown gene which belong to LCR families in Arabidopsis.Currently limited researches showed a partof LCR proteinswere involved in plant defensemechanisms.Semi-quantitative RT-PCR confirmed AtLCR 23 mainly expressed in opening flowers and young siliques.Construction of pAtLCR23::AtLCR23:GUS reporter line and histochemical staining of transgenic plants showed that AtLCR23 was specific expressed in stigma of pollinated flowers and young siliques.Combined with bioinformatics analysis,the results showed the function of AtLCR23 may be associated with pollen identification.
Arabidopsis thaliana;AtLCR23;Gene expression;RT-PCR;GUS-staining
Q786
A
1001-5280(2014)03-0246-05 DOI:10.3969/j.issn.1001-5280.2014.03.04
2014 03 12
易力雄(1988-),男,湖南娄底人,硕士研究生,Email:xiong-mao.168@163.com。*通信作者,阮颖,教授,Email:yingruan@htomail.com。
国家自然科学基金项目(31071455)。
