法舒地尔对高糖培养肾小管上皮细胞增殖和纤维化的影响
2014-03-01顾玲佳倪连松
顾玲佳,倪连松
(1.台州市第一人民医院 内分泌科,浙江 台州 318020;2.温州医科大学附属第一医院 内分泌科,浙江 温州 325015)
法舒地尔对高糖培养肾小管上皮细胞增殖和纤维化的影响
顾玲佳1,倪连松2
(1.台州市第一人民医院 内分泌科,浙江 台州 318020;2.温州医科大学附属第一医院 内分泌科,浙江 温州 325015)
目的:探讨法舒地尔(Fasudil)对高糖培养的肾小管上皮细胞(HK-2)增殖和纤维化的影响。方法:将HK-2细胞分为正常对照组(NG组,葡萄糖浓度5.5 mmol/L)、高张组(HM组,葡萄糖浓度5.5 mmol/L+甘露醇54.5 mmol/L)、高糖组(HG组,葡萄糖浓度60 mmol/L)、高糖+小剂量法舒地尔干预组[FA(5)组,D-葡萄糖60 mmol/L+法舒地尔5μmol/L]、高糖+中剂量法舒地尔干预组[FA(10)组,D-葡萄糖60 mmol/L+法舒地尔10μmol/L];⑥高糖+大剂量法舒地尔干预组[FA(20)组,D-葡萄糖60 mmol/L+法舒地尔20μmol/ L]。四甲基偶氮唑盐(MTT)法测定HK-2细胞增殖;免疫共沉淀法检测p-MYPT1-Thr853;Western印迹法检测结缔组织生长因子(CTGF)的表达;ELISA法检测细胞培养上清液转化生长因子β1(TGF-β1)和纤维连接蛋白(Fn)的含量。结果:与NG组比,HG组HK-2细胞出现增殖增加,p-MYPT1-Thr853、TGF-β1、CTGF和Fn的表达增加。与HG组比,FA(5)组、FA(10)组、FA(20)组均抑制了HK-2细胞的过度增殖,p-MYPT1-Thr853、TGF-β1、CTGF和Fn的表达均减少。结论:法舒地尔可能通过抑制Rho激酶活性抑制高糖培养的肾小管上皮细胞增殖和纤维化。
法舒地尔;肾小管上皮细胞;纤维化;糖尿病肾病
近年来,随着对RhoA/ROCK信号通路研究的加深,该信号通路在糖尿病肾病(diabetic nephropathy,DN)中的作用引起了人们的高度重视。法舒地尔(Fasudil)是目前在临床中最常用的ROCK抑制剂。但是,目前ROCK信号通路在DN中的研究主要集中在肾小球和系膜细胞。因此,我们以高糖模拟糖尿病条件,以不同浓度的法舒地尔作干预实验,观察法舒地尔对高糖培养的人肾小管上皮细胞(human renal tubular epithelial cells,HK-2)增殖和纤维化的影响,以评估法舒地尔在DN防治中的作用,并为其进一步的临床应用提供理论依据。
1 材料和方法
1.1 细胞、试剂及仪器 HK-2细胞购自武汉大学中国典型培养物保藏中心,CCTCC编号:GDC152。盐酸法舒地尔注射液购自天津红日药业股份有限公司(产品批号:091114);DMEM培养液和胎牛血清购自美国Gibco公司;MTT购自美国Sigma公司;鼠抗人结缔组织生长因子(connective tissue growth factor,CTGF)、ROCK抗体及兔抗人p-MYPT1-Thr853购自美国Cell Signaling公司;免疫共沉淀试剂盒、HRP标记二抗购自江苏碧云天生物技术研究所;Fn ELISA试剂盒购自上海西唐公司产品;酶标仪为Thermo公司产品,Imaglab凝胶成像系统为Bio-Rad公司产品。
1.2 HK-2细胞培养及分组 HK-2细胞常规培养在含10%胎牛血清、100 U/mL青霉素、100 U/mL链霉素的低糖(5.5 mmol/L D-葡萄糖)DMEM培养液中,置于37 ℃、5% CO2培养箱中培养,2~3 d换液1次。为了诱导纤维化,HK-2细胞在60 mmol/L高糖条件下培养24、48、72 h,该葡萄糖浓度是通过预实验得到,时间选择参考文献[7]。
将HK-2细胞分为6组:①正常对照组(NG组,D-葡萄糖5.5 mmol/L);②高张组(HM组,D-葡萄糖5.5 mmol/L+甘露醇54.5 mmol/L);③高糖组(HG组,D-葡萄糖60 mmol/L);④高糖+小剂量法舒地尔干预组[FA(5)组,D-葡萄糖60 mmol/L+法舒地尔5 μmol/L];⑤高糖+中剂量法舒地尔干预组[FA(10)组,D-葡萄糖60 mmol/L+法舒地尔10μmol/L];⑥高糖+大剂量法舒地尔干预组[FA(20)组,D-葡萄糖60 mmol/L+法舒地尔20μmol/L]。
1.3 MTT法检测HK-2细胞增殖 收集对数生长期细胞消化后制成细胞悬液,按2×104/mL接种于96孔板中,细胞贴壁后更换为无血清培养液同步培养24 h,按实验分组换为不同的培养液,设6个复孔/组,培养24 h。在培养终止前4 h每孔加入MTT(5 mg/ mL)20μL继续孵育4 h,然后弃上清液,每孔加入二甲基亚砜150μL终止反应,震荡混匀使结晶物充分溶解。在酶标仪波长490 nm处测量各孔的吸光值(OD值)。加法舒地尔组在实验前均用锥虫蓝染色观察,活细胞数均大于95%,排除法舒地尔的细胞毒性作用。
1.4 免疫共沉淀法检测HK-2细胞ROCK活性 HK-2细胞接种在10 cm细胞培养皿中,细胞培养贴壁生长至100%融合后,更换为无血清培养液同步培养24 h,按实验分组换为不同的培养液。在我们之前的研究中发现,HK-2细胞在60 mmol/L的高糖中培养12 h后p-MYPT1-Thr853蛋白表达最多,故我们选择培养12 h。12 h后终止培养,裂解细胞后,收集裂解液于4 ℃,17 949×g离心30 min后收集上清,取50μL上清用于检测总ROCK的表达并作为内参照,余上清加入10μL p-MYPT1-Thr853的一抗,4 ℃摇床过夜,再加入充分混匀的蛋白A+G琼脂糖4 ℃摇床2 h以沉淀免疫复合物,用预冷的PBS洗涤沉淀3次,完成最后一次洗涤后,去除上清,加入1×SDSPAGE电泳上样缓冲液。变性后取50μL样本行10% SDS-PAGE电泳,Western印迹法检测p-MYPT1-Thr853的表达。Imagelab软件分析结果,以所测得的各条带的吸光度(integrated absorbance,IA)与相应总ROCK的IA的比值作为ROCK活性值。
1.5 Western印迹法检测HK-2细胞CTGF的表达 HK-2细胞接种于10 cm细胞培养皿中,细胞培养贴壁生长至70%融合后,更换为无血清培养液同步培养24 h,按实验分组换为不同的培养液。72 h后终止培养,裂解细胞后,收集裂解液于4 ℃,17 949×g离心30 min,取上清用BCA蛋白浓度测定法测定蛋白浓度,操作按说明书。5×(5倍浓缩)蛋白上样缓冲液变性蛋白。取总蛋白60μg上样,用10%的SDSPAGE凝胶进行电泳后,恒流将蛋白转印至PVDF膜。用含5%脱脂牛奶的TBST室温摇床封闭2 h,加入一抗:小鼠抗人CTGF(1∶200)、β-actin(1∶2 000),4 ℃孵育过夜。TBST洗膜后分别加入相应的HRP标记的二抗(1∶1 000),室温摇床孵育1 h,TBST洗膜后分别取等量ECL试剂盒溶液A和B液,混合后加于PVDF膜,避光反应1 min,Bio-Rad公司Molecular Imager ChemiDoc XRS+成像系统自动曝光扫描并用Imagelab软件对条带进行分析,以所测得的各条带的吸光度与内参照β-actin的吸光度的比值作为最终结果进行统计分析。
1.6 ELISA法检测细胞培养上清液转化生长因子β1(transforming growth factor-β1,TGF-β1)和纤维连接蛋白(fibronectin,Fn)含量 收集培养24、48、72 h细胞上清液于4 ℃,4 142×g离心3 min后用ELISA法检测Fn,具体操作参见试剂盒说明书。收集细胞冰上裂解后离心,收集上清用BCA蛋白浓度测定法测定蛋白浓度,操作按说明书进行,以矫正ELISA法检测结果。
1.7 统计学处理方法 应用SPSS17.0统计软件进行统计学分析。数据用±s表示,组间差异用单因素方差分析,有显著差异者用LSD-t检验进行两两比较。P<0.05为差异有统计学意义。
2 结果
2.1 法舒地尔对高糖培养的HK-2细胞增殖的影响
与NG组比,HG组的OD值显著增大(P<0.01),提示高糖可明显促进HK-2细胞增殖。与HG组比,3个不同浓度的高糖+法舒地尔组的OD值均显著下降(均P<0.01),且与法舒地尔呈浓度依赖性,提示法舒地尔可明显抑制高糖的促增殖作用。见表1。
表1 法舒地尔对高糖培养的HK-2细胞增殖的影响(n=6,±s)

表1 法舒地尔对高糖培养的HK-2细胞增殖的影响(n=6,±s)
与NG组比:aP<0.01;与HG组比:bP<0.01
组别 OD值NG组0.65±0.02 HM组0.64±0.05 HG组0.81±0.03aFA(5)组0.76±0.02abFA(10)组0.71±0.02abFA(20)组0.66±0.02b
2.2 法舒地尔对高糖培养的HK-2细胞ROCK活性的影响 图1显示,与NG组比较,HG组HK-2细胞p-MYPT1-853蛋白表达明显增加,差异有统计学意义(P<0.01),HM组差异无统计学意义(P>0.05)。与HG组比较,高糖+法舒地尔干预组p-MYPT1-853蛋白表达均减少(均P<0.01),且与法舒地尔呈浓度依赖性,提示法舒地尔可以抑制高糖培养的HK-2细胞ROCK活性。

图1 法舒地尔对高糖培养的HK-2细胞ROCK活性的影响
2.3 法舒地尔对高糖培养的HK-2细胞TGF-β1、CTGF、Fn表达的影响 见表2-3。与NG组比较,HG组HK-2细胞培养24、48或72 h后细胞上清液中TGF-β1和Fn表达均增加,且随着时间的延长而增加(P<0.01),HM组差异无统计学意义(P>0.05)。与HG组比较,FA(20)组同步干预24、48或72 h后TGF-β1和Fn表达均减少(均P<0.01)。
图2显示,与NG组比较,HG组HK-2细胞培养72 h后CTGF表达明显增多,差异具有统计学意义(P<0.01),HM组差异不具有统计学意义(P>0.05)。与HG组比较,3个不同浓度的法舒地尔同步干预72 h后CTGF表达均减少(均P<0.01),且与法舒地尔呈浓度依赖性。
表2 法舒地尔对高糖培养的HK-2细胞TGF-β1表达的影响(n=6,±s,μg·g-1)

表2 法舒地尔对高糖培养的HK-2细胞TGF-β1表达的影响(n=6,±s,μg·g-1)
与NG组比:aP<0.05,bP<0.01;与HG组比:cP<0.01
组别TGF-β124 h 48 h 72 h NG组47.18±4.43102.46±2.56116.02±5.21 HM组45.23±4.19 96.69±4.22114.12±4.93 HG组75.99±4.73b124.37±5.72b350.95±3.20bFA(20)组59.40±6.47ac95.33±3.94c207.18±8.04bc
表3 法舒地尔对高糖培养的HK-2细胞Fn表达的影响(n=6,±s,μg·g-1)
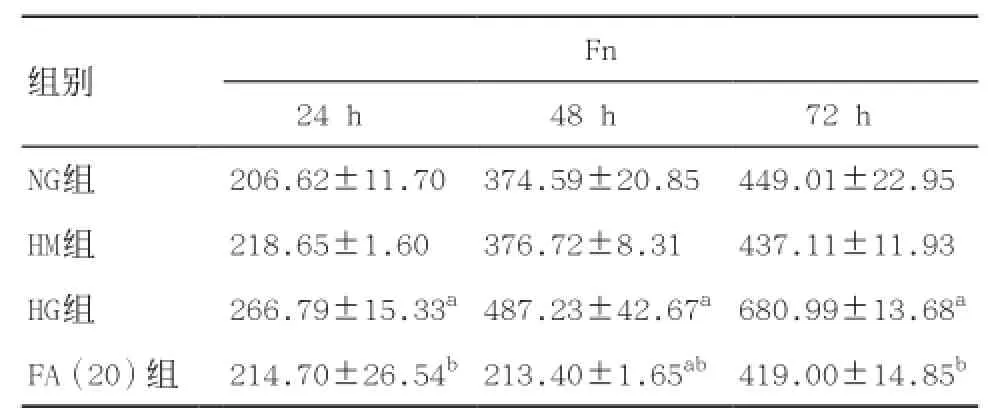
表3 法舒地尔对高糖培养的HK-2细胞Fn表达的影响(n=6,±s,μg·g-1)
与NG组比:aP<0.01;与HG组比:bP<0.01
组别Fn 24 h 48 h 72 h NG组206.62±11.70374.59±20.85449.01±22.95 HM组218.65±1.60376.72±8.31437.11±11.93 HG组266.79±15.33a487.23±42.67a680.99±13.68aFA(20)组214.70±26.54b213.40±1.65ab419.00±14.85b
3 讨论
DN的发病机制十分复杂,目前尚未完全清楚。在DN中最早出现的变化是肾脏体积的增大,肾小管上皮细胞的肥大和增殖对整个肾脏体积的增大起着至关重要的作用。在本实验中,我们用60 mmol/L的高糖作用于HK-2细胞,发现24 h后高糖明显促进了HK-2细胞的增殖,从而引起DN的发生、发展。本研究结果与Wolf等[1]一致。

图2 法舒地尔对高糖培养的HK-2细胞CTGF表达的影响
TGF-β1是公认致纤维化的细胞因子,在DN的发生和发展中起重要作用[2]。CTGF是近年来发现与纤维化密切相关的细胞因子,它作为TGF-β1的主要下游因子,通过促进细胞外基质合成,抑制细胞外基质降解从而引起纤维化的发生[3]。Fn是细胞外基质的主要成分之一,它的过度聚积使基质排列紊乱,从而使间质发生纤维化。
在本实验中,我们发现HK-2细胞在60 mmol/L高糖条件下培养一段时间,TGF-β1、CTGF和Fn的表达均明显增多,表明纤维化在DN的发生、发展中起重要作用。且随着高糖作用时间的延长,TGF-β1和Fn的表达显著增多,这将导致纤维化逐渐加重,最终进展为终未期肾病。因此,抑制纤维化将成为治疗DN的重要策略。
近年来,RhoA/ROCK信号通路在DN中的作用引起了人们的高度重视。目前有关RhoA/ROCK信号通路在DN中的研究大多集中在肾小球和系膜细胞[4-7],如Danesh等[4]研究发现高糖培养24 h后大鼠肾小球系膜细胞Rho-GTP和Ras-GTP的表达明显增加,但是越来越多的证据表明肾小管间质病变的严重程度与肾功能的进行性下降有着更为紧密的联系[8-10]。法舒地尔是ROCK选择性抑制剂,是目前唯一用于临床的ROCK抑制剂,通过与ATP竞争ROCK催化区的ATP结合位点,而抑制ROCK的活性[11]。它对DN的保护作用已经在多种糖尿病动物模型中得到证实[12-15]。
在本实验中,我们研究了ROCK信号通路在高糖培养的HK-2细胞中的作用,结果发现HK-2细胞在60 mmol/L的高糖中培养12 h后p-MYPT1的蛋白表达明显升高,说明ROCK存在功能的活化,表明高糖能使HK-2细胞ROCK信号通路激活。本实验还发现法舒地尔能明显抑制ROCK的表达。同时我们发现,高糖组给予不同浓度法舒地尔处理后,能显著抑制HK-2细胞的异常增殖,降低TGF-β1、CTGF和Fn的表达,提示法舒地尔通过抑制ROCK信号通路抑制细胞增殖,并下调高糖导致的致纤维化因子的表达,从而减轻肾小管上皮细胞纤维化程度。
综上所述,高糖环境能明显刺激肾小管上皮细胞增殖和纤维化,并激活细胞内ROCK信号通路;ROCK抑制剂法舒地尔能有效抑制高糖环境下肾小管上皮细胞过度增殖,抑制纤维化反应,提示法舒地尔对防治肾小管间质纤维化和延缓DN的进程可能起到较好的作用。我们的研究为法舒地尔的肾脏保护作用提供了更多的理论依据,但其中的有关机制还需要大量体内体外实验来阐明。
[1] Wolf G. Molecular mechanisms of diabetic mesangial cell hypertrophy: a proliferation of novel factors[J]. J Am Soc Nephrol, 2002, 13(10): 2611-2613.
[2] Chou CH, Chuang LY, Lu CY, et al. Interaction between TGF-β and ACE2-Ang-(1-7)-Mas pathway in high glucosecultured NRK-52E cells[J]. Mol Cell Endocrinol, 2013, 366 (1): 21-30.
[3] Okada H, Kikuta T, Kobayashi T, et al. Connective tissue growth factor expressed in tubular epithelium plays a pivotal role in renal fbrogenesis[J]. J Am Soc Nephrol, 2005, 16(1): 133-143.
[4] Danesh FR, Sadeghi MM, Amro N, et al. 3-Hydroxy-3-methylglutaryl CoA reductase inhibitors prevent high glucose-induced proliferation of mesangial cells via modulation of Rho GTPase/p21 signaling pathway: implications for diabetic nephropathy[J]. Proc Natl Acad Sci USA, 2002, 99(12): 8301-8305.
[5] Peng F, Wu D, Gao B, et al. RhoA/Rho-kinase contribute to the pathogenesis of diabetic renal disease[J]. Diabetes, 2008, 57(6): 1683-1692.
[6] 马东蔚, 王秋月, 马小羽, 等. 法舒地尔通过Rho/ROCK信号通路对高糖培养人肾小球系膜细胞炎症反应及纤维化的影响[J]. 中华内科杂志, 2011, 50(7): 580-584.
[7] Kolavennu V, Zeng L, Peng H, et al. Targeting of RhoA/ ROCK signaling ameliorates progression of diabetic nephropathy independent of glucose control[J]. Diabetes, 2008, 57(3): 714-723.
[8] Nangaku M. Mechanisms of tubulointerstitial injury in the kidney: fnal common pathways to end-stage renal failure[J]. Intern Med, 2004, 43(1): 9-17.
[9] Gu L, Gao Q, Ni L, et al. Fasudil inhibits epithelial-Myofibroblast transdifferentiation of human renal tubular epithelial HK-2 cells induced by high glucose[J]. Chem Pharm Bull, 2013, 61(7): 688-694.
[10] 吴甘霖, 贾汝汉, 肖圣顺, 等. 贝尼地平对糖尿病大鼠肾脏保护作用的机制探讨[J]. 中华糖尿病杂志, 2010, 2(4): 281-285.
[11] Wettschureck N, Offermanns S. Rho/Rho-kinase mediated signaling in physiology and pathophysiology[J]. J Mol Med, 2002, 80(10): 629-638.
[12] Gojo A, Utsunomiya K, Taniguchi K, et al. The Rho-kinase inhibitor, fasudil, attenuates diabetic nephropathy in streptozotocin-induced diabetic rats[J]. Eur J Pharmacol, 2007, 568 (1-3): 242-247.
[13] Xie X, Peng J, Chang X, et al. Activation of RhoA/ROCK regulates NF-κB signaling pathway in experimental diabetic nephropathy[J]. Mol Cell Endocrinol, 2013, 369(1-2): 86-97.
[14] Komers R, Oyama TT, Beard DR, et al. Rho kinase inhibition protects kidneys from diabetic nephropathy without reducing blood pressure[J]. Kidney Int, 2011, 79(4): 432-442.
[15] Wu G, Tu Y, Jia R. The infuence of fasudil on the epithelial-mesenchymal transdifferentiation of renal tubular epithelial cells from diabetic rats[J]. Biomed Pharmacother, 2010, 64 (2): 124-129.
(本文编辑:胡苗苗)
Infuence of fasudil on the proliferation and fbrosis of renal tubular epithelial cells incubated with high glucose
GU Lingjia1, NI Liansong2.
1.Department of Endocrinology, Taizhou First People’s Hospital, Taizhou, 318020; 2.Department of Endocrinology, the First Affliated Hospital of Wenzhou Medical University, Wenzhou, 325015
Objective:To investigate the influence of fasudil on the proliferation and fibrosis of human renal tubular epithelial cells incubated with high glucose.Methods:HK-2 cells were divided into normal control group (D-glucose 5.5 mmol/L), high tension group (D-glucose 5.5 mmol/L+54.5 mmol/L mannitol), high glucose group (D-glucose 60 mmol/L), high glucose+fasudil treatment group (the concentrations of fasudil were 5, 10 and 20 μmol/L). Cell proliferation was assessed with MTT assay. Changes in the p-MYPT1-Thr853 were detected with co-immunoprecipitation assay. The expression of connective tissue growth factor (CTGF) was detected with western blot, the protein content of transforming growth factor-β1(TGF-β1) and fbronectin (Fn) in the supernatant were detected by ELISA.Results:Compared with normal control group, cell proliferation and the expression of p-MYPT1-Thr853, TGF-β1, CTGF and Fn were signifcantly increased in high glucose group. Compared with high glucose group, cell proliferation and the expression of p-MYPT1-Thr853, TGF-β1, CTGF and Fn were signifcantly decreased in fasudil treatment group.Conclusion:Fasudil can inhibit high glucose-induced proliferation and fbrosis of HK-2 and it may produce effect through the inhibition of Rho kinase activity.
fasudil; renal tubular epithelial cells; fbrosis; diabetic nephropathy
R965.2
A
1000-2138(2014)10-0723-05
2013-08-27
温州市科技局科研基金资助项目(Y20100020)。
顾玲佳(1986-),女,浙江台州人,住院医师,硕士。
倪连松,主任医师,硕士生导师,Email:nils1014@ 163.com。
