胃癌组织中人巨细胞病毒感染及其临床意义
2014-03-01金劲激涂建欣吴明马海广沈贤薛向阳
金劲激,涂建欣,吴明,马海广,沈贤,薛向阳
(1.温州医科大学附属第一医院 胃肠外科,浙江 温州 325015;2.温州医科大学附属第一医院 风湿免疫科,浙江 温州 325015;3.温州医科大学附属第一医院 消化内科,浙江 温州 325015;4.温州医科大学 分子病毒与免疫研究所,浙江 温州 325035)
·论著·
胃癌组织中人巨细胞病毒感染及其临床意义
金劲激1,涂建欣2,吴明3,马海广1,沈贤1,薛向阳4
(1.温州医科大学附属第一医院 胃肠外科,浙江 温州 325015;2.温州医科大学附属第一医院 风湿免疫科,浙江 温州 325015;3.温州医科大学附属第一医院 消化内科,浙江 温州 325015;4.温州医科大学 分子病毒与免疫研究所,浙江 温州 325035)
目的:初步探讨人巨细胞病毒(HCMV)感染与胃癌的关系。方法:采用化学发光(CLIA)法对胃癌组(n=80)及健康对照组(n=80)的外周血清进行HCMV IgG、IgM抗体检测;巢式PCR技术检测22例胃癌患者的肿瘤及癌旁正常胃黏膜组织标本中的HCMV UL55基因;统计分析HCMV感染与胃癌临床特征的关系。结果:胃癌组血清HCMV-IgG阳性率为95%(76/80),HCMV-IgM阳性率为6.25%(5/80);在健康对照组血清中,HCMV-IgG阳性率为97.5%(78/80),HCMV-IgM阳性率为3.75%(3/80),HCMV IgG、IgM在胃癌组与健康对照组血清中差异无统计学意义(P>0.05)。HCMV UL55阳性检出率在22例胃癌组织中为50%(11/22),在相应正常胃黏膜组织中为9.09%(2/22),胃癌组织HCMV阳性检出率较癌旁正常组织显著升高(P<0.01)。此外,未发现HCMV感染与胃癌的TMN分期、组织病理分化及肿块大小有显著性关联。结论:胃癌组织中存在HCMV感染,且HCMV相较于癌旁正常组织更倾向感染癌灶,提示HCMV感染可能参与胃癌的发生发展过程。
胃肿瘤;人巨细胞病毒;UL55
人巨细胞病毒(human cytomegalovirus,HCMV)属于疱疹病毒科β属双链DNA,以潜伏感染状态长期甚至终生存在于人体内,在亚洲和非洲的部分地区感染率接近100%[1-2]。绝大部分患者常表现为无症状感染,但在艾滋病患者、器官移植患者及免疫功能低下的个体可出现病毒活化,表现为明显临床症状,如肺炎、肠炎、器官排斥等[3-4]。近年来,HCMV感染与恶性肿瘤发生发展的关系引起了广泛关注。已有研究表明HCMV感染与神经胶质瘤、前列腺癌等恶性肿瘤的形成有密切联系[5-6],但其与胃癌的相关性研究鲜有报道。本研究首先检测胃癌患者血清中特异性IgG及IgM抗体,评价胃癌患者HCMV感染情况,随后通过HCMV UL55基因的巢式PCR检测,分析22例胃癌组织及相应癌旁正常黏膜HCMV感染情况,并探讨HCMV胃黏膜感染与胃癌临床特征之间的相关性。
1 材料和方法
1.1 标本来源
1.1.1 血清标本:80例经胃镜及组织病理学检查确诊的胃癌患者(胃癌组)血清采自2012年3月至2012年6月本院住院患者,其中男53例,女27例,年龄49~81岁,平均(64.32±9.70)岁。并在同时期本院健康体检中心收集80例[男48例,女32例,年龄45~79岁,平均(62.82±8.99)岁]年龄性别相匹配的健康对照(健康对照组)血清。所有血清标本于-20 ℃保存备用。
1.1.2 组织标本:所有的组织标本来自于2011年6月至2012年6月在本院胃肠外科行手术治疗的胃癌患者22例,男15例,女7例,年龄42~80岁,平均(66.8±9.47)岁。每例标本留取肿瘤以及相应的正常胃黏膜组织(距肿瘤组织5 cm以上),标本于离体后30 min内保存在液氮中备用。所有患者术前均未行放、化疗等治疗,术后组织病理确诊后按照2012 NCCN指南进行TMN分期。
1.2 材料和试剂 组织基因组DNA提取试剂盒、琼脂糖凝胶DNA回收试剂盒购自天根生化科技有限公司;KOD-plus试剂盒购自日本Toyobo公司;pMD19-T连接试剂盒购自TaKaRa公司;E.coli DH 5α菌株由本实验室保存;引物由本实验室设计并委托上海生工生物工程有限公司合成。
1.3 方法
1.3.1 血清HCMV IgG、IgM抗体检测:采用德国罗氏公司Cobas 8000分析系统及配套试剂盒用化学发光法进行血清HCMV IgG、IgM抗体检测,操作步骤严格参照试剂盒说明书,空白对照、阴性对照及阳性对照均来自试剂盒。
1.3.2 胃癌组织DNA提取:标本DNA提取步骤参照组织基因组DNA提取试剂盒说明书。所有提取的组织DNA经分光光度计测浓度后保存于-20 ℃备用。
1.3.3 胃癌组织HCMV感染检测:UL55基因编码的糖蛋白B(gB)是HCMV一个不可缺少的、高度保守的基因。为此,本研究选择UL55基因作为HCMV检测的目的基因,根据文献[7]报道的检测引物,将提取的组织DNA进行巢式PCR鉴定。第一轮PCR反应体系为: DNA模板1μL,Kod-plus酶0.5μL,10×buffer 2.5μL,2.5 mmol/L dNTPs 2.5μL,25 mmol/L MgSO41μL,20μmol/L外引物各1μL,ddH2O 15.5 μL。反应条件为:94 ℃预变性5 min;94 ℃变性15 s,58 ℃退火15 s,68 ℃延伸15 s,共30个循环;最后68 ℃延伸5 min。第二轮PCR反应体系为:第一轮PCR产物1μL,Kod-plus 0.5μL,10×buffer 2.5μL,2.5 mmol/L dNTP 2.5μL,25 mmol/L MgSO41μL,20μmol/L内引物各1μL,ddH2O 15.5μL,反应条件同第一轮PCR条件。两轮PCR结束后,2%琼脂糖凝胶电泳分离鉴定PCR扩增产物,0.1 mg/mL EB染色,260 nm紫外成像。并将扩增目的片段进行琼脂糖凝胶DNA回收,步骤参照试剂盒说明书。回收后连于pMD19-T载体,并转化至E.coli DH 5α感受态细胞内,挑取阳性单克隆并用M13通用引物鉴定后,送上海生工生物工程有限公司测序鉴定。
1.4 统计学处理方法 采用SPSS 17.0统计学软件进行统计学处理。2组之间阳性率比较采用x2检验(如肿瘤与癌旁组织、不同年龄、性别、肿瘤大小之间HCMV感染阳性率比较);等级资料之间阳性率比较采用秩和检验(如TMN分期、组织病理分化类型之间HCMV感染阳性率比较)。P<0.05为差异有统计学意义。
2 结果
2.1 胃癌及正常对照标本HCMVIgG、IgM抗体检测结果 胃癌组与健康对照组血清HCMVIgG、IgM特异性抗体阳性率比较差异无统计学意义(P>0.05)。见表1。
2.2 HCMV UL55检测特异性分析 本实验通过巢式PCR对胃癌及其癌旁正常组织中的HCMV UL55基因进行扩增,可见部分组织DNA经两轮PCR后在2%琼脂糖凝胶中可出现特异性条带(见图1A),并通过进一步测序鉴定验证巢式PCR的特异性(见图1B)。

表1 胃癌组及健康对照组血清标本HCMV IgG、IgM抗体阳性率检测结果(n=80,n/%)

图1 HCMV UL55巢式PCR检测特异性分析
2.3 胃癌组织与癌旁正常组织中HCMV感染检测 22例胃癌组织及配对癌旁正常组织HCMV感染结果见图1A及表2。在胃癌组织中HCMV阳性率为50%(11/22),而在相应正常胃黏膜组织中HCMV阳性率为9.09%(2/22)。2组比较差异有统计学意义(x2= 8.844,P<0.01)(见图2)。经进一步分析,胃癌组织HCMV感染与年龄、性别、TMN分期、组织病理分化类型及肿瘤大小等胃癌患者的临床病理特征未显示明显相关性(P>0.05)。
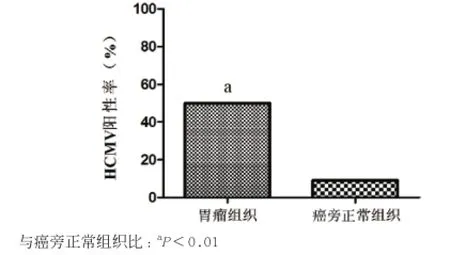
图2 胃癌组织和癌旁正常组织HCMV检出率比较
3 讨论
胃癌是我国常见的恶性肿瘤之一[8],其病因及发病机制尚未完全阐明。近年来研究显示,HCMV感染与恶性肿瘤发生发展有关[5-6]。Scheurer等[9]对不同组织类型的神经胶质瘤进行了HCMV检测,发现恶性胶质瘤相对于间变性胶质瘤、低级别胶质瘤有着更高的感染率。国内学者施浩强等[10]研究发现HCMV活动性感染与尿路上皮细胞癌的病理分化类型有关。自从溃疡性结肠炎与巨细胞病毒感染的关系被首次报道[11]后,越来越多的文献报道胃肠道疾病的发生与HCMV感染有关,以急性胃炎、胃溃疡、急性肠炎等疾病报道[12-13]多见。Hertel等[14]研究认为上皮细胞可能为HCMV攻击及潜伏的位点。Chen等[15]通过定量PCR以及免疫组织化学检测发现HCMV更倾向于感染结肠癌的上皮细胞,而亦有研究认为结肠癌与HCMV的感染无显著关联[16]。但迄今鲜有HCMV与胃癌的相关性研究报道。
为探讨HCMV感染与胃癌的关系,本研究首先采用化学发光法对胃癌组及健康对照组各80例血清进行了HCMV IgG、IgM抗体检测,未发现胃癌组与健康对照组间差异有统计学意义。其原因可能为:①HCMV人群潜伏感染率高[1-2],2组在血清学抗体水平上很难出现差异;②感染部位不特异,局部或全身的既往或现状感染均可引起IgG、IgM抗体的产生。故血清学检测HCMV IgG、IgM抗体尚不能说明胃癌与HCMV之间的关联。
HCMV是一种广泛细胞亲嗜性的DNA病毒。为探讨胃癌组织HCMV感染的情况,本研究选择HCMV基因组中高度保守的、在病毒的生长、增殖过程发挥重要作用的UL55基因[17],参考文献[7]报道的方法,建立了巢式PCR,检测胃癌及癌旁相应的正常黏膜组织中HCMV感染的情况。本研究初步验证了胃癌上皮细胞中存在HCMV,且相对于正常胃黏膜HCMV更倾向感染癌灶,提示胃癌可能与HCMV感染有关。本研究虽在HCMV与胃癌发生发展的相关性分析中未发现HCMV感染与胃癌的TMN分期、组织病理分化及肿块大小有显著性关联,但仍可发现HCMV在分化低、分期晚及体积大的病灶中有更高感染率的倾向,需在后续实验中扩大样本量、进行多中心的实验研究。
HCMV感染对肿瘤生长的影响,大多学者支持由Jindrich Cinatl团队提出的HCMV发挥“肿瘤调节”作用的学说[18]。该学说认为HCMV感染后诱发细胞反应为肿瘤细胞的生长提供有利环境。长期的HCMV感染导致的慢性炎症可通过影响细胞信号通路、释放炎症因子、促进免疫逃避、抑制肿瘤细胞的凋亡、引起基因突变、影响细胞周期及全身免疫系统的调节等来诱导肿瘤的形成[18-19]。这些研究提示了胃黏膜的持续HCMV感染可能通过类似方式参与胃癌的发生。

表2 胃癌患者临床相关资料以及组织UL55检测结果
[1] Krech U. Complement-fxing antibodies against cytomegalovirus in different parts of the world[J]. Bull World Health Organ, 1973, 49(1): 103-106.
[2] Soderberg-Naucler C. Does cytomegalovirus play a causative role in the development of various infammatory diseases and cancer?[J]. J Intern Med, 2006, 259(3): 219-246.
[3] Fisher RA. Cytomegalovirus infection and disease in the new era of immunosuppression following solid organ transplantation[J]. Transpl Infect Dis, 2009, 11(3): 195-202.
[4] Bego MG, St Jeor S. Human cytomegalovirus infection of cells of hematopoietic origin: HCMV-induced immunosuppression, immune evasion, and latency[J]. Exp Hematol, 2006, 34(5): 555-570.
[5] Samanta M, Harkins L, Klemm K, et al. High prevalence of human cytomegalovirus in prostatic intraepithelial neoplasia and prostatic carcinoma[J]. J Urol, 2003, 170(3): 998-1002.
[6] Cobbs CS, Harkins L, Samanta M, et al. Human cytomegalovirus infection and expression in human malignant glioma[J]. Cancer Res, 2002, 62(12): 3347-3350.
[7] Alkhawaja S, Ismaeel A, Botta G, et al. The prevalence of congenital and perinatal cytomegalovirus infections among newborns of seropositive mothers[J]. J Infect Dev Ctries, 2012, 6(5): 410-415.
[8] 王永川, 魏丽娟, 刘俊田, 等. 发达与发展中国家癌症发病率与死亡率的比较与分析[J]. 中国肿瘤临床, 2012, 39 (10): 679-682.
[9] Scheurer ME, Bondy ML, Aldape KD, et al. Detection of human cytomegalovirus in different histological types of gliomas[J]. Acta Neuropathol, 2008, 116(1): 79-86.
[10] 施浩强, 葛俊, 唐亮, 等. HCMV活动性感染与尿路上皮癌的相关性研究[J]. 安徽医科大学学报, 2013, 48(1): 60-65.
[11] Powell RD, Warner NE, Levine RS, et al. Cytomegalic inclusion disease and ulcerative colitis; report of a case in a young adult[J]. Am J Med, 1961, 30(2): 334-340.
[12] Ebisutani C, Kawamura A, Shibata N, et al. Gastric ulcer associated with cytomegalovirus in an immunocompetent patient: method for diagnosis[J]. Case Rep Gastroenterol, 2012, 6(2): 365-368.
[13] Al-Zafri R, Gologan A, Galiatsatos P, et al. Cytomegalovirus complicating infammatory bowel disease: a 10-year experience in a community-based, university-affliated hospital [J]. Gastroenterol Hepatol (NY), 2012, 8(4): 230-239.
[14] Hertel L, Lacaille VG, Strobl H, et al. Susceptibility of immature and mature Langerhans cell-type dendritic cells to infection and immunomodulation by human cytomegalovirus[J]. J Virol, 2003, 77(13): 7563-7574.
[15] Chen HP, Jiang JK, Chen CY, et al. Human cytomegalovirus preferentially infects the neoplastic epithelium of colorectal cancer: a quantitative and histological analysis[J]. J Clin Virol, 2012, 54(3): 240-244.
[16] Akintola-Ogunremi O, Luo Q, He TC, et al. Is cytomegalovirus associated with human colorectal tumorigenesis?[J]. Am J Clin Patho, l 2005, 123(2): 244-249.
[17] Roubalova K, Strunecky O, Zufanova S, et al. Genotyping of viral glycoprotein B (gB) in hematopoietic stem cell transplant recipients with active cytomegalovirus infection: analysis of the impact of gB genotypes on the patients’outcome[J]. Epidemiol Mikrobiol Imunol, 2010, 59(2): 92-99.
[18] Michaelis M, Doerr HW, Cinatl J. The story of human cytomegalovirus and cancer: increasing evidence and open questions[J]. Neoplasia, 2009, 11(1): 1-9.
[19] Cinatl J Jr, Vogel JU, Kotchetkov R, et al. Oncomodulatory signals by regulatory proteins encoded by human cytomegalovirus: a novel role for viral infection in tumor progression [J]. FEMS Microbiol Rev, 2004, 28(1): 59-77.
(本文编辑:胡苗苗)
Primary research of the relationship between HCMV infection and gastric cancer
JIN Jinji1, TU Jianxin2,WU Ming3, MA Haiguang1, SHEN Xian1, XUE Xiangyang4.
1.Department of Gastroenterological Surgery, the First Affliated Hospital of Wenzhou Medical University, Wenzhou, 325015; 2.Department of Rheumatology, the First Affliated Hospital of Wenzhou Medical University, Wenzhou, 325015; 3.Department of Gastroenterology, the First Affliated Hospital of Wenzhou Medical University, Wenzhou, 325015; 4.Institute of Molecular Virology and Immunology, Wenzhou Medical University, Wenzhou, 325035
Objective:To explore the correlation between HCMV infection and gastric cancer.Methods:The specifc IgG and IgM antibodies of HCMV in serum of gastric cancer group (n=80) and health control group (n=80) were detected using the chemiluminesence immunoassay. HCMV infection in gastric cancer tissues and corresponding normal tissues were determined through the detection of UL55 gene by Nested PCR. The relationships between HCMV infection and clinical features of gastric cancer were further analyzed.Results:The positive rate of HCMV-IgG and IgM were 95% (76/80) and 6.25% (5/80) in gastric cancer group, respectively. Meanwhile, the positive rate were 97.5% (78/80) and 3.75% (3/80) in health control. There was no statistically signifcant difference between the gastric cancer and health control group in HCMV-IgG, IgM detection. However, there was a signifcant difference between gastric cancer tissues and corresponding normal tissues in HCMV detection. The positive rate of HCMV UL55 was 50% (11/22) in gastric cancer tissue samples, whereas 9.09% (2/22) in corresponding normal tissues through Nested PCR detection. In addition, There was no obvious association between HCMV infection and TMN stage, pathological differentiation type and the size of tumor.Conclusion:It is the frst time to report the HCMV infection in gastric cancer tissues, and the HCMV may preferentially infect the neoplastic epithelium than corresponding normal epithelium, this research suggests the HCMV infection may participate in the occurrence and development stages of gastric cancer.
gastric neoplasms; human cytomegalovirus; UL55
R735.2
A
1000-2138(2014)10-0703-05
2013-09-04
国家自然科学基金资助项目(81001343);浙江省自然科学基金资助项目(Y2100909);温州市科技局科研基金资助项目(Y20100164,H20100028)。
金劲激(1988-),男,浙江瑞安人,住院医师,医学硕士。
薛向阳,副教授,硕士生导师,Email:wzxxy001@163.com。
