含供电基团的吡啶/吡嗪类化合物硝化反应研究
2014-03-01李勤华陆明潘仁明王鹏程祝洁
李勤华,陆明,潘仁明,王鹏程,祝洁
(南京理工大学 化工学院,江苏 南京210094)
0 引言
设计高能量、高安全的含能材料是含能材料领域研究的重点方向之一[1-4]。吡啶和吡嗪类化合物是构成高能低感含能化合物的新型骨架,近期新出现的典型化合物,如二(1,3-二硝基-二氢-1H-咪唑)并[4,5-b:4',5'-e]-4-硝基吡啶-1-氧化物,二(1,2-二硝基-1,5-二氢咪唑)并[4,5-b:4',5'-e]吡嗪-1-氧化物等化合物中均嵌入了吡啶和吡嗪结构;成熟化合物如2,6-二氨基-3,5-二硝基吡啶-1-氧化物(ANPYO)和2,6-二氨基-3,5-二硝基-1-氧吡嗪(LLM-105)等是吡啶和吡嗪的氨基和硝基衍生物[5-9]。这些化合物具有较好的爆轰性能,同时能保持较好的感度,是一类重要的高能低感的炸药,其中LLM-105 因其爆炸性能优异且感度较低,最具应用前景,成为目前高能低感炸药领域主要的研究对象[10-13]。
2,6-二氨基吡啶和2,6-二甲氧基吡嗪分别是制备ANPYO 和LLM-105 的重要中间体,它们经过硝化、还原、氧化等数步反应可以得到目标产物[14-17]。这些反应中,还原和氧化均较容易进行,且反应条件温和,产率高,能接近化学计量转化。而硝化反应却较难发生,需要在强酸环境下反应,且产率一般约为70%左右,是制约进一步降低成本和工业化的重要影响因素,成为我们研究的重点内容。
本文以2,6-二氨基吡啶和2,6-二甲氧基吡嗪为吡啶/吡嗪类化合物的典型代表底物,研究难硝化底物的硝化反应过程,主要是寻找适宜的硝化体系,分析硝化反应的影响因素,结合量子化学理论计算,对硝化过程给予合理的解释,并对比二者的硝化反应过程。
2,6-二氨基吡啶和2,6-二甲氧基吡嗪的硝化反应过程如图1所示。
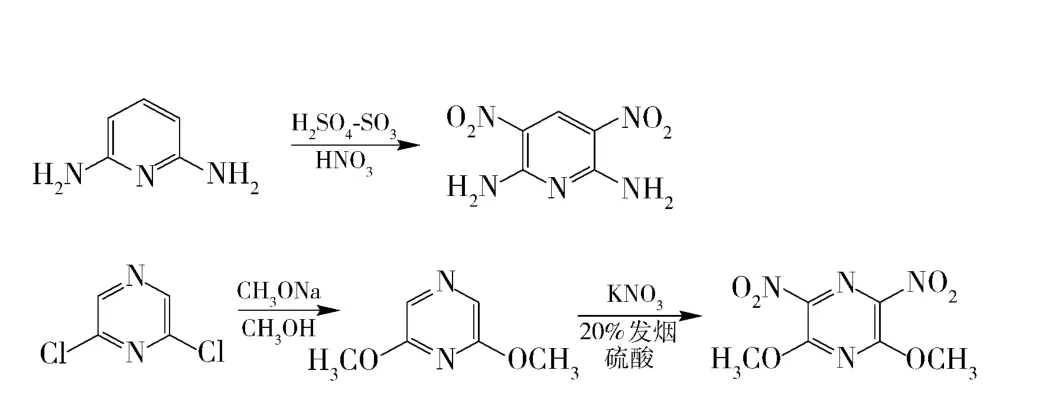
图1 2,6-二氨基吡啶和2,6-二甲氧基吡嗪的硝化Fig.1 The nitration process of 2,6-diaminopyridine and 2,6-dimethoxypyrazine
1 实验部分
1.1 实验药品及仪器
2,6-二甲氧基吡啶、2,6-二氯吡嗪、氢氧化钠、甲醇钠、二氯甲烷、碳酸氢钠、无水硫酸钠、KNO3均为分析纯;98% 浓H2SO4、20% 发烟硫酸、95%HNO3. Bruker 500 MHz 核磁共振仪,德国Bruker 公司产;Nicolet 红外光谱仪,美国Perkin Elmer 公司产;Ultra Am TSQ quntium 型高分辨质谱仪,美国Finnigan 公司产;Vario EL Ⅲ有机元素分析仪,德国Elementar公司产;高压反应釜,山东威海自控反应有限公司产。
1.2 实验步骤和表征
1.2.1 2,6-二氨基吡啶的硝化
在250 mL 装有搅拌器、温度计的4 口烧瓶中,加入20%发烟H2SO4(130 mL),搅拌下再加入2,6-二氨基吡啶(30.0 g,0.275 mol),待固体完全溶解后,冰水浴,温度控制在20 ℃以下,加入95% HNO3(26 mL,0.58 mol),继续搅拌1 h,撤去冰水浴,将混合物缓慢加热到30 ℃并保温3 h. 反应完后,将混合物倒入1 L 碎冰中,搅拌,析出大量黄褐色固体,过滤,水洗,再加入10 mol/L NaOH 溶液调pH 10 ~11 左右,过滤,水洗,干燥。然后在蒸馏水(1 g/10 mL)中煮沸1 h,DMSO 重结晶(100 mL/20 g)得纯品50.6 g,产率92.5%,熔点>300 ℃(文献[18]值为:345 ~347 ℃;348 ℃). 氢谱核磁1HNMR (DMSO-d6,500 MHz)化学位移δ:9.00(s,1H,Py-H),8.41 (s,2H,NH2),8.26 (s,2H,NH2). 红外IR (KBr/cm-1):3 478,3 367,1 627,1 455,1 391,1 370,1 327,1 282,1 236,1 040,721. 元素分析C5N5O4H5(实测值(理论值,%)):C 30.09(30.15),H 2.47(2.51),N 35.15(35.18). 质谱MS (m/z):198(M+),15l,138,66,46.
1.2.2 2,6-二甲氧基吡嗪的硝化
首先以2,6-二氯吡嗪制备2,6-二甲氧基吡嗪:室温下将14.9 g (0.1 mol)2,6-二氯吡嗪加入到100 mL 30%甲醇钠-甲醇溶液中,50 ℃下回流反应3 h,冷却后倒入350 g 碎冰中,有乳白色固体析出,静置,待烧杯中碎冰完全融化后过滤,滤液用二氯甲烷分3 次萃取(每次20 mL),滤饼也溶于二氯甲烷,合并二氯甲烷溶液,加入无水硫酸钠干燥,过滤得到滤液,旋蒸,在真空干燥箱中干燥,得到白色针状产品,产率95%,熔点30 ~32 ℃. 氢谱核磁1H NMR(CDCl3,500 MHz)化 学 位 移δ:3.964 (s,6H,OCH3),7.791 (s,2H,吡嗪环上CH). 红外IR(KBr/cm-1):1 585,1 481,2 868,1 013. 元素分析C6N2O2H8(实 测 值(理 论 值,%)):C 51.39(51.42),H 5.63(5.65),N 19.97(19.99). 质谱MS(m/z):139,111,97,79,68,55,42.
室温下将一定量的硫酸加入到250 mL 3 口烧瓶中,搅拌下缓慢加入14.0 g (0.1 mol)2,6-二甲氧基吡嗪,加料完毕后继续搅拌30 min,然后缓慢滴加硝酸,滴加完毕后升至反应温度,反应3 h. 反应结束后将反应液倒入500 mL 冰水中,有乳白色固体析出,过滤,先用10%的碳酸氢钠洗涤,再用冰水冲洗,直至滤液呈中性,烘干,得到淡黄色粉末状产品,熔点163 ~164 ℃. 氢谱核磁1HNMR (DMSO-d6,500 MHz)化学位移δ:4.25 (s,6H,OCH3);红外IR(KBr/cm-1)1 575,1 492,2 863,1 559,1 356;元素分析C6N4O6H6(实测值(计算值,%)):C 31.05(31.31),H 2.61(2.63),N 24.06(24.34);质谱MS(m/z):230(M+),200,154,111,70,59.
2 分析与讨论
2.1 2,6-二氨基吡啶的硝化影响因素
2.1.1 硝化体系
硝化强度是影响硝化收率和纯度的主要原因[19]。为了降低硝化体系中水的含量,提高硝化强度,本文研究采用不同的硝化体系对2,6-二氨基吡啶(0.05 mol)进行硝化反应,结果见表1.

表1 不同硝化体系对2,6-二氨基吡啶硝化结果的影响Tab.1 Effect of nitration system on the yield
表1结果表明,采用混酸硝化时,硝化中间物(硝酰胺吡啶)[20]容易发生水解和硝解反应,副产物含量相对较高,主产物收率偏低。KNO3代替95%HNO3后,在相同条件下收率略有提高,主要原因是氨基吡啶自身易氧化,95% HNO3比KNO3氧化能力更强;不同浓度的发烟H2SO4对产物收率影响不大,说明硝化剂的硝化能力不是决定产物收率的主要因素,而浓度高的发烟H2SO4得到的产率更低。本文采用的是20%发烟H2SO4和95%HNO3超酸硝化体系。
2.1.2 超酸配比
在发烟H2SO4和95% HNO3的超酸体系中,发烟H2SO4有助于HNO3转变成硝酰阳离子NO+2,增强了体系的硝化能力。同时H2SO4也是一种强脱水剂,它能够与硝化反应生成的水结合成为硫酸水合物,使HNO3不被水稀释,避免HNO3酸式电离,从而提高HNO3的利用率。实验通过对2,6-二氨基吡啶(0.05 mol)的硝化来考察发烟H2SO4和95%HNO3的体积比对收率的影响,结果见表2.
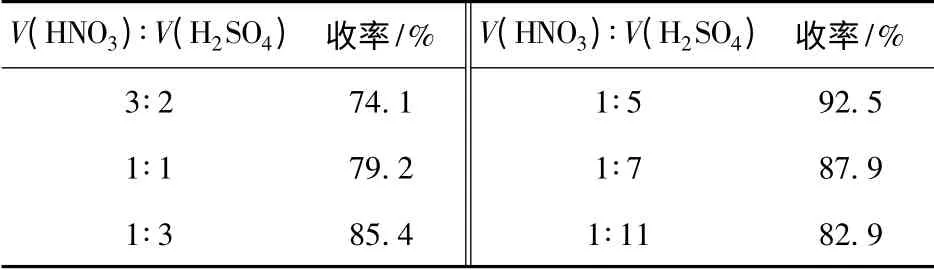
表2 超酸体积比对硝化反应的影响Tab.2 Effect of V(HNO3)∶V(H2SO4)on the yield
从表2数据可以看出:当95% HNO3和发烟H2SO4体积比为1 ∶5 时,硝化反应产率最高可达92.5%;当95% HNO3和发烟H2SO4体积比大于1∶5时,硝化反应产率较低,说明超酸的硝化能力不够,硝酸未被充分利用;当95% HNO3和发烟H2SO4体积比小于1∶5时,硝化反应的产率逐渐下降,这可能是因为超酸的硝化能力偏强,硝化反应的副产物增多,而且废酸量大不利于后处理。因此,硝硫酸最佳体积比为1∶5.
2.1.3 硝酸用量
考察了95%HNO3用量对2,6-二氨基-3,5-二硝基吡啶收率的影响,实验步骤为:0.05 mol 2,6-二氨基吡啶加到含20%发烟H2SO4中,95% HNO3滴加完毕后,30 ℃下反应3 h,改变95% HNO3的用量。实验结果如图2所示。
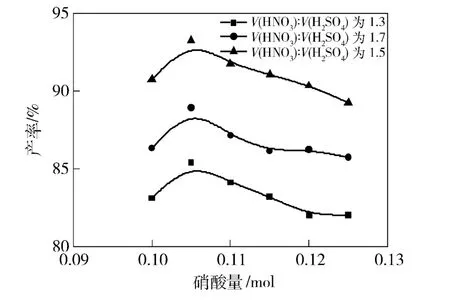
图2 95%HNO3的用量对硝化反应的影响Fig.2 Effect of HNO3 addition on nitration
由图2可以看出,当95% HNO3和2,6-二氨基吡啶的摩尔比为2.1∶1时,硝化产率最高,虽然从动力学的理论看,95% HNO3过量应该能够促使反应的进行,但实验结果表明,由于95% HNO3具有氧化性,过量较多就会氧化原料和产物,导致产率的下降。因此,在实际操作中保持稍微过量就行。
2.1.4 硝化温度

表3 温度对硝化反应的影响Tab.3 Effect of temperature on the yield
由表3可知,低温滴加完HNO3后,温度升至25 ~40 ℃,硝化能达到最佳效果。低于此温度反应的活化能不足以使硝酰胺中间体全部重排,收率较低;高于此温度,超酸体系中的氧化作用明显,副产物增多,收率下降。副产物生成过程如图3所示。

图3 2,6-二氨基吡啶的硝化重排过程Fig.3 Nitration and rearrangement process of 2,6-diaminopyridine
2.2 2,6-二甲氧基吡嗪的硝化反应
2.2.1 硝化体系对产率的影响
不同硝化体系对硝化反应的影响结果见表4(后处理采用10%的碳酸氢钠洗涤后粗品的纯度较高,硝化产率是优化后各种体系的最佳值,粗品纯度由液相色谱测定,经过乙腈重结晶后纯度达99.0%以上)。反应条件:室温下3 h.
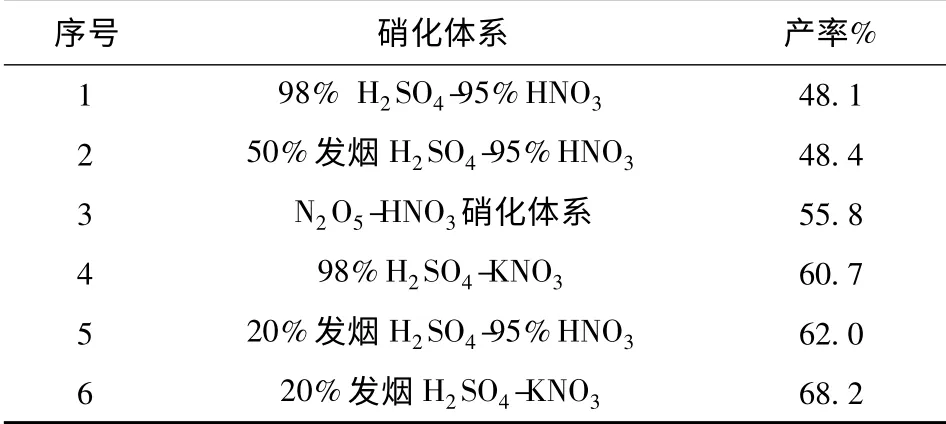
表4 不同硝化体系对硝化反应的影响Tab.4 Effect of different nitration system on the nitration yield
由表4可以看出,随着硝化体系的增强,产率逐渐升高,但纯度逐渐下降。由于氮原子的电负性较强,吡嗪环上的电子云密度较低,不利于硝化反应,需要较强的硝化体系进行硝化,硝化体系越强产生的NO+2越多,越利于硝化反应。
在发烟硫酸体系中,随硝化体系中SO3含量的升高产率升高,但SO3含量升高至50%时产率下降。SO3含量升高,体系中多余的SO3与形成NO+2 过程中的水反应生成硫酸,减少体系中的含水量,提高了产率;20%发烟硫酸和硝酸钾体系硝化产率最高,形成超酸体系产生NO+2的过程中,无水生成硝化能力较强。50%发烟硫酸和95%硝酸体系硝化能力最强,但其产率最低,原因是由于SO3具有较强的氧化性。在50%发烟硫酸体系中由于其氧化性太强而导致副反应增多,产生大量的副产物,导致产率、纯度下降。
本文对主要产率较高的20%发烟H2SO4-95%HNO3和20%发烟H2SO4-KNO3硝化体系做了具体的工艺研究。
2.2.2 发烟硫酸-硝酸体系下2,6-二甲氧基吡嗪的硝化工艺研究
仍在2,6-二甲氧基吡嗪用量为0.05 mol,硝酸过量100%,反应温度为25 ℃,反应时间为3 h 的条件下,研究95%硝酸与20%发烟硫酸配比对产率的影响,实验结果见表5.
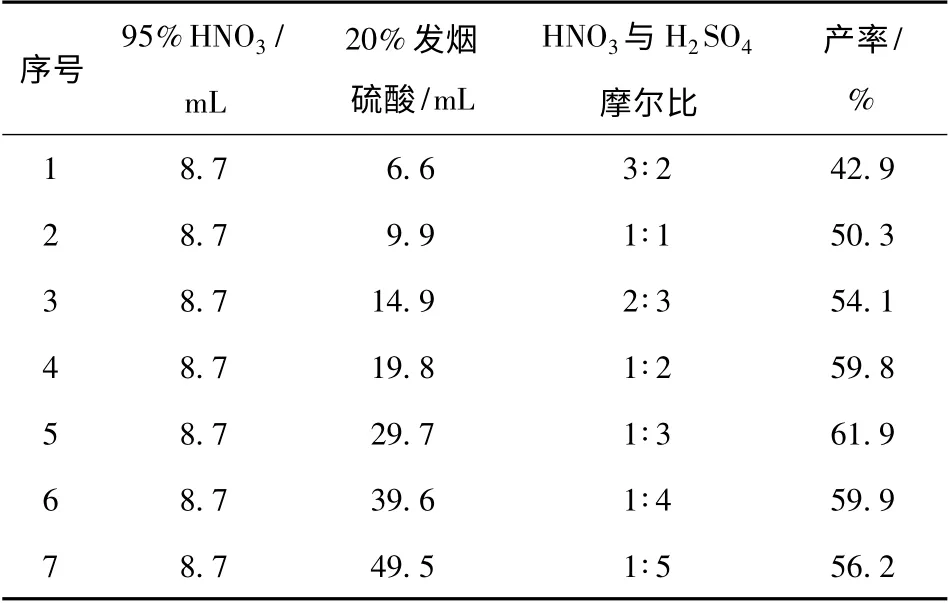
表5 硝酸与发烟硫酸摩尔比对产率的影响Tab.5 Effect of n(HNO3)/n(oleum)on the yield
发烟硫酸-硝酸体系的硝化能力要强于混酸体系,由表5可知,在发烟硫酸-硝酸体系下2,6-二甲氧基-3,5-二硝基吡嗪的产率要高于混酸体系,在硝酸与发烟硫酸的摩尔比为1 ∶3 时,产率最高,达到61.9%.
2.2.3 发烟硫酸-硝酸钾体系下2,6-二甲氧基吡嗪的硝化工艺研究
在2,6-二甲氧基吡嗪用量为0.05 mol,硝酸钾过量100%,反应温度为25 ℃,反应时间为3 h 的条件下,研究硝酸钾与20%发烟硫酸的摩尔比对产率的影响,实验结果见表6.
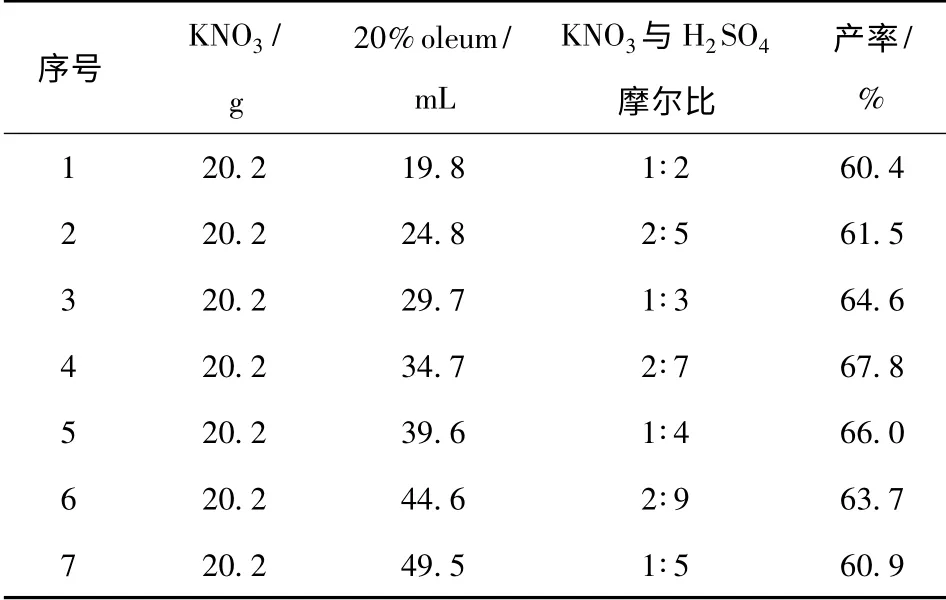
表6 硝酸钾与发烟硫酸摩尔比对产率的影响Tab.6 Effect of n(KNO3)/n(oleum)on the yield
发烟硫酸-硝酸钾体系的硝化能力要强于发烟硫酸-硝酸体系和混酸体系,由表6可知,在发烟硫酸-硝酸钾体系下2,6-二甲氧基-3,5-二硝基吡嗪的产率要明显高于前两个体系,当硝酸钾与发烟硫酸的摩尔比为1∶3.5 时,产率最高,达到67.8%.
2.3 含供电基团的吡啶、吡嗪的硝化反应对比
为了进一步研究杂环芳烃硝化反应的内在规律,采用量化计算深入分析,主要从电子云密度和零点能的角度出发,对比取代吡啶、吡嗪的硝化过程。
2.3.1 吡啶、吡嗪电子云密度的比较
通过高斯软件,计算苯环、吡啶环和吡嗪环的电子云密度,计算结果如图4所示。从计算结果可以看出,随着芳环上N 原子个数的增加,C 原子上的电子云密度呈下降趋势。因硝化是亲电取代反应,芳环上C 原子的电子密度降低将导致硝化反应难以进行。实验结果也表明,2,6-二甲氧基吡嗪的硝化产率较2,6-二氨基吡啶低。
2.3.2 取代基的影响
电子云密度还与芳环上取代基团的供吸电性及数量有关。由于氮原子的电负性较强,吡啶/吡嗪环上的电子云密度不像苯环完全平均化,氮原子附近电子云密度较高,环上碳原子的电子云密度有所降低。α 位的硝化等亲电取代反应较苯困难。若分子中含有供电子基团,环上碳原子的电子云密度将增大,亲电的硝化反应也会相对容易进行。氨基和甲氧基属于给电子基团,属于邻、对位定位基团,而向吡啶/吡嗪环上引入的氨基/甲氧基恰好在进攻试剂的邻对位,有利于硝化反应进行。

图4 吡啶环和吡嗪环的电子云密度比较Fig.4 Comparison of electronic cloud densities of prydine and pyrazine
如图5所示为2,6-二甲氧基吡嗪硝化的各中间体的能垒图。图中数据表明,供电基团如—OCH3、—NH2的引入,可以有效降低零点能,使得分子更加稳定,更有利于硝化反应的进行。硝化之后,分子能量有所上升,这是由于吸电基团—NO2的引入导致的。

图5 2,6-二甲氧基吡嗪硝化的中间体能垒图Fig.5 Energy barriers of intermediates in the nitration of 2,6-dimethoxypyrazine
3 结论
本文以2,6-二氨基吡啶和2,6-二甲氧基吡嗪为典型底物,研究了含供电基团的吡啶/吡嗪类的硝化反应。研究结果表明:
1)从硝化体系和硝化收率的实验数据可知,2,6-二氨基吡啶和2,6-二甲氧基吡嗪的硝化过程较难进行;而芳香环里含有2 个N 的吡嗪类化合物硝化收率低,更难硝化。
2)在H2SO4-SO3/HNO3硝化体系中,95%HNO3和发烟H2SO4体积比为1∶5时,30 ℃下反应,2,6-二氨基-3,5-二硝基吡啶产率可达90% 以上;2,6-二甲氧基吡嗪的硝化中,在硝酸与硫酸(发烟硫酸)的摩尔比在1∶3左右时,硝化产率较高。而在硝化能力更强的20%发烟硫酸-硝酸钾体系中,当硝酸钾与发烟硫酸的摩尔比为1∶3.5 时2,6-二甲氧基-3,5-二硝基吡嗪产率达到67.8%.
3)高斯计算的结果也验证了上述结论。随着芳环上N 原子个数的增加,C 原子上的电子云密度呈下降趋势,导致硝化反应难以进行;另一方面,分子中供电子基团的引入使得环上碳原子的电子云密度增大,亲电的硝化反应也会相对容易进行。
References)
[1] Kuo K K,Brill T B,Resce-Rodriguez R A,et al. Challenges in propellants and combustion:100 years after Nobel[M]. New York:Begell House Publishers,Inc,1998:616 -626.
[2] Chavez D E,Hiskey M A,Gilardi R D. Novel high-nitrogen materials based on nitroguanyl-substituted tetrazines[J]. Organic Letters,2004,6(17):2889 -2891.
[3] Bottaro J C,Penwell P E,Schmitt R J. 1,1,3,3-tetraoxo-1,2,3-triazapropene anion,a new oxy anion of nitrogen:the dinitramide anion and its salts[J]. Journal of the American Chemical Society,1997,119(40):9405 -9410.
[4] 张红,王开明,朱正和. 含铝RDX 炸药爆温的理论计算[J].兵工学报,2002,23(1):136 -138.ZHANG Hong,WANG Kai-ming,ZHU Zheng-he. Theoretical explosion temperature of aluminiferous RDX obtained by thermochemistry calculation[J]. Acta Armamentarii,2002,23(1):136 -138. (in Chinese)
[5] Hollins R A,Merwin L H,Nissan R A,et al. Aminonitropyridines and their N-oxides[J]. Journal of Heterocyclic Chemistry,1996,33(3):895 -904.
[6] Ritter H,Licht H H. Synthesis and reactions of dinitrated amino and diaminopyridines[J]. Journal of Heterocyclic Chemistry,1995,32(2):585 -590.
[7] Pagoria P F,Lee G S,Mitchell A R,et al. A review of energetic materials synthesis[J]. Thermochimica Acta,2002,384(1):187 -204.
[8] Licht H H,Ritter H. 2,4,6-trinitropyridine and related compounds,synthesis and characterization[J]. Propellants,Explosives,Pyrotechnics,1988,13(1):25 -29.
[9] 刘耀鹏,陈华雄,陈树森,等. 2-甲氧基-3,5-二硝基-6-叠氮基吡嗪的合成[J]. 兵工学报,2010,31(10):1357 -1362.LIU Yao-peng,CHEN Hua-xiong,CHEN Shu-sen,et al. Synthesis of 2-methoxy-3,5-dinitryl-6-azidepyrazine[J]. Acta Armamentarii,2010,31(10):1357 -1362. (in Chinese)
[10] 成健,姚其正,周新利,等. 2,6-二氨基-3,5-二硝基吡啶-1-氧化物的合成新方法[J]. 有机化学,2008,28(11):1943-1947.CHENG Jian,YAO Qi-Zheng,ZHOU Xin-Li,et al. Novel synthesis of 2,6-diamino-3,5-dinitropyridine-l-oxide[J]. Chinese Journal of Organic Chemistry,2008,28(11):1943 -1947. (in Chinese)
[11] 成健,姚其正,刘祖亮. 2,6-二氨基-3,5-二硝基吡啶-1-氧化物的合成新方法[J]. 含能材料,2009,17(2):166 -168.CHENG Jian,YAO Qi-zheng,LIU Zu-liang. Synthesis of 2,6-diamino-3,5-dinitropyridine-1-oxide[J]. Chinese Journal of Energetic Materials,2009,17(2):167 -168. (in Chinese)
[12] Sikkema D J. Design,synthesis and properties of a novel rigid rod polymer,PIPD or'M5':high modulus and tenacity fibres with substantial compressive strength[J]. Polymer,1998,39(24):5981 -5986.
[13] 李金山,黄奕刚,董海山,等. 多硝基吡啶的密度泛函理论研究[J]. 含能材料,2003,11(4):177 -181.LI Jin-shan,HUANG Yi-gang,DONG Hai-shan,et al. Density functional theory study on polynitropyridines[J]. Energetic Materials,2003,11(4):177 -181. (in Chinese)
[14] 黄玉东,王艳红,王保启,等. 一种制备2,3,5,6-四氨基吡啶盐酸盐的方法:中国,CN101289419A[P]. 2008-10-22.HUANG Yu-dong,WANG Yan-hong,WANG Bao-qi,et al. A method of preparation of 2,3,5,6-tetraaminopyridine:China,CN101289419A[P].2008-10-22. (in Chinese)
[15] 安国成,詹家荣. 2,3,5,6-四氨基吡啶的制备方法:中国,CN1907972[P]. 2006-12-27.AN Guo-cheng,ZHAN Jia-rong. Preparation method of 2,3,5,6-tetraaminopyridine:China,CN1907972[P].2006-12-27. (in Chinese)
[16] 郁晓宇,陆明,聂福德. 2,6-二氨基-3,5-二硝基-1-氧吡嗪合成工艺的改进[J]. 火炸药学报,2012,35(2):10 -14.YU Xiao-yu,LU Ming,NIE Fu-de. Improvement of thesynthesis process of 2,6-diamino-3,5-dinitropyraz -ine-1-oxide[J]. Chinese Journal of Explosives & Propellants,2012,35(2):10 -14. (in Chinese)
[17] 王鹏程,刘想,陆明,等. 2,3,5,6-四氨基吡啶盐酸盐的合成[J]. 南京理工大学学报:自然科学版,2012,36(5):898 -903.WANG Peng-cheng,LIU Xiang,LU Ming,et al. Synthesis of 2,3,5,6-tetraamineopyridine hydrochloride[J]. Journal of Nanjing University of Science and Technology:Natural Science Edition,2012,36(5):898 -903. (in Chinese)
[18] Williams R L,Cohen S A. The chemistry of aryltetraamines. II.the synthesis of 2,3,5,6-tetraaminopyridine[J]. Journal of Heterocyclic Chemistry,1971,8(5):841 -843.
[19] 成健,刘祖亮,姚其正,等. 2,6-二氨基(4-氨基)吡啶的二硝化反应[J]. 火炸药学报,2009,32(3):9 -11.CHENG Jian,LIU Zu-liang,YAO Qi-zheng,et al. Dinitration of 2,6-diamino (4-amino)pyridines[J]. Chinese Journal of Explosives & Propellants,2009,32(3):9 -11. (in Chinese)
[20] Deady L W,Grimmett M R,Potts C H. Studies on the mechanism of the nitraminopyridine rearrangement[J]. Tetrahedron,1979,35(24):2895 -2900.
