水库水有机污染物遗传毒性的研究
2014-02-28王娟婷于衍真
王娟婷,李 玄,于衍真
(济南大学 土木建筑学院,济南 250022)
随着工业、农业的发展,由于大量工业废水不达标排放,绝大部分生活废水不经处理直接排放,农村地区不合理大量使用化肥、农药等化学物质,导致了严重的面源污染[1]。
大量人工合成有机物进入水环境,这些有机物不易被微生物降解,并通过食物链逐级富集。研究表明,进入水体的有机物种类繁多,绝大部分对水生生物和人体有直接或间接、急性或慢性的致毒作用,一些还能积累在组织内部,改变细胞的DNA结构,使组织发生癌变[2-6]。
近年来,水中有机污染物对人体健康的潜在危害及饮用水中有机污染物质的去除效率受到人们的普遍关注[7]。
按照国内常规给水处理工艺流程进行模拟实验,分别对枯水期与丰水期设定水源水、沉后水、滤后水及出厂水4个水样进行试验,研究常规给水处理工艺对有机污染物的去除效率,对比丰水期、枯水期进水水质与出水水质,及时找到处理工艺的薄弱环节,为水质及时调节工艺组合提供可靠参考。
为进一步真实地反映饮用水中有机污染物对人体的危害,采用彗星实验[8]对脾脏淋巴细胞进行DNA损伤研究[9-10]。淋巴细胞是机体内一类重要的免疫细胞,是机体发生癌变的早期信号[11]。
1 实验材料与方法
根据国内水厂常用的给水处理工艺流程,组建模拟水厂流程(图1),设定采集4个水样:原水(A)、加混凝剂经沉淀之后的沉后水(B)、经快速砂滤池的滤后水(C)及液氯消毒后的出水(D)。进水采样分两期进行,枯水期(1月),丰水期(8月)。将水样进行有机物富集,应用GC/MS分析技术分析各水样有机提取物的主要成分,将富集后的物质复溶,配置成高、中、低3个不同浓度溶液喂养雌性小白鼠,连续染毒7d,处死小鼠,取小鼠脾脏细胞做彗星试验[12]。
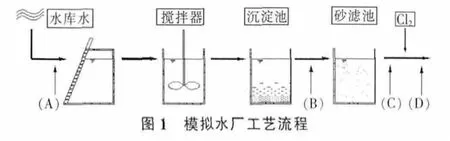
2 实验结果
2.1 有机物提取物的GC/MS成分分析
表1和表2显示了应用GC/MS分析枯水期与丰水期水样有机提取物的成分,其中枯水期共定性出有机物10种,进水中检测出42种有机物,丰水期共定性出有机物13种,进水中检测出44种有机物。在丰水期、枯水期有机污染物中,单环芳烃类和多环芳烃类化学物都居于首位。与枯水期相比,来自丰水期水样的有机物种类和数量均比相应的枯水期水样的多,这与化肥农药等成分通过丰水期雨水冲刷和地表径流进入水体有很大关系。
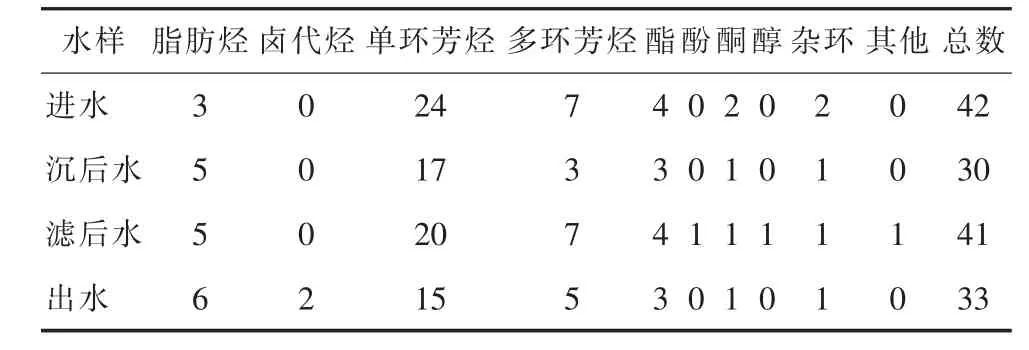
表1 枯水期水样浓缩物中有机成分
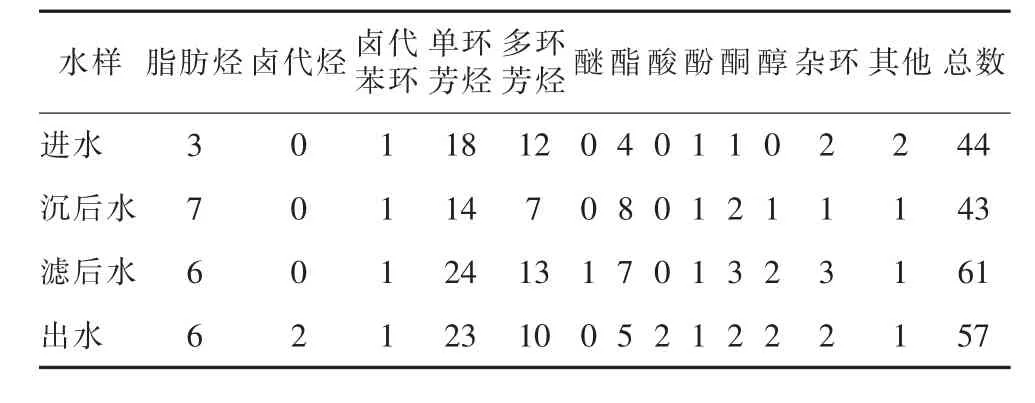
表2 丰水期水样浓缩物中有机成分
2.2 枯水期与丰水期小白鼠脾脏淋巴细胞彗星实验结果
在彗星图像中,彗头代表细胞核,即未断裂的、分子量较大的DNA片段,彗尾代表细胞核中DNA片段在电场作用下的迁移,DNA片段越小,迁移的距离越远,分子量小的DNA片段越多,彗星图像分散程度越高。
当前,评价彗星实验结果常用的定量指标主要有:彗星尾长、彗尾DNA含量和尾矩[13]。在较低损伤范围内,尾长与损伤呈线性关系;在高损伤范围时,尾长并不随损伤程度的增加而增长。而彗尾DNA含量及尾矩与损伤程度关系密切,因此,选用彗尾DNA含量及尾矩更能准确反映DNA损伤程度。
图2、图3分别是枯水期、丰水期4种水样分别喂养小白鼠后,小白鼠脾脏细胞的彗星实验图。
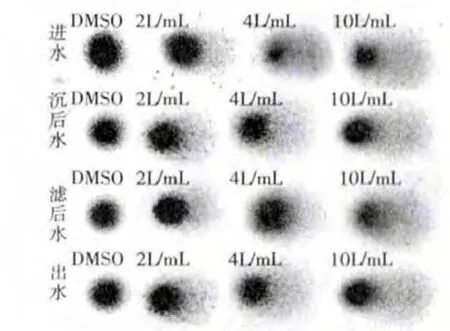
图2 枯水期有机提取物对小鼠淋巴细胞DNA损伤的彗星实验
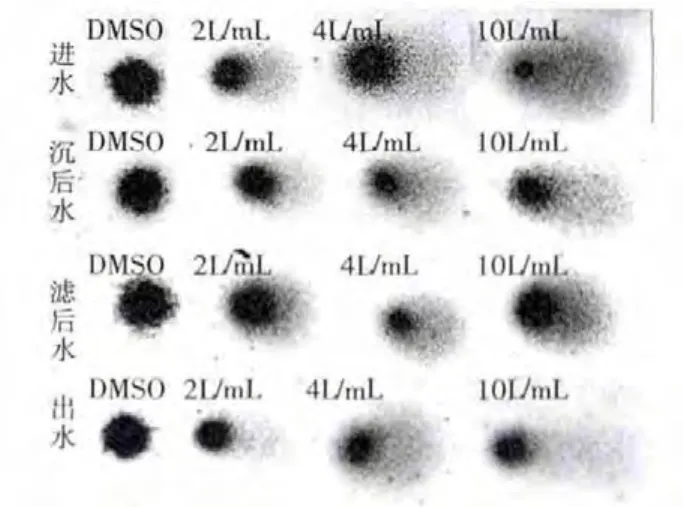
图3 丰水期有机提取物对小鼠淋巴细胞DNA损伤的彗星实验
从彗星图片中,可以看出枯水期和丰水期的各阶段水样,对小白鼠脾脏细胞DNA都有不同程度的损伤,而且随着喂养溶液浓度的增大,损伤程度增大。
2.3 淋巴细胞DNA损伤结果
采用彗尾DNA含量这一指标,利用计算机图像分析软件实验结果,如图4~图6。

图4 枯水期彗星实验结果
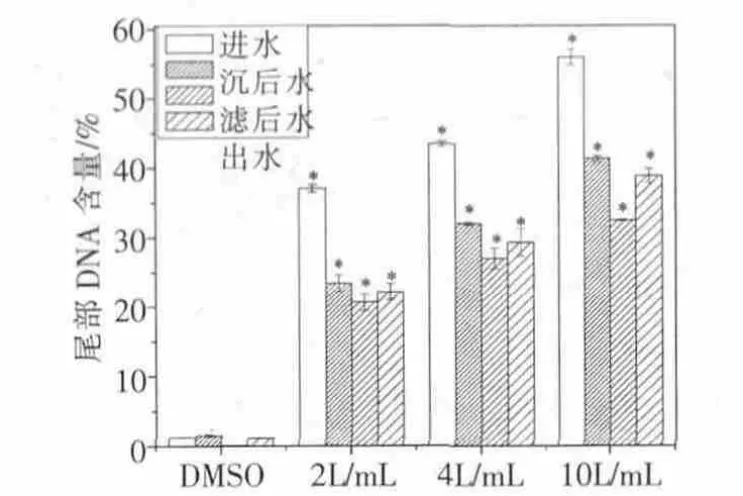
图5 丰水期彗星实验结果
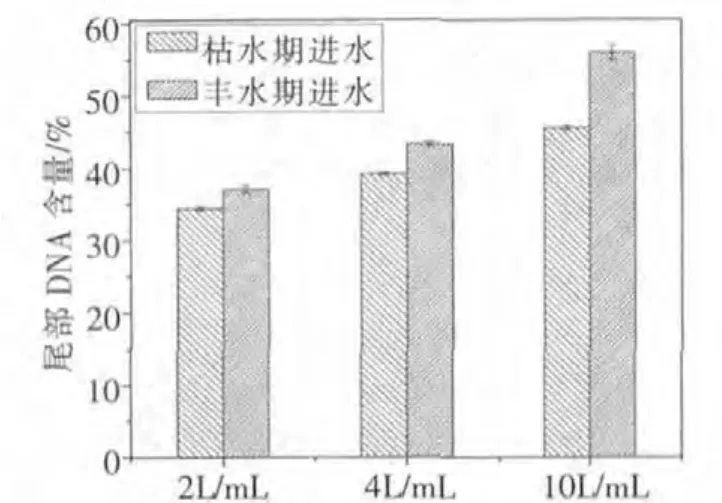
图6 枯水期与丰水期进水彗星实验结果
图4与图5表明无论是丰水期还是枯水期,从进水到沉后水、滤后水及出水的有机提取物均对小鼠脾脏淋巴细胞有不同程度的DNA损伤。并且随着有机提取物浓度的增加,尾部DNA含量增加,即DNA损伤程度增加。其中未经任何处理的进水的DNA损伤最高,而滤后水的DNA损伤最低。经过砂滤池过滤的滤后水再经消毒处理,其出水的DNA损伤与滤后水相比均呈现增高的现象,这主要是采用液氯消毒产生了消毒副产物的缘故[14-15]。
图6显示了不同浓度的枯水期与丰水期进水有机提取物对彗星尾部DNA含量的影响,丰水期的响应值明显高于枯水期,并且随着提取物浓度的增大,这种差异越来越明显。这种差异与水库所在地在丰水期和在多雨季节当地田间施用化肥与农药有很大关系,这些化肥与农药成分随着雨水的冲刷和地表径流大部分进入饮用水水源。
3 结语
(1)饮用水源的污染对给水处理工艺提出新的挑战。常规水处理工艺可以在一定程度上降低水中有机污染物的遗传毒性,但不能消除危害。
(2)我国饮用水消毒仍然以液氯消毒为主,由于消毒副产物的存在,增加了水的遗传毒性。
(3)水库在枯水期与丰水期的水质常规理化监测没有任何超标,但丰水期水样中有机提取物的有机物种类与数量明显高于枯水期,前者对小鼠淋巴细胞的DNA损伤程度也高于后者。这类有机污染物大部分为持久性有机污染物,可以在环境中稳定存在,在人和动物体内富集,直至中毒的浓度。
(4)水厂处理工艺要根据进水水质进行适当的调整或者添加必要的预处理,以适应不断变化的原水水质,保障良好的饮用水水质[13-15]。
(5)利用颗粒性活性炭代替快速砂滤池,减少消毒副产物前体;开发和应用新型消毒剂,防止消毒副产物的产生等。
[1]庄颖.水中有机污染物对人体的潜在危害及预防对策[J].环境与健康杂志,2001,18(3):187-189.
[2]李晓东,蔡国庆,马军.水中有机成分及其对饮用水水质的影响[J].给水排水,1999,25(5):12-14.
[3]SIYANYTSYA V, KOCHKODAN V, GONCHARUK V.Natural organic matter removal from water by complexationultrafiltration[J].Desalination, 2008, 223(1/3):91-96.
[4]ZULARISAM A W, ISMAIL A F.Razman Salmi.Behaviours of natural organic matter in membrane filtration for surf ace water treatment a review[J].Desalination, 2006, 194(1/3):211-231.
[5]崔玉川,傅涛.我国水污染及饮用水源中有机污染物的危害[J].城市环境与城市生态, 1998, 11(3):23-25.
[6]刘征涛.持久性有机污染物的主要特征和研究进展[J].环境科学研究, 2005,3(18):93-101.
[7]李兆利,厉以强,等.长江南京段水体中有机污染物的遗传毒性研究[J].环境科学研究,2006, 19 (3):105-108.
[8]N P Singh, R E Stephens,E L Schneider.modification of alkaline micro gel electrophoresis for sensitive detection of DNA damage[J].INT J RADIATBIOL,1994,66:23-28.
[9]朱惠刚.水中有机致突变物综合评价指标探讨[J].上海环境科学,1995,10(14):44-49.
[10]CLAIRTA, KRAMERJR, SYDORM, et al.Concentration of aquatic dissolved organic matter by reverse osmosis [J].Water Res, 1991, 25(9):1033-1037.
[11]陈文青,吕世静,何德.螺旋藻多糖对免疫低下小鼠淋巴细胞增殖及促进IFN-的诱生作用[J].时珍国医国药,2008(94):941-942.
[12]张金荣,唐非,谷康定,等.自来水中有机污染物对细胞DNA 的损伤作用[J].中国公共卫生,2004,20(7):784-785.
[13]孟紫强,张连珍.单细胞凝胶电泳技术在人血淋巴细胞DNA 损伤研究中的应用 [J]. 遗传学报,1998,25(4):294-300.
[14]Chisholm K, Cook A, Bower C, et al.Risk of birth defects in Australian communities with high levels of brominated disinfection by products [J].Environ Health Perspect, 2008(116):1267-1273.
[15]Hoffman C S, Mendola P, Savitz D A, et al.Drinking water disinfection by product exposure and fetal growth[J].Epidemiology, 2008(19):729-737.
