脱细胞基质管腔人工仿真胆管的体内重建:动物实验初步报告
2014-02-27周荣幸程南生李富宇
周荣幸 程南生 李富宇
近年来文献显示,医源性胆管损伤的发生概率依然有0.74%~2%[1-3]。此外,肝内胆管结石或胆总管结石常年结石刺激会对胆管壁造成透壁性炎性损伤,肝内胆管结石病例中由此发生的肝门胆管狭窄甚至胆管壁部分缺失在亚太地区也并非罕见。由于胆管自身修复能力较差,其修复完全靠纤维瘢痕组织愈合完成,目前的治疗方法有限,临床治疗现有的球囊扩张、胆管支架、胆管端端吻合以及胆肠吻合术等手术方案,疗效远不令人满意[2-6],尚需探讨新的治疗途径。寻找更为优良的具备胆管正常组织结构和功能的胆管替代物是当今肝胆外科所急需解决的问题,本实验前期通过生物组织工程学以及高分子材料学的研究进展,利用猪胆管、输尿管等组织材料已经制作脱细胞管腔基质材料,并在材料腔内面复合高分子聚氨酯(PU)材料后成功制备人工仿真胆管,经过检验,证实该材料在体外的生物力学特性、免疫原性、细胞毒性以及在体内的降解性等特性能满足体内实验要求[7],进一步行动物体内试验,检验其在动物体内对于胆管狭窄或者缺损的修复效果,为远期临床实际应用做先期探索性准备。
材料与方法
一、人工仿真胆管的制备[7]
采用健康封闭群内江成年猪胆管以及输尿管组织;剪除管腔周围结缔组织后在磷酸盐缓冲液(PBS)中搅拌清洗2 h,1%十二烷基硫酸钠(SDS)液浸泡搅拌24 h,PBS反复冲洗3~4次,取出1% Triton-100(聚乙二醇单辛基苯基醚)浸泡搅拌24 h;烘干机37℃烘24 h,干燥的脱细胞支架内均匀涂抹浓度为10%的聚氨酯水乳液,控制管壁厚度0.2~0.4 mm;烘干机37℃干燥72 h,密封包装,γ射线灭菌,完成人工仿真胆管的制备(图1)。
二、人工胆管治疗胆管缺损动物模型体内实验
将购于四川大学动物实验中心的18只封闭群内江猪随机分为三组,每组各6只。①支架组:植入手术时切除距离胰腺上端1 cm胆总管约1 cm,应用人工仿真胆管原位端端吻合修复缺损的胆管,同时于管腔内安置硅胶支架。②无支架组:植入的人工胆管腔内不安置塑料支架,其余均同支架组。③假手术组:开腹后直接关腹。植入手术时取右侧肋缘下切口进腹,打开肝十二指肠韧带腹膜,分离出胆总管;从胆囊管和肝总管汇合处下方1 cm处剪断胆总管约1 cm;取人工仿真胆管,修剪长度约1.5 cm,支架材料内径约0.3~0.5 cm,支架组安置一硅胶支架,长度约2 cm,直径0.3 cm,管壁厚度0.03 cm,分别越过上下吻合口约1 cm;6-0 Prolene线连续缝合上下端吻合口。
三、血清学检查
术后第1、3、7、30、60、90天采集血液样本送四川大学华西医院生化室检测血常规、肝脏功能、肾脏功能,并使用酶联免疫吸附试验(ELISA)法测定血清白细胞介素6(IL-6)水平。
四、组织标本采集及观察
分别于植入术后第15、30、70、100天处死实验动物或者实验动物死亡后,取样从肝门部至十二指肠段胆管分3段(从下至上,第一段是植入段近端胆管,第二段是植入段,第三段为植入段远端胆管)切断并予以石蜡包埋后切片,切片行常规HE染色、细胞角蛋白19(CK19)和上皮细胞黏附分子(HEA125)免疫荧光染色。
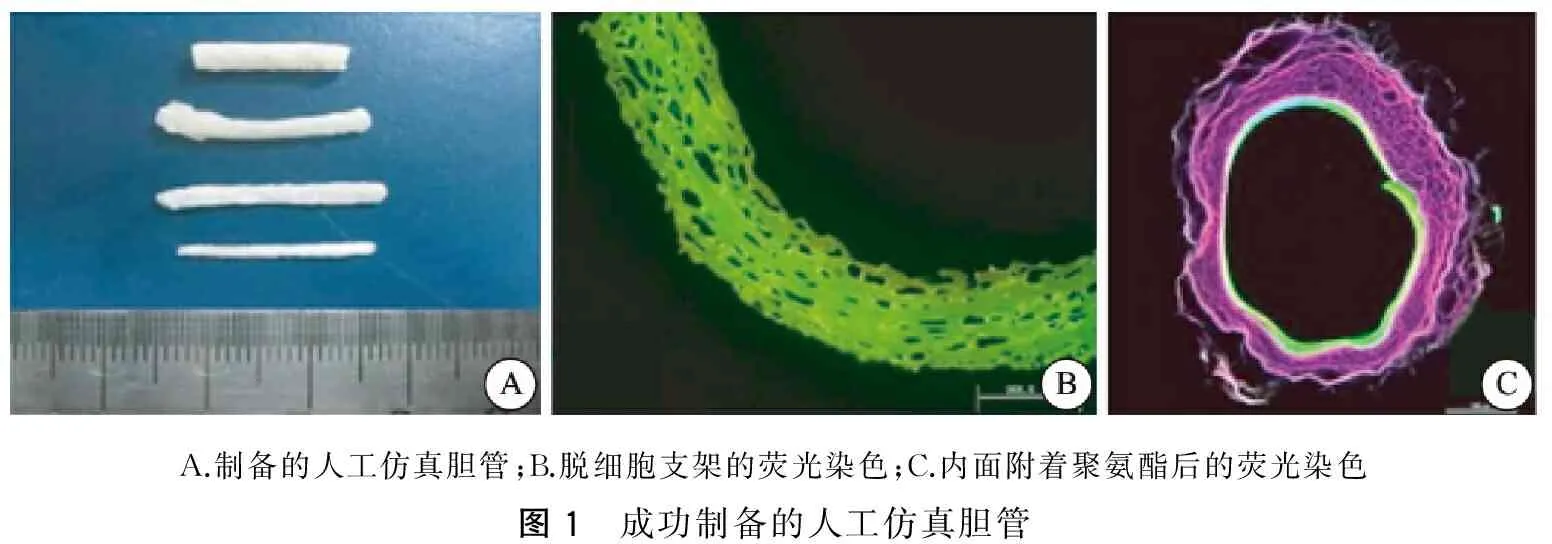
A.制备的人工仿真胆管;B.脱细胞支架的荧光染色;C.内面附着聚氨酯后的荧光染色图1 成功制备的人工仿真胆管
五、CK19、HEA125的免疫组化检测
按照说明书进行免疫组化荧光染色,主要流程包括:切片脱蜡后滴加一抗,在4℃反应过夜后滴加二抗,最后在室温下显色,于激光共聚焦平台采集图像。
六、统计学处理
采用SPSS(19.0版)统计软件包进行分析。连续性变量采取t或者U检验,二分类变量采取卡方检验,P<0.05为差异有统计学意义。
结 果
一、动物体内重建
每一台动物手术均由同一位主刀医生完成,如图2所示,吻合后人工仿真胆管充盈,胆汁引流通畅,术野无漏胆。
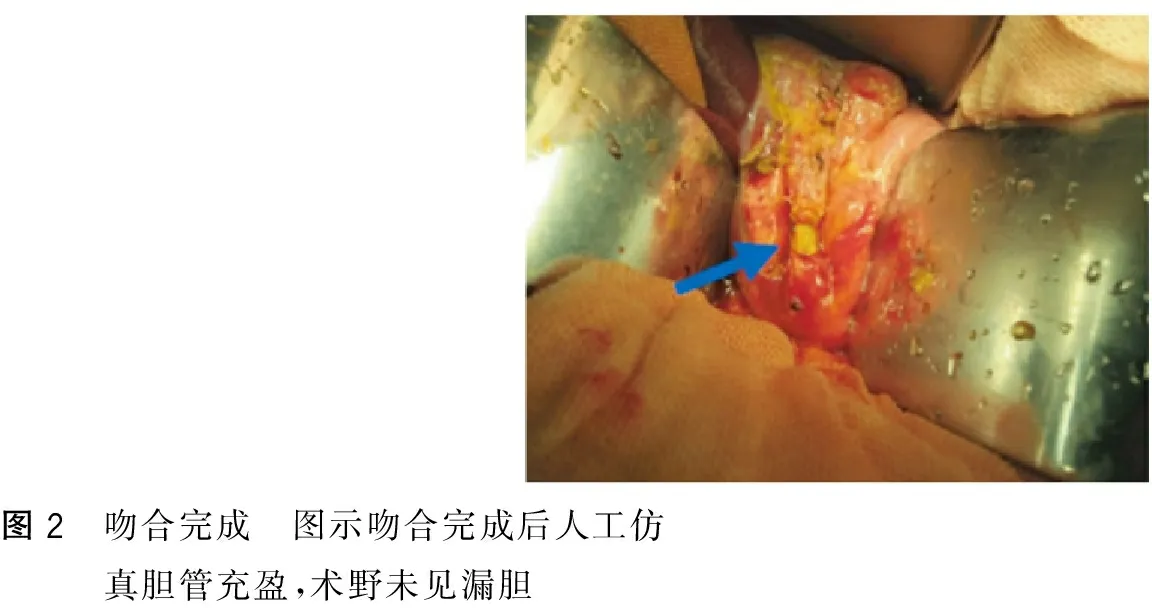
图2 吻合完成 图示吻合完成后人工仿真胆管充盈,术野未见漏胆
二、实验室检查
各组动物植入术后血清丙氨酸转氨酶(ALT)、总胆红素水平(TB)、IL-6、白细胞计数(WBC)结果变化曲线见图3。支架组、假手术组植入术后血清TB未见明显升高,WBC在术后轻度升高,术后第1周后逐渐下降到正常值;无支架组实验动物血清TB呈进行性升高趋势,ALT、WBC、IL-6不同程度升高。支架组、无支架组术中胆管胆汁细菌培养均未见细菌生长,无支架组动物死亡后有2只动物胆管胆汁细菌培养出大肠杆菌,支架组、假手术组处死后胆汁细菌培养未见细菌生长。
三、大体标本
所有实验动物处死或者死亡后解剖均未见胆漏。无支架组植入术后第2、7、8天死亡的动物解剖发现腹腔粘连明显,肝脏不同程度淤胆,胆管周围组织水肿,大网膜包裹肝外胆管,肝内外胆管以及胆囊明显扩张(植入术后第2天死亡轻度扩张),吻合口狭窄、吻合口远端胆管无扩张,脓性胆汁,黏稠,大量絮状物;第40天死亡的动物解剖发现肝脏纤维化,肝内外胆管扩张,胆汁黏稠,结石形成,吻合口下方胆管成束装,挛缩(图4)。支架组实验动物分别于第15、30、70、100天处死,解剖发现支架组动物肝内外胆管未见明显扩张,胆汁颜色金黄,无絮状物以及结石形成,吻合口无明显狭窄,但可见6-0 Prolene缝线残留,植入胆管腔无塌陷(图5、6)。假手术组动物解剖和正常组织无明显差别。
四、人工仿真胆管植入术后病理学改变
1.支架组HE染色结果 植入术后第15天无显上皮以及黏膜下腺体生长,植入段近端可见黏膜轻度增生,远端黏膜下腺体丰富,上皮增生(图7A~C);植入术后第30天植入段上皮开始形成,伴有黏膜下腺体的增生,植入段近端胆管黏膜轻度增生,远端上皮、黏膜下腺体增生明显(图7D~F);植入术后第70天复层增生上皮覆盖新生胆管,黏膜下腺体增生更为明显,近端和远端胆管的黏膜均较植入术后第30天增生明显(图7G~I);植入术后第100天可见新生胆管被胆管类似上皮完整覆盖,黏膜下腺体略有减少,近端及远端胆管黏膜及黏膜下腺体较植入术后第70天增生减退(图7J~L)。

图3 各组实验动物术后血清ALT、TB、IL-6、WBC的变化曲线

A.胆管、胆囊扩张明显,肝脏淤胆改变(植入术后第8天);B.胆管下端纤维化,挛缩,狭窄(植入术后第8天);C.肝脏纤维化改变,形态失常,可见结石形成,肝外胆管纤维条索化改变(植入术后第40天)图4 无支架组动物死亡后解剖图

植入术后第100天动物解剖可见肝脏颜色正常,肝内外胆管无扩张,剖开胆管未见狭窄,可见支架材料以及缝线残留图5 支架组动物解剖后标本

A.植入术后第15天;B.植入术后第30天;C.植入术后第70天;D.植入术后第100天图6 支架组动物处死后胆管标本取材
明
2.无支架组动物标本 HE染色可见,植入术后可见上皮水肿,黏膜下层可见大量炎性细胞浸润,人工仿真胆管可见炎性细胞浸润;植入术后40天死亡动物可见结构混乱,无明显黏膜、黏膜下层次,未见管腔结构(图8)。
3.假手术组动物标本 此组胆管未见异常。
五、CK19和HEA125免疫荧光染色
为了判定植入段胆管覆膜组织的来源,我们进行了胆管上皮组织定性的CK19以及HEA125的免疫荧光检测。结果提示,在人工仿真胆管植入后,新生胆管在形成的过程中,伴随有上皮细胞、黏膜下腺体的形成和增生。在支架组植入术后第15天,与植入段近、远端正常胆管黏膜上皮相比,人工仿真胆管植入段未见明显CK19和HEA125表达,提示无明显上皮及黏膜下腺体形成;植入术后第30天,人工仿真胆管植入段有少量CK19和HEA125表达,提示有上皮及黏膜下腺体开始形成;植入术后第70天,人工仿真胆管植入段可见有较多的CK19和HEA125表达,提示类似胆管上皮和黏膜下腺体样组织增生明显;植入术后第100天,人工仿真胆管植入段的CK19和HEA125表达与植入段近、远端正常胆管黏膜上皮的CK19和HEA125表达相接近,提示在人工仿真胆管管腔内形成更为完整的类似于胆管上皮样组织,但黏膜下CK19和HEA125表达较第70天明显减少(图9、10)。
讨 论
胆管缺损和狭窄性疾病的治疗至今仍是肝胆外科学的难点,目前尚无满意的治疗方案[1-6]。尽管目前已有利用胃窦肌瓣、小肠肌瓣、肝圆韧带组织进行原位修复的一些术式,但大多数术后狭窄率高,术后远期效果远不令人满意。尽管目前大多数学者主张原位修复[4,6],保留Oddi括约肌的功能,但鉴于目前原位修复对病例要求较高,仅少数病例可实施,多数此类病人不得不因胆管缺损较大而接受胆肠吻合术,这种手术方式的并发症包括反流性胆管炎、胆管再次狭窄、胆管结石、胆汁性肝硬化等,而这些并发症的处理难度大、效果差,常需实施多次外科手术或内镜治疗,给病人带来极大的身心痛苦,并为病人家庭和社会带来巨大的经济负担[8-9]。因此,如果能寻找能有效修复胆管缺损或狭窄的替代材料进行原位修复,就能避免胆肠吻合术所带来的一系列弊端,为胆管缺损性和狭窄性疾病的治疗开辟全新的治疗途径。

A~C为植入术后第15天;D~F为植入术后第30天;G~I为植入术后第70天;J~L为植入术后第100天A、D、G、J为植入段近端胆管;B、E、H、K为植入段胆管;C、F、I、L植入段远端胆管图7 支架组植入人工仿真胆管的术后改变(HE染色,×200)

A.植入术后第7天可见炎性细胞浸润,上皮细胞水肿(HE,×200);B.植入术后第7天可见人工仿真胆管炎性细胞浸润,黏膜面水肿(HE,×200);C.植入术后第40天镜下可见结构混乱,无明显黏膜、黏膜下腺体结构,无管腔结构(HE,×400)图8 无支架组动物死亡后植入段远端胆管HE染色
肝外胆管缺乏足够的肌层[10],其损伤或缺损后主要靠纤维结缔组织修复的特性决定了胆管较其他管腔结构更易发生纤维化、狭窄。鉴于人工血管目前已成功地应用于临床治疗[11],人工胆管亦可能成为胆管缺损性疾病和狭窄性疾病的替代性修复材料。但目前人工胆管仍面临无有效的表面组织覆膜、免疫原性较强易诱发免疫排斥反应、易炎性狭窄,无法真正替代胆管功能等问题[12-13]。而本实验初步探讨了应用人工仿真胆管修复体内胆管缺损的实验疗效,研究结果表明,在保留胆总管下端Oddi括约肌功能的基础上,植入的脱细胞基质人工胆管可很好地维持胆管腔的完整性,实验过程中胆管无梗阻、无漏胆发生,再生后的胆管组织能较好地起到替代正常胆管引流胆汁的生理功能的作用,因此人工仿真胆管有可能为胆管狭窄及缺损性病变的治疗提供一个潜在性全新的治疗选择。对于胆管狭窄、闭锁、肿瘤等疾病,以往大多只能选择胆-肠吻合这样的手段来解决。也许在不久的将来,肝胆外科医生可以在切除病灶的基础上选择人工胆管植入进行原位修复,保留了Oddi括约肌的功能,有效防止胆肠吻合带来的一系列并发症,大大提高该类病人的术后远期疗效和生活质量。
众所周知,为了维持胆管正常生理功能,胆管上皮细胞扮演了重要的角色。尽管胆管上皮细胞仅占肝细胞的3%~5%,然而其却在胆汁流经胆管时调整胆汁成分中发挥了重要的功能[14],胆管上皮形成的黏膜还可以阻碍胆汁渗入黏膜下层,避免刺激纤维层的成纤维细胞活化增殖形成瘢痕。CK-19和HEA-125大多存在于胆管上皮细胞、肝细胞等上皮样来源的细胞当中,是迄今为止较为公认的胆管上皮细胞相对特异性的标记物[15-16]。本实验中,对不同阶段植入段胆管CK19、HEA125的动态观察结果显示,在人工仿真胆管植入后,新生胆管在形成的过程中,伴随有上皮细胞、黏膜下腺体的形成和增生。随着植入时间的延长,人工仿真胆管植入段的CK19和HEA125表达与与植入段近、远端胆管黏膜上皮的CK19和HEA125表达愈相接近,提示在人工仿真胆管管腔内逐步形成较为完整的胆管上皮样组织。胆管上皮的成功再生可能得益于较低的炎性反应[9, 17],以及与人工仿真胆管的多孔海绵样组织结构有关,多孔的结构让上皮细胞易于穿透和附着。尽管和正常胆管的单层柱状上皮略有不同,其原因可能是因此局部细胞因子、炎性介质、支架刺激以及胆盐的综合因素结果所致。但CK19、HEA125的免疫荧光结果提示人工仿真胆管覆膜组织来源与正常胆管黏膜上皮相类似,其远期能否形成与正常胆管上皮完全一致的上皮组织有待于后期进一步观察证实。在此需着重指出的是,我们构建的人工仿真胆管表面的覆膜组织无论是否是真正的胆管上皮组织,其能很好的维持胆管缺损修复处的完整性,并保护黏膜下的纤维肌层免被胆汁侵蚀。实验过程中无管腔塌陷,无吻合口狭窄、无梗阻性黄疸,无胆汁渗漏,无胆汁性腹膜炎,胆管引流通畅;可以很好的行使正常的胆管胆汁引流功能,能够较好的达到胆管缺损的修复、重建、人工植入物替代功能。
为了维持良好的胆管引流功能,重中之重的是如何有效避免胆管狭窄。人工仿真胆管植入后所导致的炎症同胆管狭窄密切相关。众所周知,在有感染、创伤、免疫排斥等因素的刺激下,多种细胞会释放IL-6并触发细胞内IL-6的分泌[18],促使炎症局部范围以及血清中IL-6浓度的上升。IL-6在急性炎症中,可以诱导多种炎性细胞合成和分泌急性期蛋白、促进T、B细胞增殖、以及中性粒细胞的激活和定向分化,在炎症中扮演了重要的角色[19-20]。而过度的刺激炎症细胞会大量释放TGF-β1[21],活化成纤维细胞核肌成纤维细胞,诱导成纤维细胞和肌成纤维细胞增生、新生血管形成,刺激巨噬细胞分泌过量的弹力纤维和纤连蛋白等细胞外基质,从而导致瘢痕形成、挛缩引发胆管狭窄。因此,IL-6是一种重要的炎性介质,其水平同炎症程度密切相关[22]。为此,我们前期通过α-gal抗原的免疫组化检测了人工仿真胆管的免疫原性较低[7]。α-gal抗原是一种广泛存在多种细胞中的自然抗原,并且是人体内最大的抗体簇,其IgM以及IgG亚型抗体同植入排斥相关[23]。人工仿真胆管的免疫原性相关研究结果表明α-gal呈低表达;结合体内实验中,支架组的血清IL-6水平在1周内较假手术组轻度升高,1周后血清IL-6水平同假手术组差异无统计学意义,以及支架组动物处死后胆汁无细菌生长,WBC在植入术后第7天后逐渐恢复正常范围,而且组织学提示局部炎性细胞较少,这些结果提示支架组的炎性反应较低,远期再狭窄可能性较低。
本实验中,无支架组实验动物均死亡,解剖发现肝外胆管扩张明显、胆汁淤积,考虑实验动物死于急性梗阻性化脓性胆管炎。解剖发现梗阻层面均位于植入段,而术中人工仿真胆管吻合后可见其充盈良好,梗阻原因是由于手术缝合导致闭塞的可能性小,由于人工仿真胆管材质较软,容易塌陷,且胆管内压力较低,胆管狭窄或闭塞可能是术后胆管周围组织水肿压迫所致。同样也有其他学者报道采用脱细胞基质材料在胆管植入术后容易萎缩和塌陷而导致胆管梗阻的报道[9-17]。本实验采用了内置胆管支撑是基于对人工仿真胆管材料的生物力学特性以及实验动物的特点而考虑的。人工仿真胆管材质偏软,在植入后容易狭窄,尽管内面涂抹了10%PU可以加强其生物力学强度,但是在体内重建实验中仍会塌陷,而置入了支架后可以帮助其维持管腔结构,且实验证明没有影响胆管的重塑和胆管上皮的移行。并且,支架胆管吻合口愈合过程中能起到持续性的局部加压作用,而加压治疗是预防和治疗瘢痕增生的重要方法之一[24]。持续性适当的加压可使瘢痕血管腔变细,血管数量下降,瘢痕中血供减少,且能使血管壁内皮细胞发生退变,加重损伤血管壁,导致瘢痕组织缺血缺氧,组织缺氧导致肌成纤维细胞发生退行性变,释放溶酶体可水解胶原结节,细胞外基质沉积减少;另外细胞内缺氧会导致线粒体水肿,功能减退或者停滞,成纤维细胞增殖受阻,胶原及细胞外基质生成能力减弱,抑制瘢痕形成[25-26]。因此,在本实验中,人工仿真胆管植入术中,于胆管内安置支架的方案被证实是必要的。后续研究中,拟将该支架作为胆管塑形过程中的过渡性支撑,待胆管塑形完成后,可拔出该支架,尽管就目前而言,对于支架支撑的时间长短尚无定论。
本实验证明了脱细胞支架制作的人工仿真胆管有着以下特性:基本可完全降解以及可接受的降解速度、低局部炎症反应及低免疫原性,低细胞毒性等;动物体内实验过程中无管腔塌陷、吻合口狭窄、胆漏、胆管狭窄等并发症发生,很好地行使了胆管引流胆汁的功能,证明其有潜力成为一种较为理想的生物材料应用于临床胆管缺损的替代修补材料。但是就目前而言,要将其应用于临床之前,还有很多的需改进和进一步研究之处。首先,本实验的实验对象为正常的胆管组织,而临床应用往往是针对那些有病变的胆管组织,对于这样的体内环境,胆管重建修复的结果是否与本实验一致还有待于进一步探讨;其次,该人工仿真胆管材料的生物力学强度不够,不能完全维持自身管腔结构,尚需安置胆管支架,对此世界范围尚无一个很好的解决办法,据本实验研究结果推测,在人工仿真胆管的塑形期,安置支架是有必要的,后续研究中,可将该支架作为临时支架,待塑形完成之后,可拔出该类支架;此外,此实验设计时间最长100 d,缺乏新生胆管的远期效果评价;最后,本实验人工仿真胆管植入长度为1 cm,虽然结果较为满意,但1 cm的长度远不足满足未来临床需要,对需要使用长度更长的人工仿真胆管材料才能完成的胆管重建的情况下,其结果还无法预测。目前人工胆管的研究,还仅限于动物实验阶段,虽能较好保持胆管腔完整性以及维持胆管功能,但还有诸多需要进一步研究之处,不过鉴于人工血管已经成功应用于临床,我们有理由相信,通过学者不断的提高和改进,人工胆管也有成功应用临床的一天。
(本文图9见封二,图10见目次Ⅳ)
1 Lillemoe KD,Martin SA, Cameron JL, et al. Major bile duct injuries during laparoscopic cholecystectomy. Follow-up after combined surgical and radiologic management. Ann Surg,1997, 225: 459-471.
2 Frilling A,Li J,Weber F,et al.Major bile duct injuries after laparoscopic cholecystectomy:a tertiary center experience. J Gastrointest Surg,2004,8:679-685.
3 Schmidt SC, Langrehr JM, Hintze RE, et al. Long-term results and risk factors influencing outcome of major bile duct injuries following cholecystectomy.Br J Surg,2005,92:76-82.
4 Pitt HA,Kaufman SL,Coleman J,et al. Benign postoperative biliary strictures. Operate or dilate?. Ann Surg,1989,210:417-427.
5 Pitt HA, Miyamoto T,Parapatis SK,et al. Factors influencing outcome in patients with postoperative biliary strictures.Am J Surg,1982,144:14-21.
6 Chijiiwa K, Yamashita H, Yoshida J, et al. Current management and long-term prognosis of hepatolithiasis.Arch Surg,1995,130:194-197.
7 蒋晓琼,熊先泽,程南生,等.去细胞支架材料用于胆管替代的相容性研究.中国普外基础与临床杂志,2010,3:248-252.
8 Attiah MA, Halpern CH,Balmuri U,et al.Durability of Roux-en-Y gastric bypass surgery: a meta-regression study. Ann Surg,2012,256: 251-254.
9 Miyazawa M,Torii T,Toshimitsu, et al. A tissue-engineered artificial bile duct grown to resemble the native bile duct. Am J Transplant, 2005,5:1541-1547.
10李富宇, 李宁, 蒋力生, 等 浅谈慢性增生性胆管炎在肝内胆管结石防治中的意义. 中华肝胆外科杂志,2008,14:225-228.
11Hu HJ, Xu GL, Li JS, et al. Small-diameter prosthetic H-graft portacaval shunts in the treatment of portal hypertension.Chin Med J, 2004,117:195-198.
12Li Q,Tao L,Chen B,et al. Extrahepatic bile duct regeneration in pigs using collagen scaffolds loaded with human collagen-binding bFGF. Biomaterials,2012,33:4298-4308.
13P rez Alonso AJ,Del Olmo Rivas C,Romero IM,et al.Tissue-engineering repair of extrahepatic bile ducts.J Surg Res, 2013,179:18-21.
14Alpini G, Lenzi R, Sarkozi L, et al. Biliary physiology in rats with bile ductular cell hyperplasia. Evidence for a secretory function of proliferated bile ductules. J Clin Invest,1988,81:569-578.
15de Boer CJ, van Krieken JH, Janssen-van Rhijn CM, et al. Expression of Ep-CAM in normal, regenerating, metaplastic, and neoplastic liver.J Pathol,1999,188: 201-206.
16Wu PC, Lai VC, Fang JW, et al. Hepatocellular carcinoma expressing both hepatocellular and biliary markers also expresses cytokeratin 14, a marker of bipotential progenitor cells. J Hepatol, 1999, 31: 965-966.
17Aikawa M, Miyazawa M, Okada K, et al. Development of a novel reflux-free bilioenteric anastomosis procedure by using a bioabsorbable polymer tube. J Hepatobiliary Pancreat Sci,2010,17:284-290.
18Xing Z, Gauldie J, Cox G, et al. IL-6 is an antiinflammatory cytokine required for controlling local or systemic acute inflammatory responses.J Clin Invest,1998,101:311-320.
19Suwa T, Hogg JC, Quinlan KB, et al. The effect of interleukin-6 on L-selectin levels on polymorphonuclear leukocytes.Am J Physiol Heart Circ Physiol,2002,283:H879-884.
20Steensberg A, Fischer CP, Keller C,et al.IL-6 enhances plasma IL-1ra,IL-10,and cortisol in humans.Am J Physiol Endocrinol Metab, 2003, 285: E433-E437.
21Suwa T,Hogg JC,English D,et al.Interleukin-6 induces demargination of intravascular neutrophils and shortens their transit in marrow.Am J Physiol Heart Circ Physiol,2000,279:H2954-H2960.
22Kukielka GL, Smith CW, Manning AM, et al. Induction of interleukin-6 synthesis in the myocardium. Potential role in postreperfusion inflammatory injury. Circulation,1995,92:1866-1875.
23Galili U,Anaraki F,Thall A,et al. One percent of human circulating B lymphocytes are capable of producing the natural anti-Gal antibody.Blood,1993,82:2485-2493.
24Aikawa M, Miyazawa M, Okada K,et al. Regeneration of extrahepatic bile duct--possibility to clinical application by recognition of the regenerative process.J Smooth Muscle Res,2007,43:211-218.
25Nakamura N, Lill JR, Phung Q, et al. Endosomes are specialized platforms for bacterial sensing and NOD2 signalling.Nature, 2014, 509: 240-244.
26Kuma A,Hatano M, Matsui M,et al.The role of autophagy during the early neonatal starvation period.Nature,2004,432:1032-1036.
