基体改进剂在电感耦合等离子体质谱分析中的应用
2014-02-27陈纯李贝路新燕刘丹高勇
陈纯,李贝,路新燕,刘丹,高勇
(河南省环境监测中心,河南 郑州 450004)
近20年来,电感耦合等离子体质谱仪(ICP-MS )已经广泛应用在环境、地质、石化等行业的多种元素的痕量和超痕量测定中。伴随着仪器分析技术水平的不断发展,分析人员对数据的精确度、干扰的消除、灵敏度的提高以及检出限的降低也提出了更高的要求。ICP-MS分析技术中存在的一些问题,尤其是基体效应问题渐渐显现出来,如等离子体负荷过高导致熄火、积碳在采样锥或截取锥口沉积导致信号淬灭或大幅下降等。为消除这些影响,分析者多采用萃取前处理、加氧、电热进样、加热-冷凝-去溶进样、膜过滤进样等手段,尽可能消除有机物对测试结果的影响。
1 醇类改进剂在ICP-MS分析中的应用
醇类是应用最广泛的ICP-MS基体改进剂。其改善信号的作用机理较为复杂。一般认为,适当浓度的醇类引入ICP后,其对电离能较高的部分元素的信号增敏作用随着元素电离能的增加而增强;而对于低电离能的元素,如Na,K和Ca等,则由于空间电荷效应,呈现出分析信号的抑制[1]。
LARSEN等[2]将甲醇引入待测溶液中,辅以增强的入射频率,可以加强As和Se的ICP-MS信号强度。在适宜的3%体积比的甲醇存在下,As的信号强度约增加了4 500~5 000 CPS /(ng·mL-1),Se的信号强度约增加700~1 100 CPS /(ng·mL-1)。与水溶液相比,两种元素的信号增强倍数为3.5~4.5倍,基线噪声并未增加。
OLIVAS等[3]研究发现,醇类物质使得等离子体中的40Ar37Cl,40Ar38Ar,40Ar2H2等有很大的降低,同时可以使Se的分析信号有高达10倍的增强;在2%的一元醇中,Se的增强是在2%乙腈和2%丙酮中的2~3倍。OLIVAS等也报道了甲醇的加入使汞的信号只提高了1倍多,但HUANG等[4]报道甲醇的加入可以使Hg的信号有10倍的提高,这是由于甲醇和乙腈在雾化过程中可能与Hg形成了一些挥发性化合物,从而使得Hg的传输效率得到提高。这些不一致的观察可能是因为含碳化合物的增敏作用更加取决于仪器的操作条件。
胡兆初等[5]则研究了不同醇溶液对各元素信号的影响因子。研究发现,1%甲醇溶液中,Se信号的增强因子为1.7。引入体积比为7%的甲醇或2%的丙酮后,Se最大的增强因子可以达到3;其他元素的增强因子也相等。其研究表明,对分析元素增敏作用的差异主要跟进入等离子体的碳元素的绝对量有关,而与官能团无关。

TAYLOR等[7]则发现,溶液中的糖类物质容易引起质谱仪中的离子干扰,而乙醇并无此现象。在高质量数区域(60~181)时,当引入高含量的糖类溶液(葡萄糖、果糖和蔗糖)时出现了碳的多原子离子干扰,而引入等效糖类浓度的乙醇和醋酸溶液,在高质量数区域却未见碳的多原子离子干扰。其解释为糖类分子的环状结构和其在ICP中不充足的停留时间的组合影响造成了ICP中糖类分子的离子化程度较低,导致了高质量数区域也出现了碳的多原子离子干扰。
辛仁轩等[8]通过研究乙醇溶液对有机ICP过程的影响,发现主要有2个方面:对雾化进样的影响及对ICP 光源过程的影响。同水溶液进样相比,乙醇溶液进样改变了试液的物性,导致分析物进入等离子体的速率增加,从而改进分析性能。对于具有较低的电离电位和激发电位的稀土元素而言,检出限可以有显著改善。
李冰等[9,10]也研究了乙醇在ICP-MS中的增强效应,同时考察了入射功率和载气流速与增强效应之间的关系。结果发现,加入乙醇后雾化效率提高,认为这可能是乙醇的加入改变了溶液的物理特性,如溶液黏度、溶液表面张力、溶剂分子的相互作用等。在氢化物发生进样与ICP-MS联用分析时,乙醇会引起激发温度和电子密度发生变化,由此会影响到原子化、激发、电离过程[11]。
胡兆初等[12]指出硝酸基体对分析信号的影响不能通过内标(Rh和In)的方法得到纠正,通过把4%的乙醇溶液加入到1%~10%的硝酸基体溶液中,证实了此种方法能较好地抑制硝酸基体对元素分析产生的干扰,对高电离能元素75As,82Se和126Te的抑制作用从30%~40%降低到5%。用ICP-MS对样品中As进行直接测定时,常伴随着Nd2+,Sm2+,Eu2+以及ArCl+的干扰,加入4%的乙醇同时配合提高雾化气流速度,可以解决这两个问题。他们指出,可将4%的乙醇,0.94 L/min的雾化气流速度以及1 350 W的射频功率作为对实际样品的测定条件。在最佳的仪器操作条件下(3%的HNO3,0.98 L/min的载气流速以及1 350 W的射频功率),二价稀土离子(Ce2+)的干扰降低了6.5倍,As的信号强度提高了3倍,并且As的当量浓度(ArCl+干扰影响,根据以3%的HNO3和4%乙醇为介质的外标溶液校正计算而得)降低了一个数量级,这为ICP-MS直接测定地质和环境样品的As提供依据。
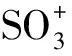
胡兆初等[15,16]以异丙醇为基体介质,对比研究了不同浓度异丙醇中各元素的质谱行为。并采用基体效应判别因子对不同元素在异丙醇基体中的ICP-MS行为进行了分类。结果表明:(1)低于60mmol/L异丙醇基体对大多数元素具有增敏效应;在特定仪器条件下,>100 mmol/L的异丙醇基体反而会对元素的分析信号产生严重的抑制效应。随着浓度的增加,一级电离能大的元素受到的抑制程度也越大,这是因为,适量的异丙醇可以有效降低干扰氧化物的产率,但过高浓度的异丙醇会对等离子体中心通道产生局部冷却,进而降低了分析物的电离度,使分析信号降低的同时,促进了氧化物产率的增加。
胡兆初等[15-17]利用甲醇、丙酮对ICP-MS测定7Li~238U各元素时基质的影响及干扰氧化物的产率进行了研究[17,40,41]。发现甲醇、丙酮的浓度、分析元素的电离能以及仪器操作条件的变化会引起分析信号的加强或抑制;且随元素质量数的增加,甲醇、丙酮对元素的增强效应有减少的趋势。认为,分析信号的加强主要是因为甲醇、丙酮的引入改变了分析元素在ICP中的电离特性及其离子在电感耦合等离子体中的空间分布,促使等离子体中轻质量元素的被采样锥提取的效率提高。甲醇、丙酮对分析信号的影响主要受到碳存在的影响;对高电离能的元素As和Se,碳的电荷转移反应是其增敏的主要原因。
DRESSIER等[18]对乙醇溶液在高功率、低雾化气流速的操作条件下对分析的影响进行了探索,结果发现和水溶液相比,乙醇溶液下的Ba2+/Ba+分析信号比更低,各种溶液下CeO+/Ce+的情况则较为类似。元素分析信号在有机介质中被加强, CeO+/Ce+干扰信号比可低于3%,这种增强对元素Se,As 和Hg较为显著。
LIORENTE等[19]对单元醇、多元醇以及有机酸等有机试剂在ICP-MS测定Se时的作用及机理进行了讨论。结果表明,少量(如4%)的甲醇、乙醇、糖类、乙二醇以及酒石酸的加入,配合相应的仪器操作条件,能够显著提高Se与干扰离子信号比。4%的乳酸和甘油的加入能有效降低40Ar37Cl+的干扰,4%甘油的加入使Se/ArCl信号比高于无氯化物时。指出,与单元醇相比,基体中引入多元醇和有机酸对最佳雾化气流速影响相对较小;加入有机试剂后,等离子体功率越高,最佳雾化气流速向低流速方向迁移越小。与水溶液体系相比,采用相对较高的功率和较低的雾化气流速,有利于含有机试剂的样品分析[19-21]。
2 烃类及其衍生物在ICP-MS分析中的应用
烃类及其衍生物一般多生成多原子分子离子,通过碰撞或反应来降低干扰,改善信噪比。HILL等[22]认为雾化器中甲烷的引入能有效地减少某些元素测定时的离子干扰。对雾化气流速、功率及甲烷添加比都进行了研究,得出甲烷的加入并没有对分析结果造成太大影响,但却显著降低了背景值及ArCl+,ArO+,ClO+和MO+在ICP-MS测定中的干扰,且在仪器的最佳操作条件下,雾化气体中甲烷的加入可以完全去除ArCl+的干扰,将10% HCl中的As的检出限提高到0.75 ng/mL,减少大部分ArO+和ClO+的干扰,将10% HCl中Fe和V的检出限分别提高到0.48和 2.52 ng/mL,其可以将MO+的干扰降低10倍。
PARK等[23]发现有机气体的引入能提高分析物ICP-MS测定的检出限、准确度以及精密度。少量甲烷(10 mL/min)的引入能增强样品中As,Se和Ge的分析信号,对测定时的干扰也具有很好的抑制效果。且Ar/CH4体系的测定灵敏度至少为传统单独Ar体系的2倍,As,Se和Ge的检出限分别达到0.064 ,0.014和0.012 mg/L,运用NIST SRM方法在此体系中对冻干尿液样本进行分析,得到As,Se和Ge的回收率分别为103%,99.9%和96.5%,此种方法同样适用于生物样品在ICP-MS中的测定。与引入有机试剂不同,甲烷的引入对降低氧化物离子的干扰更为显著。
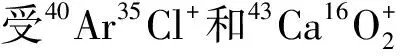
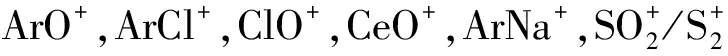
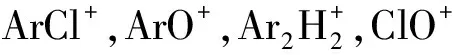
3 其他有机类改进剂在ICP-MS分析中的应用
GAMMELGARD等[31]对尿液中Se的测定方法及其增敏试剂、仪器参数、内标盐含量对尿基质的影响等进行了研究,对几种含碳有机溶液(甲醇,乙醇,丙醇,丁醇,甘油,乙腈和乙酸)的灵敏度增强效应进行了考察[31]。结果表明,依赖于优化的雾化器的载气流量和射频功率,Se增强因子达到了6。在最佳雾化气体流速下,7种含碳有机溶液的增强效应没有表现出重要差别。在相应优化的仪器操作条件下,不同溶剂的增强实验中,不同Se物种的灵敏度是相同的。
ALLAIN等[33]研究了甘油和葡萄糖等在ICP-MS分析中的基体效应。发现这些有机物对第一电离能较高的元素Hg,As,Au,Se和Te等(约在9~11eV之间)具有特殊增强效应。认为,由于碳的存在使等离子体中离子的生成过程发生了变化,最终导致分析信号增加。在载气中加入部分甲烷,结果发现,对高电离能元素同样有强烈的增敏作用,但其增敏作用与雾化效率无关。
KARUNASAGAR等[28]对不同浓度的乙腈作基体改进剂对Cd的ICP-MS测定的影响进行了讨论,结果发现乙腈的引入能有效抑制氧化钼的干扰,准确测定了微克升量级的Cd并获得了很好的加标回收率。结果表明,乙腈能明显降低氧化钼的产率。认为这主要是因为乙腈分子中的氰基的存在有利于反应MO=M+1/2O2进行,而对于异丙醇,由于其N原子的缺失而无法形成氰基。
胡兆初等[30]也研究了在EDTA介质中不同质量范围元素的ICP-MS质谱行为,探讨了不同质谱条件下低浓度EDTA对不同元素分析信号的影响。结果表明,EDTA的引入对不同质量数的元素的灵敏度影响不一,但氧化物产率均明显降低。对轻质量元素9Be,59Co信号增强约100%,中质量元素115In,159Tb信号增强约20%,重质量元素209Bi、238U信号变化不明显;相同条件下,与水溶液相比,EDTA介质的CeO+/Ce+、LaO+/La+产率约降低10%,有效降低了多原子离子干扰,这可能是由于EDTA介质中碳参与竞争反应,生成了CO以代替了部分干扰氧化物的生成。与2% HNO3介质相比,在相同功率条件下,EDTA介质中信号达最佳时需采用雾化气流速略低一些,这可能是由于有机试剂分解消耗掉了部分能量,分析物需要在等离子体中心通道停留更多的时间,以充分原子化激发电离。还对钠盐对元素质谱行为的影响也做了讨论,结果表明,易电离元素(K,Na等)无论以何种形式被引入,都会对测定元素产生严重的抑制,且抑制强度随元素质量数的增大而减小。而大量研究结果也表明[8,13,18,30-32,34,35],在ICP-MS中引入乙醇、异丙醇、甲醇、丙酮、EDTA等对干扰氧化物产率有一定的影响,但对Ce氧化物产率的抑制都不大于1.3倍。
LONGERICH等[36]研究了1%的硝酸、1%的醋酸、12%的醋酸、1%的乙醇及12%的乙醇等溶液对元素的ICP-MS测定时的基体效应。结果表明,有机基体存在时,高功率和高等离子体气流速可以维持等离子体的相对稳定;ICP-MS可直接分析高达12%的乙醇基体样品;在每种有机基体中都需要对雾化气流速进行优化以获得最大的灵敏度。
HAUSLER等[37]也报道了采用二甲苯作稀释剂,在等离子气中加入约2%的氧气,并提高ICP的入射功率来直接测定石油中痕量元素的方法。
MARSHALL等[38]报道了甲基丙烯酸的引入也会显著抑制ICP-MS中存在的多原子离子及分子离子干扰,但其具体对分析信号的影响还受仪器操作条件及甲基丙烯酸浓度的影响。如用水溶液的标准曲线法则仍然会存在误差(5%m/v的甲基丙烯酸存在下,偏差范围为1%~18%),且这种误差在检测多种元素的情况下不能通过内标法加以矫正,为避免出现此类校准问题,建议对仪器操作条件等进行优化后使用标准加入法进行测定分析。
曹淑琴等[39,40]研究了ICP-MS测定样品中Hg时,乙二胺和三乙醇胺等物质的引入对其响应信号的影响,并对其机理进行了探讨。结果发现,少量氨水,乙二胺和三乙醇胺的引入能使Hg的信号增强,但引入氨水的增强程度小于乙二胺和三乙醇胺。随着雾化气流速的增加,增强信号有所降低,引入氨水的降低程度也小于乙二胺和三乙醇胺。同样的雾化气流速时,随着射频功率的提高,Hg的信号强度也越大。他们发现,Hg信号的增强是由于3种物质的引入和溶液中的Hg离子发生了作用,提高了Hg的传送效率所致。实验还表明,在优化的操作条件下,乙二胺和三乙醇胺的引入能使Hg的检出限降低,运用这种方法测定标准参考物质中的Hg,分析结果十分接近真值。
4 无机类化学改进剂在ICP-MS分析中的应用
LARSEN等[2]把碳元素以碳铵形式加入待测溶液中,辅以增强的入射频率,加强了As和Se的ICP-MS信号强度。但是碳元素以碳铵的形式加入会导致ICP-MS仪器的碳污染,但这不影响其能使As的分析信号强度成倍增加。
BEAUCHEMIN等[20]报道了ICP-MS测定总As时,氮的引入可以克服40Ar35Cl+的潜在干扰。
曹淑琴等[39,40]研究了ICP-MS测定样品中Hg时,氨水的引入对其响应信号的影响。结果发现,少量氨水的引入对Hg的分析信号有显著的增强效应。
5 结论
基体改进技术虽然在ICP-MS中得到一定的应用,但是其并未能如石墨炉的基体改进剂一样获得大家的共识,对其研究也多停留在“基体效应”层面上,其实验数据及相关理论的积累还远远不够,而其影响ICP-MS分析的原因的探讨也明显不足,业界至今还没有形成一致说法。对仪器生产厂商、相关分析人员在特定实验条件下对特殊样品和典型元素进行分析的指导性也不够强。随着分析技术的不断发展,ICP-MS基体改进剂的机理探索及复合使用等有望获得进一步的突破;其对ICP-MS分析技术的进一步拓展应用范围,提高分析水平具有重要意义。
[1] AL-AMMAR A S,REITZNEROVA E,BARNES R M.Feasibility of using beryllium as internal reference to reduce non-spectroscopic carbon species matrix effect in the inductively coupled plasma-mass spectrometry (ICP-MS) determination of boron in biological samples[J].Spectrochim Acta Part B,1999,54:1813-1820.
[2] LARSEN E H,STURUP S.Carbon-enhanced inductively coupled plasma mass spectrometric detection of arsenic and selenium and its application to arsenic speciation[J].J Anal At Spectrom,1994(9):1099-1105.
[3] OLIVAS R M,QUETEL C R,DONARD O F.Sensitive determination of selenium by inductively coupled plasma mass spectrometry with flow injection and hydride generation in the presence of organic solvents[J].J Anal At Spectrom,1995(10):865-870.
[4] HUANG C,JIANG S.Speciation of mercury by reversed-phase liquid chromatography with inductively coupled plasma mass spectrometric detection[J].J Anal At Spectrom,1993(8):681-686.
[5] HU Z C,HU S H,GAO S,et al.Volatile organic solvent-induced signal enhancements in inductively coupled plasma-mass spectrometry: a case study of methanol and acetone[J].Spectrochim Acta Part B,2004,59: 1463-1470.
[7] TAYLOR V F,MARCH R E,LONGERICH H P,et al.A mass spectrometric study of glucose,sucrose,and fructose using an inductively coupled plasma and electrospray ionization[J].Int J Mass Spectrom,2005,243: 71-84.
[8] 辛仁轩.电感耦合等离子体质谱中有机试剂的基体效应研究[J].光谱学与光谱分析, 2000(20):498-500.
[9] 李冰,尹明.乙醇在电感耦合等离子体质谱中的增强效应研究[J].光谱学与光谱分析,1995(15):35-40.
[10] 李冰,吴列平,尹明,等.乙醇增强氢化物发生电感耦合等离子体质谱法测定砷锑铋硒的研究[J].岩矿测试,1999,18: 101-110.
[11] GOOSSENS J,VANHAEEKE F,MOENS L,et al.Elimination of intereferences in the Determination of Arsenic and Selenium in biological samples by inductively coupled Plasma mass spectrometry[J].Anal Chim Acta,1993,280:137-143.
[12] HU Z C,GAO S,HU S H,et al.Suppression of interferences for direct determination of arsenic in geological samples by inductively coupled plasma mass spectrometry[J].J Anal At Spectrom,2005(20):1263-1269.
[13] VANHAECKE F,DAMS R,VANDECASTED C.Zone model as an explanation for signal behaviour and non-spectral interferences in inductively coupled plasma mass spectrometry[J].J Anal At Spectrom,1993(8):433-438.
[14] PAN C,ZHU G,BROWNER R F.Comparison of desolvation effects with aqueous and organic (carbon tetrachloride) sample introduction for inductively coupled plasma atomic emission spectrometry[J].J Anal At Spectrom,1990(5):537-542.
[15] 胡兆初,胡圣虹,刘勇胜,等.异丙醇介质中基体效应及元素的电感耦合等离子体质谱行为研究[J].三峡大学学报,2002,24: 465-469.
[16] 胡兆初.有机介质中元素的电感耦合等离子体质谱(ICP-MS)行为特性研究[R].武汉:中国地质大学,2003:10-15.
[17] 胡兆初.有机基体改进溶液和激光剥蚀进样电感耦合等离子体质谱在大陆地壳疑难元素丰度研究中的应用[R].西安:西北大学,2006:17-18.
[18] DRESSLER V L,POZEBON D,CURTIUS A.Introduction of alcohols in inductively coupled Plasma mass spectrometry by a flow injection system[J].Anal Chim Acta,1999,379:175-183.
[19] LIORENTE L,GOMEZ M,CAMARA C.Improvement of selenium determination in water by inductively coupled plasma mass spectrometry through use of organic compounds as matrix modifiers[J].Spectrochim Acta Part B,1997,52:1825-1838.
[20] BEAUCHEMIN D,SIU K W,MCLAREN J W,et al.Determination of arsenic species by high-performance liquid chromatography-inductively coupled plasma mass spectrometry[J].J Anal At Spectrom,1989(4):285-289.
[21] 胡兆初,胡圣虹,刘勇胜,等.醋酸基体浓度变化对元素ICP-MS行为的影响[J].基体研究与应用,2003,15:64-66.
[22] HILL S J,FORD M J,EBDON L.Investigations into the application of methane addition to the nebulizer gas in inductively coupled plasma mass spectrometry for the removal of polyatomic interferences[J].J Anal At Spectrom,1992(7):1157-1165.
[23] PARK K S,KIM S T,KIM Y M,et al.Application of methane mixed plasma for the determination of Ge,As,and Se in serum and urine by ICP-MS[J].Bull Korean Chem Soc ,2003(24):285-290.
[24] PLOTZNER I,SALA J V,MOUSTY F.Signal enhancement and reduction of interferences in inductively coupled plasma mass spectrometry with an argon-trifluoromethane mixed aerosol carrier gas[J].J Anal At Spectrom,1994(9):719-726.
[25] EBDON L,FORD M J,HUTTON R C,et al.Evaluation of ethene addition to the nebulizer gas in inductively coupled plasma-mass spectrometry for the removal of matrix-,solvent-,and support-gas-derived polyatomic ion interferences[J].Appl Spectrosc,1994,48: 507-516.
[26] LIORENTE L,GOMEZ M,CAMARA C.Improvement of selenium determination in water by inductively coupled plasma mass spectrometry through use of organic compounds as matrix modifiers[J].Spectrochim Acta Part B,1997,52: 1825-1838.
[27] PARK K S,KIM S T,KIM Y,et al.The Matrix Effect of Biological Concomitant Element on the Signal Intensity of Ge,As,and Se in Inductively Coupled Plasma/Mass Spectrometry[J]. Bull Korean Chem Soc,2002(23):389-393.
[28] KARUNASAGAR D,ARUNACHALAM J.Determination of cadmium by inductively coupled plasma mass spectrometry-reduction of molybdenum oxide interferences by addition of acetonitrile[J].Anal Chim Acta,2001,441:291-296.
[29] EVANS H E,EBDON L.Simple approach to reducing polyatomic ion interferences on arsenic and selenium in inductively coupled plasma mass spectrometry[J].J Anal At Spectrom,1989(4):299-300.
[30] 胡兆初,胡圣虹,帅琴,等.EDTA介质中元素的ICP-MS行为研究[J].分析实验室,2002,21: 1-5.
[31] GAMMELGARD B,JONS O.Determination of selenium in urine by inductively coupled plasma mass spectrometry: interferences and optimization[J].J Anal At Spectrom,1999(14):867-874.
[32] EVANS E H,EBDON L.Effect of organic solvents and molecular gases on polyatomic ion interferences in inductively coupled plasma mass spectrometry[J].J Anal At Spectrom,1990(5):425-430.
[33] ALLAIN P,JAUNAULT L,MAURAS Y,et al.Signal enhancement of elements due to the Persence of carbon-containing compounds in induetively coupled Plasma mass spcetrometry [J].Anal Chem,1991,63:1497-1498.
[34] KRALJ P,VEBER M.Investigations into nonspectroscopic effects of organic compounds in inductively coupled plasma mass spectrometry[J].Acta Chim Slov,2003,50: 633-644.
[35] RODUSHKIN I,NORDLUND P,ENGSTROM E,et al.Improved multi-elemental analyses by inductively coupled plasma-sector field mass spectrometry through methane addition to the plasma[J] .Anal At Spectrom,2005,20:1250-1255.
[36] LONGERICH H P.Effect of nitric acid,acetic acid and ethanol on inductively coupled plasma mass spectrometric ion signals as a function of nebuliser gas flow,with implications on matrix suppression and enhancements[J].Anal At Spectrom,1989(4):665-667.
[37] HAUSLER D.Trace element analysis of organic solutions using inductively coupled plasma-mass spectrometry[J].Spectrochim Acta Part B,1987,42: 63-73.
[38] MARSHALL J,FRANKS J.Matrix interferences from methacrylic acid solutions in inductively coupled plasma mass spectrometry[J].J Anal At Spectrom,1991(6):591-600.
[39] 曹淑琴,陈杭亭,曾宪津.电感耦合等离子体质谱中有机试剂的基体效应研究[J].光谱学与光谱分析,2000,20:498-500.
[40] CAO S Q,CHEN H T,ZENG X J.Determination of mercury in biological samples using organic compounds as matrix modifiers by inductively coupled plasma mass spectrometry[J].J Anal At Spectrom,1999(14):1183-1186.
