18F-FES在乳腺癌患者体内摄取与病理免疫组化的关系
2014-02-27孙艺斐杨忠毅张勇平王明伟姚之丰薛静
孙艺斐 杨忠毅 张勇平 王明伟 姚之丰 薛静
鲍晓1 杨文涛2 沈镇宙3 邵志敏3 章英剑1
1.复旦大学附属肿瘤医院核医学科,复旦大学上海医学院肿瘤学系,上海 200032;2.复旦大学附属肿瘤医院病理科,复旦大学上海医学院肿瘤学系,上海 200032;3.复旦大学附属肿瘤医院乳腺外科,复旦大学上海医学院肿瘤学系,上海 200032
18F-FES在乳腺癌患者体内摄取与病理免疫组化的关系
孙艺斐1 杨忠毅1 张勇平1 王明伟1 姚之丰1 薛静1
鲍晓1 杨文涛2 沈镇宙3 邵志敏3 章英剑1
1.复旦大学附属肿瘤医院核医学科,复旦大学上海医学院肿瘤学系,上海 200032;2.复旦大学附属肿瘤医院病理科,复旦大学上海医学院肿瘤学系,上海 200032;3.复旦大学附属肿瘤医院乳腺外科,复旦大学上海医学院肿瘤学系,上海 200032
背景与目的:16α-18F-17β-雌二醇(18F-FES)作为雌激素受体(estrogen receptor, ER)特异性显像剂,可在活体内反映ER的表达状况。本研究主要探讨乳腺癌患者体内18F-FES摄取结果与病理免疫组化的相关性。方法:自行制备18F-FES,入组26例乳腺癌患者(17例原发性乳腺癌,9例复发转移性乳腺癌),分别进行18F-FES及18F-FDG PET/CT显像,对每例患者进行空心针穿刺或手术治疗,对比相应病灶的免疫组化和18F-FES、18F-FDG摄取结果。结果:96.15%(25/26)的患者18F-FES结果与ER病理免疫组化一致,以18F-FES SUVmax≥1.5为ER阳性,18F-FES PET/CT显像诊断乳腺癌病灶ER阳性的灵敏度为93.33%,特异度为100%。ER、PR的免疫组化结果与18F-FES的SUVmax呈明显的正相关;HER-2/Neu的免疫组化结果与18F-FES的SUVmax呈负相关。结论:18F-FES有望用于全面反映乳腺癌患者全身病灶的ER表达情况,为临床个体化治疗方案的制定提供帮助。
雌激素受体;免疫组化;18F-FES;18F-FDG;ER亚型
乳腺癌是女性最常见的恶性肿瘤之一,发病率呈不断上升趋势。临床通常采用手术、放化疗和内分泌等综合治疗。内分泌治疗是否有效很大程度取决于乳腺癌病灶雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)的表达情况[1-2]。目前临床及科研检测ER和PR最常用的方法为免疫组化法。但该种检测方法为有创、离体测定,无法反映全身所有病灶的ER表达情况。随着分子影像技术的不断发展,PET/CT显像在乳腺癌中的应用日益增多,16α-18F-17β-雌二醇(18F-FES)作为ER特异性显像剂,可在活体内反映ER的表达状况,从而指导临床选择个体化的治疗方案[3]。本研究主要探讨乳腺癌病灶摄取18F-FES程度与病理免疫组化的相关性,为进一步开展临床研究提供客观指标。
1 资料和方法
1.1 研究对象
入组2010年8月—2012年9月于复旦大学附属肿瘤医院就诊的乳腺癌患者26例。入组标准:①近2个月未行放疗或化疗;②如服用ER拮抗剂类内分泌药物者须停用5周,芳香化酶抑制剂类药物可以正常使用;③患者病灶最长径≥0.8 cm。对每例患者都进行空心针穿刺或手术切除,了解相应病灶的PR、HER-2、ER及Ki-67的表达情况。入组患者都分别签署了18F-FES和18F-FDG PET/CT显像的知情同意书。
1.2 显像药物和设备
18F-FES和18F-FDG均由本院核医学科自行制备,放射化学纯度>95%。其中18F由Siemens Eclips ST回旋加速器制备;18F-FES使用Siemens Explora GN多功能合成模块和Explora LC液相色谱分离模块,同时结合自制的固相萃取装置,采用“一锅法”完成合成和分离[4];18F-FDG由Explora FDG4合成模块生产。显像仪器为Siemens biograph 16HR。
1.3 PET/CT显像
患者在1周内分别进行18F-FES和18F-FDG PET/CT显像,以18F-FDG PET/CT的显像结果确定病灶的部位及大小。
18F-FES PET/CT显像前静脉注射6 mCi(222 MBq)的18F-FES,2 min内缓慢推注,1 h后上机检查。
18F-FDG PET/CT显像前禁食4 h以上,血糖必须控制在10 mmol/L以下。按7.4 MBq/kg(0.2 mCi/kg)静脉注射后安静休息45~60 min,显像前排空膀胱,再饮水600~1 000 mL以充盈胃。
PET/CT显像时,先采集CT图像,扫描范围从颅底至股骨中段,扫描参数:电压120 kV,电流80~250 mA,螺距3.6。在同一范围用三维模式采集PET图像,每床位2~3 min,然后自动利用CT数据对PET图像进行衰减校正,进行图像重建和融合。图像采用有序子集最大期望值法(OSEM)迭代重建。
1.4 图像分析
重建图像以冠状、水平、矢状三方向断层像和三维容积像电影方式显示,由2位核医学科医师独立视觉判断,并对病灶行最大标准摄取值(SUVmax)半定量分析。参考国外一些18F-FES PET/CT的研究[5-6],本研究以1.5为阈值,SUVmax≥1.5的病灶定为ER阳性,反之为ER阴性。
1.5 免疫组化ER分析方法
本院病理科对ER/PR的判断标准采用Allred score方法,根据染色阳性细胞的比例和染色强度,阳性细胞比例<1%为(-);1%≤阳性细胞比例<10%为(+);10%≤阳性细胞比例<50%为(++);阳性细胞比例≥50%为(+++);染色强度分为弱、中、强,若染色强度弱,则阳性级别下降一级。如:阳性细胞比例为40%判定为(++),但染色强度为弱,则判定为(+)。
1.6 统计学处理
采用SPSS 16.0进行数据处理,采用Spearman做相关分析,P<0.05为差异有统计学意义。
2 结 果
2.1 患者的基本情况
26例患者皆为女性,平均年龄(55.6±9.3)岁(2 8~6 5岁),绝经后患者1 5例,病理类型皆为浸润性导管癌,肿块平均为(2.8±2.0)cm(0.8~10.2 cm),病理免疫组化显示ER阳性共15例。26例患者中,17例为原发性乳腺癌,5例胸壁复发,4例淋巴结转移。
2.2 18F-FES显像表现
静脉注射18F-FES,1 h后显像,正常器官组织中,胆囊处可见最高的生理性放射性分布(SUVmax:55.8~98.5)。除胆囊外,放射性分布较高的脏器组织依次为:胆管(SUVmax:26.0~37.5)、膀胱(SUVmax:17.0~24.3)、回肠(SUVmax:13.4~22.3)、肝脏(SUVmax:14.2~19.4)、子宫(SUVmax:5.6~9.9)、肾盂(SUVmax:4.6~8.5)、空肠(SUVmax:4.0~8.3)、肾实质(SUVmax:2.8~3.3)、胰腺(SUVmax:1.8~3.6)、心肌(SUVmax:1.9~2.3)。骨骼、肌肉、肺、乳腺等处均未见明显放射性分布(SUVmax:0.5~1.1)。ER阳性的患者图像中,除了上述所见外,在病灶部位可见均匀分布的放射性摄取,而非局灶性的放射性摄取。
2.3 18F-FES显像诊断ER表达价值
26例患者中,25例18F-FES结果与ER病理免疫组化一致,符合率达96.15%(表1)。以免疫组化结果为ER诊断金标准,以FES SUVmax≥1.3为ER阳性,假阳性1/16,假阴性0/10,灵敏度为100%,特异度为90.91%,阳性预测值为93.75%,阴性预测值为100%,ROC曲线下面积为0.955;以FES SUVmax≥1.5为ER阳性,则假阳性0/14,假阴性1/12,灵敏度为93.33%,特异性为100%,阳性预测值为100%,阴性预测值为91.67%,ROC曲线下面积为0.967。免疫组化ER阳性、18F-FES PET/CT显像亦阳性患者见图1,两者均为阴性的患者见图2,18F-FES SUVmax处于1.3这一临界值、免疫组化分别为阳性和阴性的2例患者PET/CT图像见图3。

表1 病灶PET/CT显像结果与免疫组化结果Tab. 1 Lesions on PET/CT and ER assays

图1 免疫组化ER阳性(+++,编号25)患者18F-FES PET/CT显像Fig. 1 Patient No.25 with ER positive (+++) detected by18F-FES PET/CT

图2 免疫组化ER阴性(编号1)患者18F-FES PET/CT显像Fig. 2 Patient No.1 with ER negative (-) detected by18F-FES PET/CT
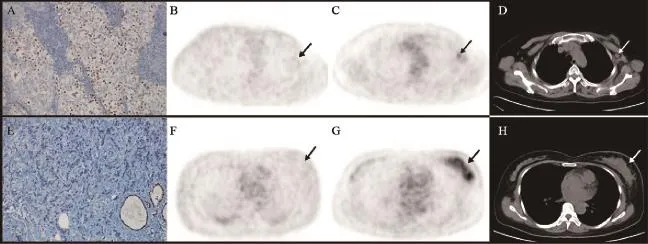
图3 18F-FES PET/CT显像结果不确定患者(SUVmax均处临界值1.3)Fig. 3 The controversial results of18F-FES PET/CT imaging (SUVmaxwas 1.3)
2.4 18F-FES与病理免疫组化关系
通过分析26例患者的数据,本研究发现ER、PR的免疫组化结果与18F-FES的SUVmax呈明显的正相关(相关系数分别为r=0.724,P<0.001及r=0.776,P<0.001);HER-2/Neu的免疫组化结果与18F-FES的SUVmax呈负相关(相关系数r=-0.587,P=0.002);Ki-67指标与18F-FDG的SUVmax呈正相关(相关系数r=0.578,P=0.004);肿块的大小与18F-FDG SUVmax呈明显正相关(相关系数r=0.564,P=0.003,表2)。
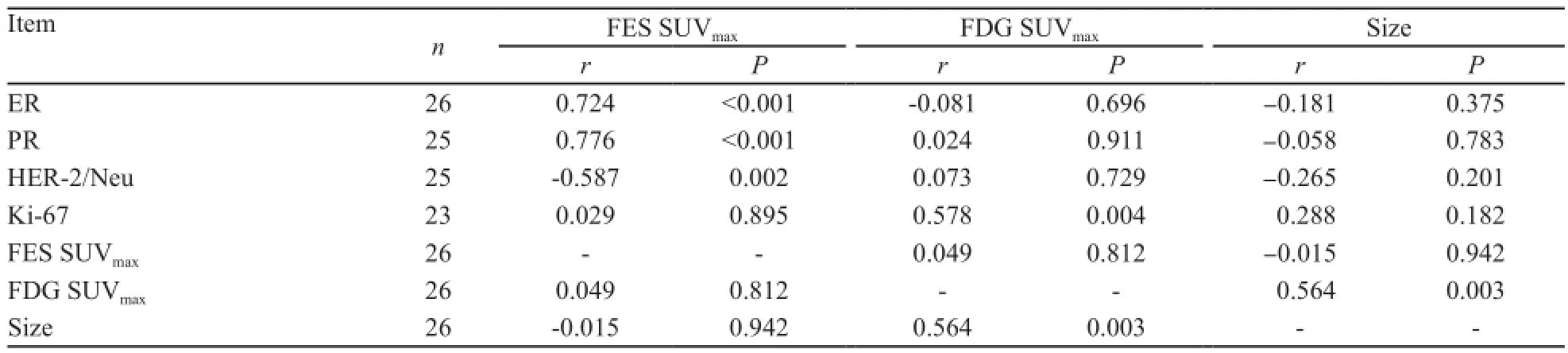
表2 PET/CT显像结果与免疫组化关系Tab. 2 The concordance between PET/CT imaging and immunohistochemical assays.
3 讨 论
FES是一种雌激素类似物,与雌激素有相似的结合特性,能够特异地与ER结合。FES与其他类固醇激素类似,静脉注入后很快被肝脏摄取代谢,并通过消化道排泄,胆汁中的代谢产物又经过小肠重吸收,所以FES在肝脏、小肠等处有很高的生理性摄取。由于注射FES后肝内快速聚集,所以血中清除很快,在注射后20 min,仅20%非代谢状态的FES存在于血液循环中,血液浓度在注射后20~30 min达到峰值。本研究结果与文献一致[7-8]。个别患者见注射侧血管有条索状放射性分布,这可能与2 min的缓慢静脉推注有关,两者之间的关系还有待进一步研究。
FES与ER特异性结合,其摄取客观反映了患者体内ER的分布及其生物活性,故可以被用来预测乳腺肿瘤ER的表达。Dehdashti等[9]对21例转移性乳腺癌患者进行研究,对比了粗针活检测定ER与18F-FES PET结果,符合率为88%,低于本研究结果。原因可能与该研究所使用的仪器为不带CT的早期PET有关,不能进行厚度衰减校正与定位,而且以SUVmax≥1.0来判定病灶ER阳性。
进一步分析本次入组的26例患者显像结果,可以发现编号为12、15的患者,病理免疫组化证实其病灶ER表达为阳性(++)及强阳性(+++),而18F-FES的SUVmax仅为1.3及1.5;出现此结果的原因可能是部分容积效应所致,因为这2例患者病灶最长径仅为1.0 cm及0.8 cm,可使SUVmax低于真实值。
ER有两种亚型:一种为传统的ERα,另一种为新近研究发现的ERβ,两者的配体结合区60%同源,这就意味着两者对雌激素的亲和力是不同的。不同病灶中由于两种受体亚型的组成比例不同,就会导致病灶对雌激素的结合能力不尽相同[10-11]。18F-FES作为一种雌激素类似物,与雌激素有相似的结构性,所以其对ER的两种亚型也应具有不同的亲和力。Tsujikawa等[12]的研究结果提示,在子宫内膜癌患者中,FES的摄取与ERα亚型呈明显的正相关,ERα比例越高,FES的摄取程度越高。同时本院病理免疫组化检测的ER也是ERα,可以推论FES摄取程度与免疫组化的阳性程度应有良好的相关性。本研究发现,编号17患者的病理免疫组化结果为强阳性(+++),18F-FES的SUVmax为2.9,编号26患者病理免疫组化结果为阳性(++),18F-FES的SUVmax却为9.0,而两者肿块均超过2.0 cm。出现这种FES摄取程度与免疫组化阳性程度不一致的原因,从病理免疫组化的角度来分析,可能与活检时取材有限有关。由于活检取材的局限性,未能完全反应整个肿块的ER受体情况。
在乳腺癌的发展进程中,ERα与ERβ究竟扮演何种角色尚无定论。多数研究表明,ERβ对正常乳腺组织具有保护作用,可对抗ERα的促肿瘤生长作用,诱导肿瘤细胞凋亡,抑制肿瘤细胞增殖,其表达缺失可能对乳腺癌的发生、发展具有极其重要的意义[13-16]。然而,也有研究发现,ERβ过度表达对乳腺癌细胞增殖具有促进作用[17-18]。因此,ERα和ERβ各自的表达状态及两者的相互作用对肿瘤细胞生物学特性的影响值得进一步探讨。这也许可以成为核医学今后在乳腺癌显像方面的发展方向。
在复发转移的乳腺癌患者中,复发转移灶的ER表达与原发灶不完全一致。Mortimer等[19]发现24%(4/17)的转移性乳腺癌患者在不同部位病灶之间FES摄取存在差异性;Amir等[20]报道约12.6%的ER阳性的原发乳腺癌患者,其复发转移病灶与原发病灶的ER表达不同;此外,Simmons等[21]发现40%的乳腺癌患者转移灶的ER/PR表达与原发灶不一致。综上所述,由于18F-FES与病理免疫组化结果有良好的一致性,其在肿瘤组织中的分布与E R有关,有望用于全面反映乳腺癌肿瘤患者全身病灶的E R表达情况,为临床个体化治疗方案的制定提供帮助。
本科自行制备的FES与免疫组化ER的符合率达96.15%,能很好显示ER阳性病灶,有望进一步用于临床应用。
[1]ROSE C, THORPE S M, ANDERSEN K W, et al. Beneficial effect of adjuvant tamoxifen therapy in primary breast cancer patients with high estrogen receptor values [J]. Lancet, 1985, 1(8419): 16-19.
[2]BERTELSEN C A, GIULIANO A E, KEM D H, et al. Breast cancers: estrogen and progesterone receptor status as a predictor of in vitro chemotherapeutic response [J]. J Surg Res, 1984, 37(4): 257-263.
[3]ALMUBARAK M, OSMAN S, MARANO G, et al. Role of positron emission tomography scan in the diagnosis and management of breast cancer [J]. Oncology (Williston Park), 2009, 23(3): 255-261.
[4]张勇平, 章英剑, 王明伟, 等. 基于Explora GN/LC双模块的16α-[18F]氟-17β-雌二醇全自动化合成 [J]. 中华核医学杂志, 2011, 31(3): 196-200.
[5]PETERSON L M, MANKOFF D A, LAWTON T, et al. Quantitative imaging of estrogen receptor expression in breast cancer with PET and 18F-fluoroestradiol [J]. J Nucl Med, 2008, 49(3): 367–374.
[6]KRUCHTEN M, GLAUDEMANS A W, VRIES E F, et al. PET imaging of estrogen receptors as a diagnostic tool for breast cancer patients presenting with a clinical dilemma[J]. J Nucl Med, 2012, 53(2): 182-190.
[7]KIESEWETTER D O, KILBOUM M R, LANDVATTER S W, et al. Preparation of four fluorine- 18-labeled estrogens and their selective uptakes in target tissues of immature rats [J]. J Nucl Med, 1984, 25(11): 1212-1221.
[8]LAVANYA S, HANNAH M L, JEANNE M L, et al. 18F-Fluoroestradiol [J]. Semin Nucl Med, 2007, 37(6): 470-476.
[9]DEHDASHTI F, MORTIMER J E, SIEGEL B A, et al. Positron tomographic assessment of estrogen receptors in breast cancer:comparison with FDG- PET and in vitro receptor assays [J]. J Nucl Med, 1995, 36(10): 1766-1774.
[10]SPEIRS V. Oestrogen recept or in breast cancer: good, bad or still too early to tell [J]. J Pathol, 2002, 197(2): 143-147.
[11]ZHAO C, DAHLMAN W K, GUSTAFSSON J A. Estrogen signaling via estrogen receptor beta [J]. J Biol Chem, 2010, 285(51): 39575-39579.
[12]TSUJIKAWA T, YOSHIDA Y, KIYONO Y, et al. Functional oestrogen receptor α imaging in endometrial carcinoma using 16α-[18F]fluoro-17β-oestradiol PET [J]. J Nucl Med, 2011, 38(1): 37-45.
[13]ROGER P, SAHLA M E , MAKELA S, et al. Decreased expression of estrogen receptor beta protein in proliferative preinvasive mammary tumors [J]. Cancer Res, 2001, 61(6): 2537-2541.
[14]PARUTHIYIL S, PARMAR H, KEREKATTE V, et al. Estrogen receptor beta inhibits h uman breast cancer cell proliferation and tumor formation by causing a G2 cell cycle arrest [J]. Cancer Res, 2004, 64(1): 423-428.
[15]STROM A, HARTMAN J, FOSTER J S, et al. Estrogen receptor beta inhibits 17 beta-estradiol-stimulated proliferation of the breast cancer cell line T47D [J]. Proc Nat l Acad Sci U SA, 2004, 101(6): 1566-1571.
[16]牛秀珑, 王奕飞, 孙奕, 等. 雌激素受体亚型对人乳腺癌细胞株MCF-7生物学特性的影响[J]. 中国普外基础与临床杂志,2011,18(7): 711-716.
[17]HOU Y F, YUAN S T, LI H C, et al. ER beta exerts multiple stimulative effects on human breast carcinoma cells [J]. Oncogene, 2004, 23(34): 5799-5806.
[18]侯意枫, 袁胜涛, 李鹤成, 等. 雌激素受体β对人乳腺癌细胞株生物学特性的影响[J]. 中华肿瘤杂志, 2005,27(7): 389-392.
[19]MORTIMER J E, DEHDASHTI F, SIEGEL B A, et al. Positron emission tomography with 2-[18F]Fluoro-2-deoxy-D-glucose and 16alpha-[18F]fluoro-17betaestradiol in breast cancer: correlation with estrogen receptor status and response to systemic therapy[J]. Clin Cancer Res, 1996, 2(6): 933-939.
[20]AMIR E, CLEMONS M, PURDIE C A, et al. Tissue confirmation of disease recurrence in breast cancer patients: pooled analysis of multicentre, ultidisciplinary prospective studies[J]. Cancer Treat Rev, 2012, 38(6): 708-714.
[21]SIMMON S C, MILLER N, GEDDIE W, et al. Does confirmatory tumor biopsy alter the management of breast cancer patients with distant metastases? [J]. Ann Oncol, 2009, 20(9): 1499-1504.
The correlation of18F-fluoroestradiol uptake in patients with breast cancer to in vitro immunohistochemical assay of ER status
SUN Yi-fei1, YANG Zhong-yi1, ZHANG Yong-ping1, WANG Ming-wei1, YAO Zhi-feng1, XUE Jing1, BAO Xiao1, YANG Wen-tao2, SHEN Zhen-zhou3, SHAO Zhimin3, ZHANG Ying-jian1(1.Department of Nuclear Medicine, Fudan University Shanghai Cancer Center; Department of Oncology, Shanghai Medical College, Fudan University, Shanghai 200032, China; 2. Department of Pathology, Fudan University Shanghai Cancer Center; Department of Oncology, Shanghai Medical College, Fudan University, Shanghai 200032, China; 3. Department of Breast Surgery, Fudan University Shanghai Cancer Center; Department of Oncology, Shanghai Medical College, Fudan University, Shanghai 200032, China)
ZHANG Ying-jian E-mail: yjzhang111@aliyun.com
Background and purpose:16α-[18F] fl uoroestradiol (18F-FES) is an in vivo speci fi c imaging agent for estrogen receptor (ER). We investigated the concordance between tumor ER status as determined by FES-PET and in vitro immunohistochemical assays.Methods:18F-FES was prepared by ourselves. Twenty-six patients were enrolled (17 primary and 9 metastatic/recurrent). Patients underwent both18F-FES and18F-FDG PET/CT.Results:We found good overall agreement (96.15%) between in vitro ER assays and FES-PET. The ER status diagnosis sensitivity of18F-FES was 93.33% and the speci fi city was 100% when using cut-off value of SUVmax≥1.5. There was a positive correlation between in vitro ER, PR assays and the SUVmaxof18F-FES while in vitro HER-2/neu assays correlatived negatively with18F-FES SUVmax.Conclusion:These results suggested18F-FES may be useful for studying the ER expression of all malignant lesions in patients with breast cancer and guiding individual therapy.
Estrogen receptor; Immunohistochemistry;18F-FES;18F-FDG; ER subtype
10.3969/j.issn.1007-3969.2014.02.008
R737.9
A
1007-3639(2014)02-0128-07
2013-10-17
2014-01-23)
章英剑 E-mail:yjzhang111@aliyun.com
