金属三片罐生产过程中双酚类物质迁移规律的研究
2014-02-27范雨豪刘志刚柏建国姚卫蓉
范雨豪,刘志刚,柏建国,赵 彦,姚卫蓉,*
(1.江南大学食品学院,江苏无锡214122;2.江南大学机械工程学院,江苏无锡214122;3.奥瑞金包装股份有限公司,北京101407)
金属三片罐生产过程中双酚类物质迁移规律的研究
范雨豪1,刘志刚2,柏建国3,赵 彦3,姚卫蓉1,*
(1.江南大学食品学院,江苏无锡214122;2.江南大学机械工程学院,江苏无锡214122;3.奥瑞金包装股份有限公司,北京101407)
按照金属三片罐的实际生产工艺,跟踪研究了制罐内涂、外涂、彩印、上光、罐内补涂以及全喷工序过程的中间品,各自相应内壁涂膜中9种双酚物向3%(m/v)乙酸和10%(v/v)乙醇模拟液中的迁移情况。结果表明:双酚F二环氧甘油醚及其衍生物在两种模拟液中都未检出;而双酚A-(2,3-二羟丙基)甘油醚和双酚A-双(2,3-二羟丙基)甘油醚在两种模拟液中均有迁出;10%乙醇中还检测到双酚A二环氧甘油醚及其他衍生物。在10%乙醇体系中,迁出的双酚物在全喷后增加显著。3%乙酸体系中,迁出的双酚物在补涂和全喷后增加明显。结果表明补涂与全喷这两个工艺对三片罐的食品安全性造成潜在影响,可在加工过程中作为关键控制点进行控制。
金属三片罐,生产过程,双酚类物质,食品模拟液,迁移
用金属材料制作的罐头包装材料,通常需要在其内表面涂覆涂层以防止罐头内容物对罐壁腐蚀,目前常见的涂料主要有环氧树脂、环氧酚醛树脂、环氧聚酯等[1]。涂层在烘烤成膜过程中,如果化学反应不完全,原料不充分交联,可能就有微量的树脂单体残留在涂层中,例如双酚A(BPA)、双酚A二环氧甘油醚(BADGE)、双酚F二环氧甘油醚(BFDGE)及其环氧衍生物等[2]。在罐头食品的杀菌、存储过程中,这些化合物就有可能渗入至食品或饮料中,进而进入体内[3]。研究发现,双酚类物质不仅能造成人类和动物的内分泌系统、神经系统、免疫系统异常,还会严重干扰人类和动物的生殖遗传功能[4-6]。
欧盟对食品包装材料中的BADGE,BFDGE及其衍生物含量有严格的规定,在《关于在与食品相接触的材料及物品内使用某些环氧衍生物的法规》(EC/ 1895/2005H号指令)[7]中规定了BADGE、双酚A-(2,3-二羟丙基)甘油醚(BADGE·H2O)及双酚A-双(2,3-二羟丙基)甘油醚(BADGE·2H2O)在食品或食品模拟物中迁移总量不得超过9mg/kg,双酚A-(3-氯-2-羟丙基)甘油醚(BADGE·HCl)、双酚A-双(3-氯-2-羟丙基)甘油醚(BADGE·2HCl)及双酚A-(3-氯-2-羟丙基)(2,3-二羟丙基)甘油醚(BADGE·H2O·HCl)在食品或食品模拟物中迁移总量不得超过1mg/kg,BFDGE则不得检出。我国对于BADGE、BFDGE及其衍生物没有相应的卫生标准和检测方法,相比欧盟等国家的严格要求,存在一定的食品安全隐患。
由于内壁涂料成膜后有害物质的含量与该涂料的喷涂工艺有密切的相关性[8]。因而,有必要针对三片罐的实际生产工艺,对罐子内壁涂膜中双酚类物质的迁移规律展开研究。目前,对BADGE、BFDGE及其环氧衍生物的检测方法有高效液相色谱法[9-10]、高效液相色谱-串联质谱法(HPLC-MS/MS)[11-14]和气相色谱-串联质谱法(GC-MS)等[15]。本文采用具有较高的抗干扰能力和较高的灵敏度的HPLC-MS/MS方法,对9种双酚类化学物进行准确定性和定量,并对其在实际生产中的迁移转化规律进行了详细研究。
1 材料与方法
1.1 材料与设备
BADGE、BADGE·H2O、BADGE·2H2O、BADGE· HCl、BADGE·2HCl、BADGE·H2O·HCl、BFDGE、双酚F-双(2,3-二羟丙基)甘油醚(BFDGE·2H2O)、双酚F-双(3-氯-2-羟丙基)甘油醚(BFDGE·2HCl) 均为色谱纯,美国ChemService公司;甲醇、甲酸 色谱纯,美国Fisher公司;乙醇、乙酸、乙酸铵 分析纯,天津市大茂化学试剂厂;双酚类物质混合标准储备液 分别准确称取9种双酚类物质的标准品0.01g(精确至0.1mg)用甲醇超声溶解,定容至100m L容量瓶中,制成浓度为100mg/L标准储备液,4℃密封保存,从9种标准储备液中分别移取0.1m L于10m L容量瓶中并用甲醇定容,配成浓度为1mg/L的混合标准储备溶液。
液相色谱串联质谱仪 API4000+高效液相色谱-三重四极杆串联质谱,美国AB SCIEX公司;色谱柱 Eclipse Plus C18(1.8μm,2.1mm×100mm),Agilent公司;恒温灭菌锅YXQ-LS-50A 上海博迅实业有限公司医疗设备厂;单边测试仪 实验室定制。
1.2 实验方法
1.2.1 取样 涉及涂料的三片罐主要生产工艺:内涂1→内涂2→外涂→彩印→上光→补涂→全喷。其中前5道工序是彩印板的生产流程,补涂和全喷是罐子的生产工序。每道工序结束后对应进行采样。金属板每工序取一大张,将其裁剪成5小张,罐子补涂和全喷后各取5个。
1.2.2 浸泡条件 按照欧盟EC和FDA的规定,根据拟装食品的性质,分别选取3%(w/v)乙酸水溶液和10%(v/v)乙醇水溶液模拟酸性食品。
金属板剪成半径约为7.5cm的圆,参考GB/T 5009.156-2003食品用包装材料及其制品的浸泡实验方法通则[16]的要求。用餐具洗涤剂在涂层表面刷洗5次,用自来水冲洗0.5m in,再用蒸馏水清洗3次,置于烘箱中晾干备用。烘干后将金属板单面内壁涂膜朝上放入单边测试仪中,注入模拟液至满,密封后旋紧盖帽将其放入灭菌锅。
罐子按照GB/T 5009.156-2003食品用包装材料及其制品的浸泡实验方法通则的要求[16],即将其置于水平桌上,用量筒注入模拟液至离上边缘(溢出面)5mm处,封盖将其放于灭菌锅。
迁移条件按照食品实际生产过程中杀菌工艺:温度为95℃,时间30m in。
为了便于对金属板和罐子内壁涂膜中双酚物迁出量进行比较,选用内涂层单位面积双酚物迁出量(μg/dm2)代替μg/L。计算公式如下:
X=c×V×10(/S×K)
式中:X:双酚物迁出量,μg/dm2;c:标准曲线求得的目标物的浓度,μg/L;V:模拟物浸泡液体积,m L,其中金属板为100m L,罐子245m L;S:样品与模拟物的接触面积,cm2,其中金属板为100cm2,罐子188.5cm2;K:折算因子,K值为1;10:单位校正因子。
1.2.3 样品前处理 由于浸泡液基质简单,因此浸泡完成后,内涂层浸泡液用0.45μm的有机相滤膜过滤至进样瓶。若样品浓度高出线性范围,则将浸泡液稀释适当倍数后待测。
1.2.4 HPLC-MS/MS检测条件
1.2.4.1 色谱条件 采用Eclipse PlusC18色谱柱(1.8μm,2.1mm×100mm);柱温:50℃;流速:0.25m L/m in;进样量:5μL;流动相:A:10mmol/L乙酸铵水溶液(用甲酸调节pH=4.75),B:100%甲醇,梯度洗脱。具体参数如表1所示。
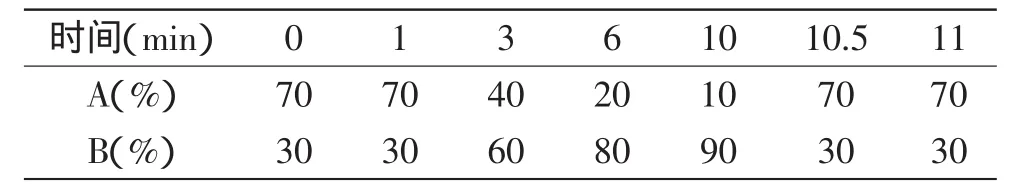
表1 9种双酚物的梯度洗脱参数Table 1 Elution parameters for 9 kinds of bisphenol compounds
1.2.4.2 质谱条件 电喷雾ESI,正离子模式;扫描方式:多反应监测(MRM);离子喷雾电压(Ion Spray Voltage):5500V;离子源温度T:550℃;雾化器Gas 1∶40。MRM扫描参数如表2所示。
1.2.5 标准曲线与最低检出限 分别用3%乙酸和10%乙醇溶液稀释双酚物混合储备溶液,配制最终浓度分别为1.0、2.0、5.0、10.0、20.0、50.0、100、200、500μg/L的系列工作溶液,并直接用HPLC-MS/MS测定。以各双酚物浓度为横坐标(X),峰面积为纵坐标(Y),绘制标准曲线。通过不断降低标准溶液浓度,取信噪比为3时的浓度为最低检出限。
1.2.6 回收率和精密度的测定 选取自制空白金属板和罐子,在3%乙酸溶液和10%溶液浸泡液中分别添加9种双酚物标准溶液,使得模拟液中双酚物浓度分别为2、20、200μg/L,按照样品前处理步骤进行处理,每个浓度水平做3个平行实验,再按照HPLCMS/MS检测条件进行检测,考察方法的回收率和精密度。
2 结果与讨论
2.1 食品模拟物基质的影响
将两种食品模拟物的标准工作液进行测定,结果发现同浓度的样品在不同的食品模拟物中表现出不同的峰面积,如图1所示,BADGE和BFDGE在3%乙酸中的峰面积要小于10%乙醇中的峰面积,而其含两个水衍生物的峰面积大于10%乙醇的峰面积。这可能由于BADGE和BFDGE在酸溶液中易发生水解,转化为比较稳定的BADGE·2H2O和BFDGE·2H2O缘故[17]。因此为了保证分析方法的准确性,实验采取分别配制不同基质的标准工作溶液的方法,针对相应基质的食品模拟物进行检测。
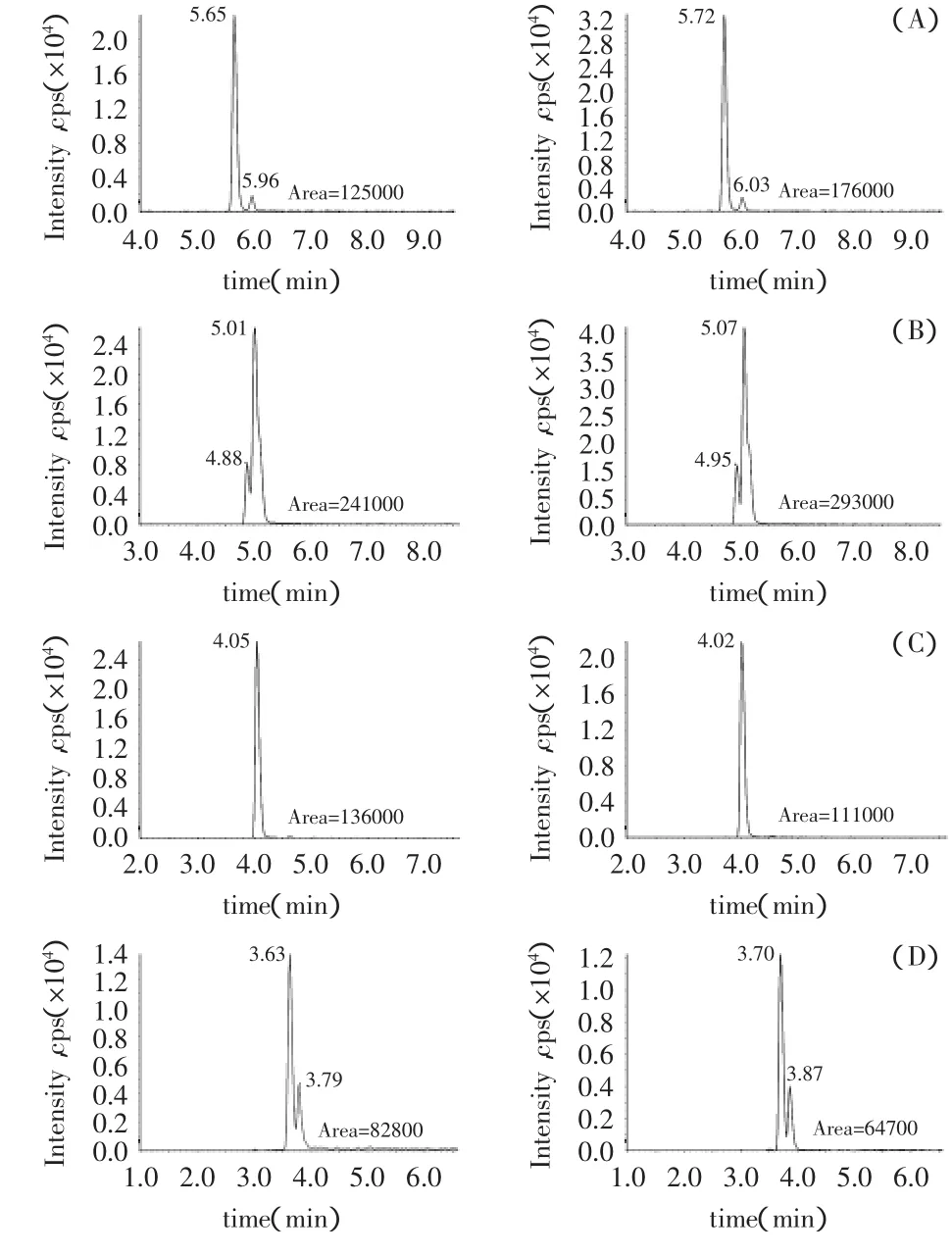
图1 3%乙酸和10%乙醇模拟物配制的不同双酚物标准工作液(100μg/L)色谱图Fig.1 The chromatograms of differentbisphenol compound standard solutions(100μg/L)prepared by 3%acetic acid and 10%ethanol
2.2 线性范围与检出限
根据上述条件,采用HPLC-MS/MS检测,得出9种双酚物标准物质的线性回归方程。在1~500.0μg/L范围内各标准曲线线性关系良好,相关系数均大于0.998,最低检出限为0.5μg/L。相关数据见如表3所示。
2.3 回收率与精密度
分别用2种食品模拟液配制高、中、低三个浓度水平的混合标准溶液进行回收实验,浓度水平分别为2、20、200μg/L,回收率与精密度测定结果如表4所示。9种双酚物添加回收率为83.2%~102.6%,相对偏差(RSD)均小于13%,说明本研究建立的方法可靠,满足检测要求。
2.4 3%乙酸模拟液中不同工序双酚物的迁移变化情况
样品经历(95℃/30m in)的浸泡条件后发现,在3%乙酸体系中检测到的双酚物有BADGE·H2O和BADGE·2H2O。将相邻工序之间迁出的双酚物含量进行比较。由图2分析可得,在3%乙酸模拟体系中,BADGE·H2O、BADGE·2H2O两种物质均在罐子补涂和全喷后迁出量增加明显。这是由于补涂粉末和全喷涂料中本身含有一定量的双酚类聚合物,涂料涂附烘烤后易残留未聚合的单体导致双酚类物质的迁出。BADGE·H2O在补涂和全喷后增加量分别为6.96μg·dm-2和2.99μg·dm-2;全喷后的迁移量为11.18μg·dm-2。BADGE·2H2O增加量分别为7.01μg·dm-2和50.43μg· dm-2;全喷后的迁移量达58.67μg·dm-2。因而在整个生产工序中,罐子补涂和全喷这两个工艺点对内壁涂膜中双酚物在3%乙酸模拟液中迁出量影响较大,可作为关键点进行控制。
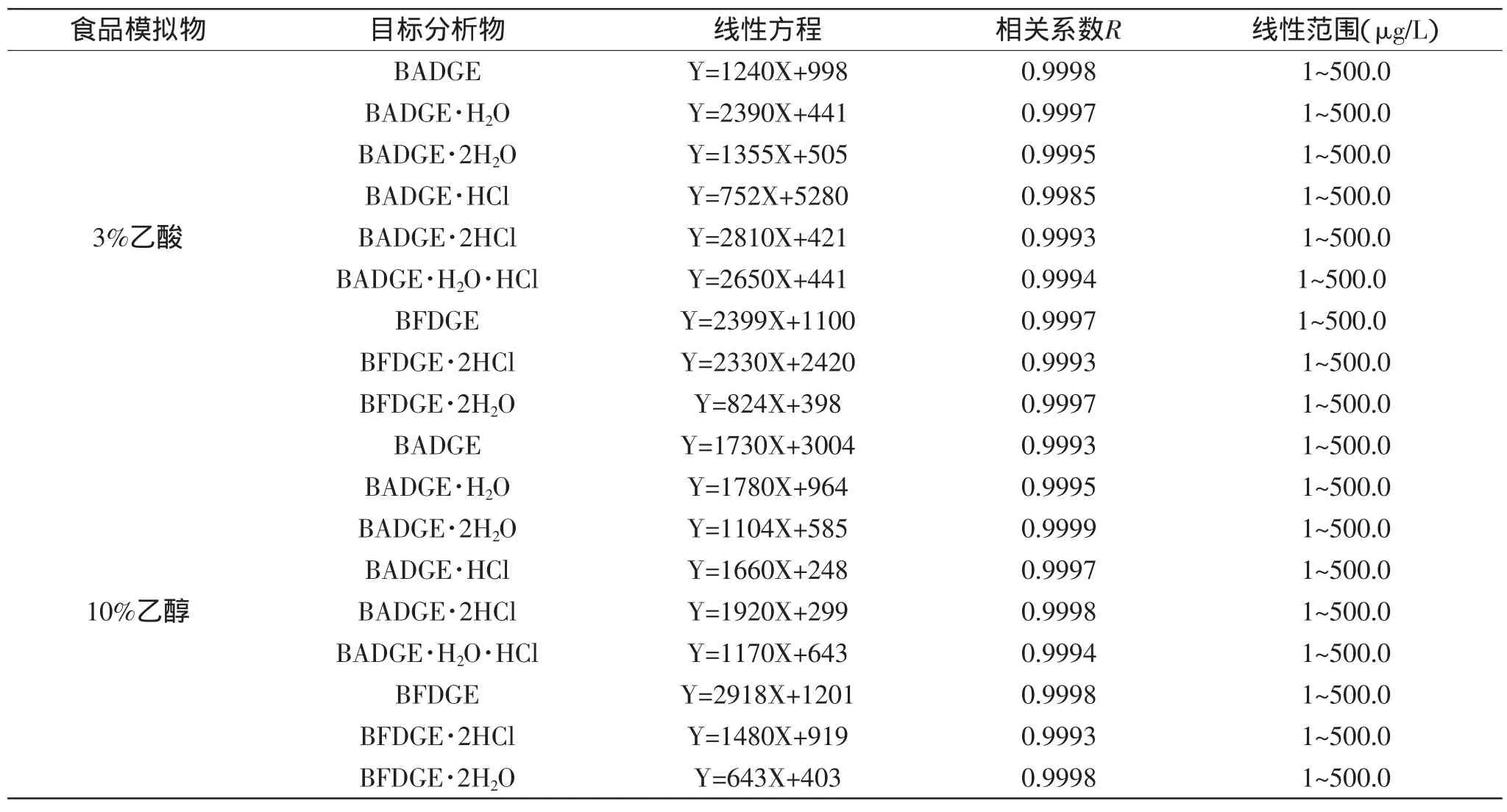
表3 不同模拟物下9种双酚物的线性关系Table 3 Liner ranges,correlation coefficientsand linearequationsof9 kindsofbisphenolcompounds in differentsimulated solutions
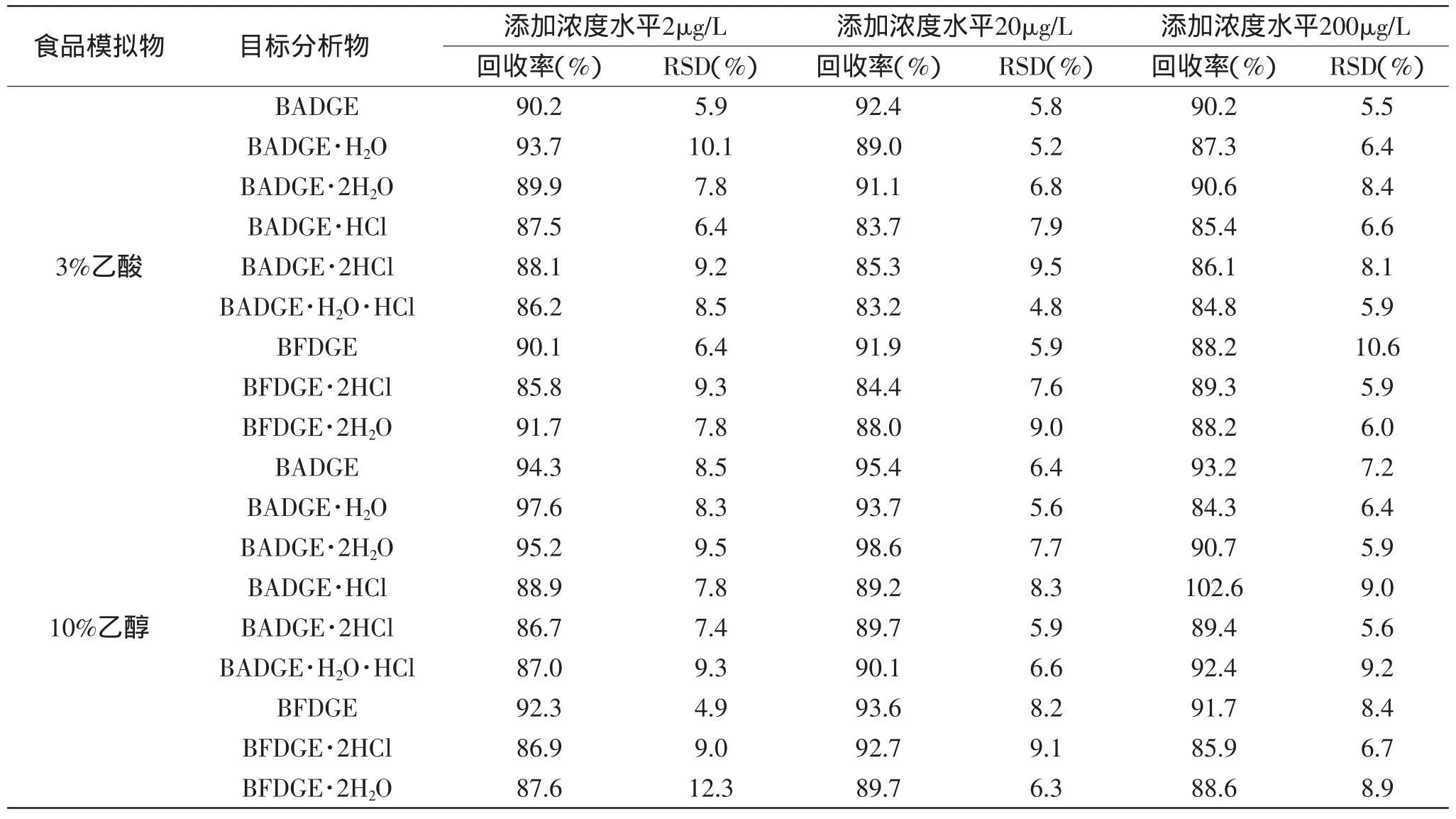
表4 9种双酚物的回收率和精密度测定结果(n=3)Table 4 The average recovery and relative standard deviation of samples(n=3)
2.5 10%乙醇模拟液中不同工序双酚物的迁移变化情况
在10%乙醇模拟体系中,BADGE及其衍生物均有检出。这可能由于该模拟物中的乙醇降低了溶液的极性,其极性与多种双酚物的极性相似,根据“相似相溶”的原理从而容易引起多种双酚物的迁移,并且迁出的双酚类物质在乙醇中的半衰期要长于其他水性模拟物[18]。由图3可得,其中每道工序均有检出的物质有BADGE·H2O、BADGE·2H2O以及BADGE·H2O·HCl,而BADGE、BADGE·HCl和BADGE·2HCl只在罐子全喷后有检出。通过对相邻工序之间迁出的双酚物含量进行比较,BADGE·H2O、BADGE·2H2O以及BADGE·H2O·HCl这三种物质均在全喷后迁出量增加显著,迁出量分别达48.17、5.45、5.12μg·dm-2;增加量分别为39.23、4.62、4.39μg·dm-2。而BADGE、BADGE·HCl和BADGE·2HCl全喷后迁出量分别为27.27、52.53、0.78μg·dm-2。因而在整个生产工序中,罐子全喷对内壁涂膜中双酚物在10%乙醇模拟液中迁出量影响最大,可作为关键控制点进行控制。
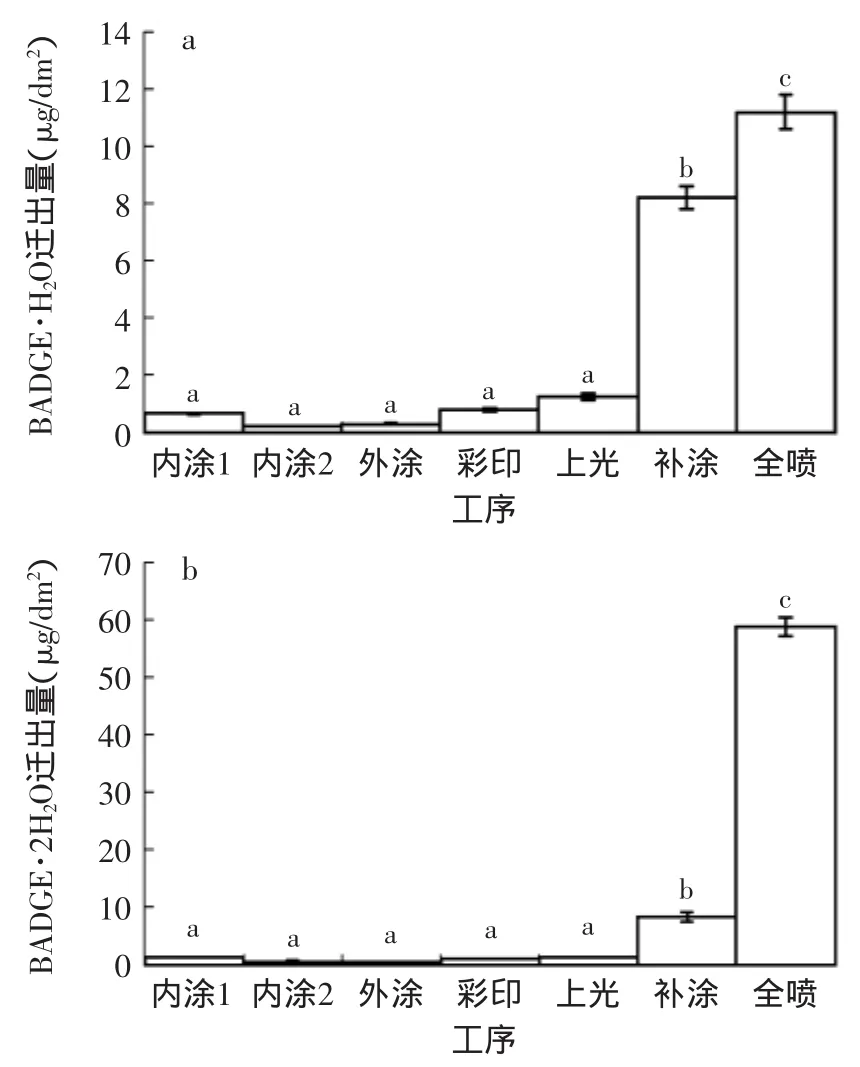
图2 3%乙酸模拟液中BADGE·H2O、BADGE·2H2O随工艺的迁出情况(±s,n=5)Fig.2 Migration of BADGE·H2O and BADGE·2H2O into 3% acetic acid solution with the production process(±s,n=5)
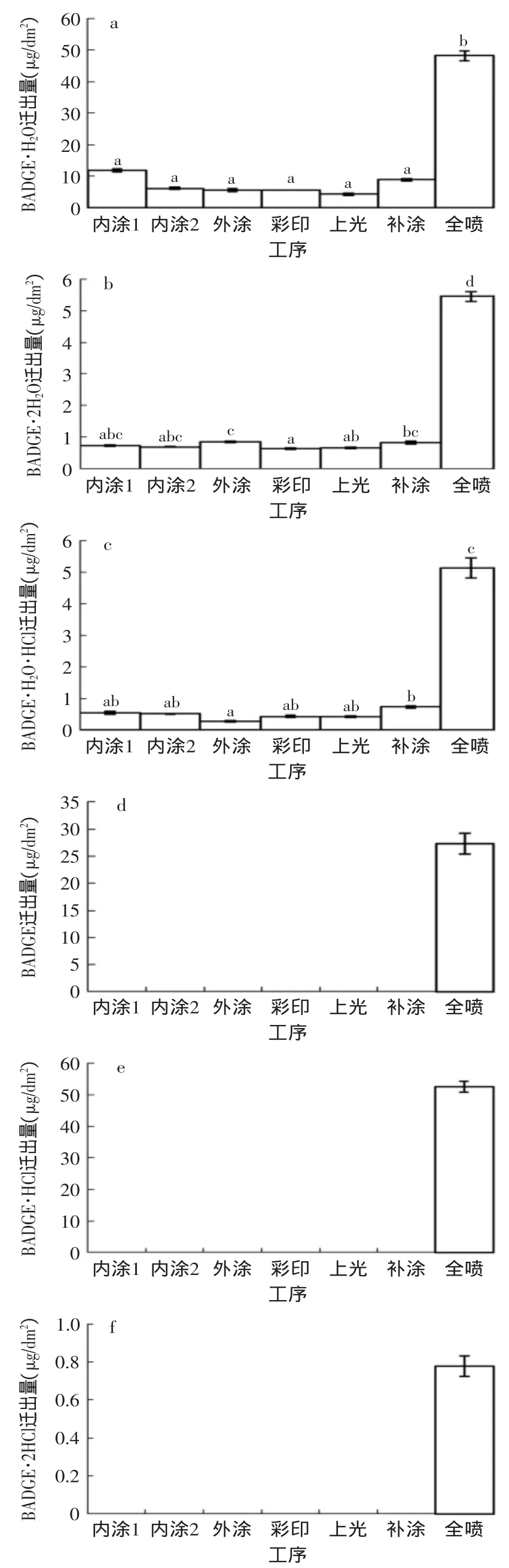
图3 10%乙醇模拟液中BADGE·H2O、BADG·2H2O、BADGE· H2O·HCl、BADGE、BADGE·HCl以及BADGE·2HCl随工艺的迁出情况(±s,n=5)Fig.3 Migration of BADGE·H2O,BADGE·2H2O,BADGE·H2O· HCl,BADGE,BADGE·HCl and BADGE·2HCl into 10% ethanol solution with the production process(±s,n=5)
3 结论
本实验研究了酸性饮料三片罐制罐过程中间品,各自相应内壁涂膜中9种双酚物质向3%乙酸(m/v)和10%乙醇(v/v)模拟液中的迁移情况,采用实际饮料罐的灭菌工艺即95℃和30m in为浸泡条件,借助HPLC-MS/MS对浸泡液中双酚物的含量进行检测。结果表明,BADGE·H2O、BADGE·2H2O在两种模拟液中均有迁出;而BFDGE及其衍生物在两种模拟液中都未检出;10%乙醇中还检测到BADGE、BADGE·HCl、BADGE·2HCl以及BADGE·H2O·HCl。在10%乙醇体系中,迁出的双酚物在全喷后增加显著。3%乙酸体系中,迁出的双酚物在补涂和全喷后增加明显。因而补涂与全喷这两个工艺对三片罐的食品安全性造成潜在影响,可在加工过程中作为关键控制点进行控制。
[1]李碧芳,曾泳艇,郑彦婕,等.双酚A环氧衍生物在罐头食品中的迁移规律与污染情况研究[J].食品工业科技,2011,32(1):246-249.
[2]Fromme H,Kuchler T,Otto T,et al.Occurrence of phthalates and bisphenol A and F in the environment[J].Water Research,2002,36(6):1429-1438.
[3]Jose LV,Albert Z,Antonio G C,et al.Determination of trace amounts of bisphenol F,bisphenol A and their digiycidyl ethers in wastewater by gas chromatography-mass spectrometry[J]. Analytica Chimica Acta,2001,431:31-40.
[4]李思瑜,刘兴荣,黄敏,等.环境内分泌干扰物双酚A脱除方法研究进展[J].现代预防医学,2007,34(11):2094-2095.
[5]Bolt H,Stewart J.Highlight report:the bisphenol A controversary[J].Archives of Toxicology,2011,85(12):1491-1492.
[6]Graciela R,Lago V,Jorge L,etal.Cytotoxic effects of BADGE(bisphenolA diglycidylether)and BFDGE(bisphenol Fdiglycidyl ether)on Caco-2 cells in vitro[J].Arch Toxicol,2006,80(11):748-755.
[7]Official Journal of the European Union[Z].Commission Regulation(EC)No.1895/2005.
[8]李捷.食品用金属包装容器内壁涂料质量安全专项调查分析报告[J].福建质量信息,2008(12):26-29.
[9]韩灏,邵兵,马亚鲁,等.高效液相色谱法测定饮料类食品中的类雌激素[J].色谱,2005,23(2):176-179.
[10]缪佳铮,薛鸣,张虹.高效液相色谱分析食品罐内涂料中双酚A和双酚F环氧衍生物残留[J].分析化学,2009,37(6):911-914.
[11]Pardo O,Yusa V,Leon N,et al.Determination of bisphenol a diglycidyl ether residues in canned foods by pressurized liquid extraction and liquid chromatography-tandem mass spectrometry [J].Journal of Chromatography A,2006,1107(1-2):70-78.
[12]张朝晖,罗生亮,吴少林,等.鱼肉类罐头中双酚-二环氧甘油醚的固相萃取/HPLC-MS/MS法检测[J].分析测试学报,2009,28(6):714.
[13]吴新华,丁利,李忠海,等.多壁碳纳米管固相萃取-高效液相色谱-串联质谱法测定食品接触材料中双酚-二环氧甘油醚的迁移量[J].色谱,2010,28(11):1094-1098.
[14]Cabeado A G,Aldea S,Porro C,et al.Migration of BADGE(bisphenol a diglycidyl-ether) and BFDGE(bisphenol F diglycidyl-ether)in canned seafood[J].Food and Chemical Toxicology,2008,46(4):1674-1680.
[15]焦艳娜,丁利,李晖,等.加速溶剂萃取-GC-MS/MS法测定食品接触材料中双酚A、双酚F及其衍生物的残留量[J].包装工程,2011,32(15):53-55.
[16]GB/T 5009.156-2003.食品用包装材料及其制品的浸泡实验方法通则[S].中华人民共和国卫生部,2003-08-11.
[17]Poustkova I,Dobias J,Steiner I,et al.Stability of bisphenol A diglycidyletherand bisphenol Fdiglycidylether in water-based food stimulants[J].European Food Research and Technology,2004,219(5):534-539.
[18]Losada PP,Lozano JS,Abuín SP,et al.Kinetics of the hydrolysisofbisphenolA diglycidylether(BADGE)inwater-based food simulants[J].Fresenius’Journal of Analytical Chemistry,1993,345(7):527-532.
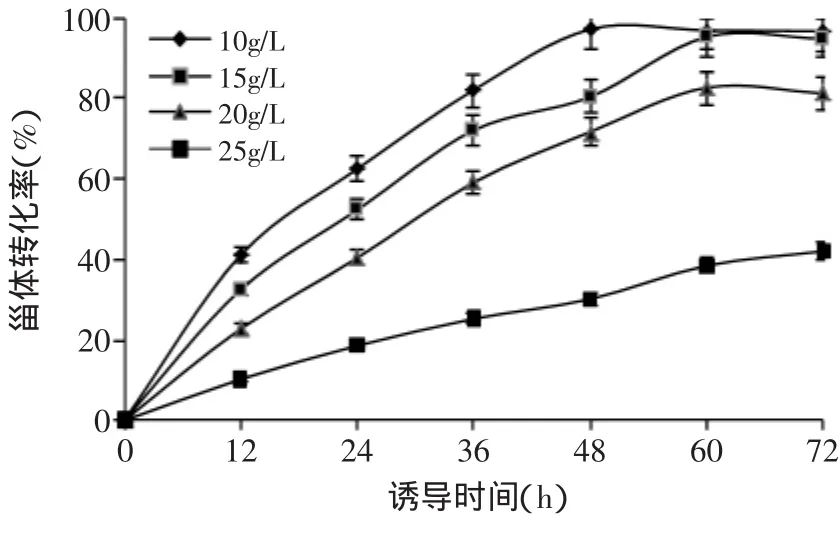
图9 投加不同浓度4-AD后其转化率随时间变化情况Fig.9 Influence of the incubation period and the concentration of 4-AD added
采用优化好的培养基及培养条件对诺卡氏菌转化4-AD的能力进行验证发现:投加4-AD浓度为10g/L及15g/L时,转化率分别为97.2%和95.3%,转化基本完全;4-AD浓度为20g/L时,转化率仍可达82.7%,表现出很好的转化效率,有一定的工业化前景。
参考文献
[1]张丽青.微生物转化在甾体药物合成中的应用[J].中国医药工业杂志,1985,18(1):27-41.
[2]叶丽,史济平.甾体微生物转化在制药工业中的应用[J].工业微生物,2001,31(4):40-47.
[3]杨英,姜绍通.微生物降解甾醇侧链转化雄甾-4-烯-3,17-二酮的研究进展[J].微生物学通报,2006,33(6):142-145.
[4]郭一平,郑璞.甾体物C11α-羟化反应的研究进展[J].浙江工业大学学报,2004,32(4):437-441.
[5]林彦良.甾体化合物微生物转化的研究[D].济南:山东大学,2009:19-22.
[6]魏琦,熊志刚,冀志霞,等.微生物转化雄甾-4-烯-3,17-双酮的菌种筛选和转化条件的初步研究[J].微生物学通报,2007,34(6):1134-1137.
[7]黄伟,陆震鸣,耿燕,等.桦褐孔菌菌丝体及甾类化合物的发酵条件优化[J].菌物学报,2012,31(6):909-916.
[8]王嘉,关怡新,王海清,等.拟结晶投料环氧黄体酮犁头霉羟化过程研究[J].生物工程学报,2006,22(4):662-666.
[9]Miaomiao Chen,Fengqing Wang,Liangcai Lin,et al. Characterization and application of fusidane antibiotic biosynethsis enzyme3-ketosteroid-Δ1-dehydrogenase in steroid transformation [J].ApplMicrobiol Biotechnol,2012,96(1):133-142.
[10]Wenquan Zhang,Li Cui,Mengyao Wu,et al.Transformation of prednisolone to a 20β-hydroxy prednisolone compound by Streptomyces roseochromogenes TS79[J].Appl Microbiol Biotechnol,2011,92(4):727-735.
Research of the m igration of bisphenol com pounds in the production process of three-piece metal cans
FAN Yu-hao1,LIU Zhi-gang2,BAI Jian-guo3,ZHAO Yan3,YAOWei-rong1,*
(1.School of Food Science and Technology,Jiangnan University,Wuxi214122,China;2.School ofMechanical Engineering,Jiangnan University,Wuxi214122,China;3.O.R.G.Packaging Co.,Ltd.,Beijing 101407,China)
The m igration of nine kinds of bisphenol com pounds from respective inner coating of intermed iate p roduct to 3%(m/v)acetic acid and 10%(v/v)ethanol after internal surface coating,external surface coating,color p rinting,varnishing,supp lementary coating and full sp raying of cans according to the p rac tical p roduc tion p rocess of three-piece metal cans was stud ied.It was found that bisphenol F dig lycidyl ether and its derivatives were not detected in both two simulated solutions,whereas bisphenol A(2,3-dihyd roxyp ropyl)g lycidyl ether and bisphenol A bis(2,3-dihyd roxyp ropyl)g lycidyl ether were detec ted in both simulated solutions.Moreover,bisphenol A(3-chloro-2-hyd roxyp ropyl)g lycidyl ether and other derivatives were also detec ted in 10%ethanol system,and the contents of all these detected bisphenol com pounds increased significantly after full sp raying of cans.Meanwhile,the contents of these compounds also remarkab ly inc reased after supp lementary coating and full sp raying of cans in 3%acetic acid system.The results suggested the two p rocessing points inc lud ing supp lementary coating and full sp raying of cans had potential im pacts on the safety of inner coatings,which were deemed as key controlpoints.
three-p iece metal cans;p roduc tion p rocess;bisphenol compounds;food simulated solutions;m ig ration
TS292
A
1002-0306(2014)18-0332-06
10.13386/j.issn1002-0306.2014.18.066
2013-12-23 *通讯联系人
范雨豪(1990-),男,在读硕士研究生,研究方向:食品安全与质量控制。
江苏科技支撑计划-社会发展(BE2012631)。
