酶解法制备猪肩胛骨降血压肽
2014-02-27陈昌琳张殊莹黄山珊
陈昌琳,李 诚,付 刚,张殊莹,黄山珊,肖 岚
(四川农业大学食品学院,四川雅安625014)
酶解法制备猪肩胛骨降血压肽
陈昌琳,李 诚*,付 刚,张殊莹,黄山珊,肖 岚
(四川农业大学食品学院,四川雅安625014)
以猪肩胛骨为原料,用蛋白酶将其水解用以制备降血压肽。以酶解液的血管紧张素转化酶(ACE)抑制率为主要指标,筛选出风味蛋白酶为最适的蛋白酶进行酶解优化实验。考察酶解时间、酶解温度、pH、酶底比、底物浓度5个因素对酶解液的水解度和ACE抑制率的影响,并在此基础上通过响应面优化实验,确定最佳酶解条件为:酶底比6900U/g、酶解温度53℃、酶解时间4.5h,此条件下进行验证实验制备出ACE抑制率为65.31%的猪肩胛骨降血压肽,ACE抑制率理论值为66.93%。
猪肩胛骨,酶解,降血压肽,响应面法
我国是畜禽骨资源大国,但由于技术水平的限制,畜禽骨的利用还处于落后的阶段,存在被大量浪费或仅被加工成附加值低的产品问题。因此,运用酶解回收利用骨蛋白极具研究价值[1]。目前已有利用骨蛋白制备呈味肽及功能性肽的报道[2]。
高血压是一种常见的慢性心血管疾病,常伴有器官及结构的不良变化;易引起冠状动脉心脏病、外周动脉疾病和中风并且能够引发各种并发症。因此,高血压具有一定的危险性。降血压药物是通过抑制血管紧张素转化酶的活性,而减少有升血压作用的血管紧张素转化酶II的生成,同时降低对有降血压作用的缓激肽被破坏而起到降血压作用,如卡托普利、依那普利都是ACE抑制剂。然而,这些合成药物具有不利的副作用,如咳嗽、味觉障碍、头晕、头痛、皮疹、血管神经性水肿等[3-4]。而食源性的降血压肽具有专一、持久、安全性高、降血压效果温和且对正常血压无影响、无副作用的特点[5],因而成为研究热点。目前,已经有研究者利用牛骨、鸭骨、羊骨、猪骨、鸡骨等畜禽骨为原料制备了降血压肽[6-10],还有研究者以乳酸菌发酵猪骨骼肌制备了降血压肽[11]。其中陈硕[12]、李娜等[13]的研究证明以猪股骨头胶原蛋白为原料制备的降血压肽在原发性高血压大鼠体内具有降血压作用。而利用猪肩胛骨制备降血压肽的研究还未见报道。猪肩胛骨的利用率更低、来源更广泛、价格更低廉,且附着肉少,前处理更容易,是制备降血压肽的理想原料。
本实验直接采用骨粉为酶解底物,避免了复杂的提取胶原蛋白的过程。通过比较6种酶对酶解液ACE抑制率及水解度的影响,筛选出最适蛋白酶,再通过单因素和响应面实验优化出制备猪肩胛骨降血压肽的最佳酶解条件,为猪肩胛骨降血压肽的理论研究和进一步的产品开发提供理论依据。
1 材料与方法
1.1 材料与仪器
新鲜猪肩胛骨 购自雅安农贸市场,剔净非骨骼成分,清洗,高压蒸煮4h,烘干,粉碎制成骨粉,制得的骨粉蛋白含量为19.96%,冷藏备用;酸性蛋白酶(酶活力为32.69U/mg)、中性蛋白酶(酶活力为34.00U/mg)、碱性蛋白酶(酶活力为114.17U/mg)、胃蛋白酶(酶活力为3050.25U/g)、胰蛋白酶(酶活力为262.13U/mg)、风味蛋白酶(酶活力为23.43U/mg) 上海Kayon公司;血管紧张素转化酶(ACE)、马尿酰组氨酰亮氨酸(Hip-His-Leu,HHL) Sigma公司;其他化学试剂 为国产分析纯。
酸度计 方舟科技;UV-3200紫外分光光度计MAPADA 冷冻干燥机、高速冷冻离心机、移液枪Thermo;QT-2漩涡混合器 上海琪特分析仪器有限公司;超纯水装置 优普公司。
1.2 实验方法
1.2.1 猪肩胛骨蛋白的酶解工艺 称取一定量的猪肩胛骨粉,按一定比例加入蒸馏水,混匀,调pH后加入一定量的酶,在指定温度下酶解指定时间。酶解完成后,沸水浴灭酶10m in,4℃10000r/m in离心10m in,得到上清液,测定其ACE抑制率及水解度。
1.2.2 蛋白酶的筛选 以酸性蛋白酶、中性蛋白酶、碱性蛋白酶、胰蛋白酶、胃蛋白酶、风味蛋白酶为筛选对象,选择底物浓度为5%、酶底比6000U/g,酶解温度和pH在最适条件(见表1)下进行酶解反应,酶解5h后,测定上清液水解度及ACE抑制率,筛选出水解度及ACE抑制率最高的酶。
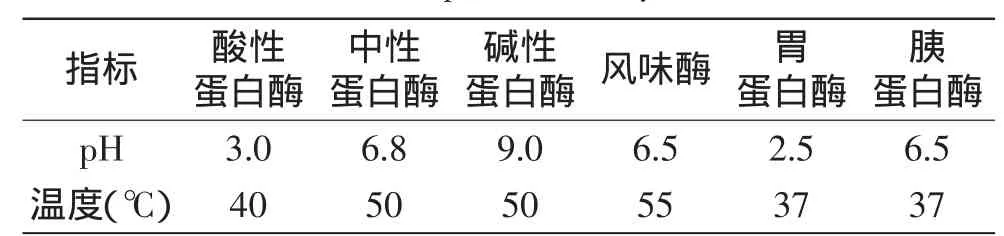
表1 各种蛋白酶酶解条件Table 1 Kinds of proteases enzyme conditions
1.2.3 猪肩胛骨降血压肽制备工艺优化单因素实验
将自制猪肩胛骨粉样品按照比例1%、2%、3%、4%、5%、6%加入一定量蒸馏水,分别在酶底比1000、3000、5000、7000、9000、11000U/g,酶解温度为50、55、60、65、70、75℃,pH 5.5、6、6.5、7、7.5,酶解时间1、2、3、4、5、6h的不同条件下进行酶解,以ACE抑制率为主要指标,筛选出最适的条件。
1.2.4 猪肩胛骨酶解制备降血压肽的响应面实验 在酶解单因素实验的基础上,以酶底比、酶解温度、酶解时间为影响因素,以ACE抑制率作为指标,进行优化实验,采用Box-Behnken进行实验设计和结果分析,得出制备降血压肽的最佳工艺条件。实验设计见表2。

表2 响应面实验因素水平表Table 2 Factors and levels of RSM experiment
1.2.5 ACE抑制率的测定 在Cushman等[14]所用的方法的基础上进行改进。方法如下:将酶解液稀释5倍,将ACE酶配制成0.1U/m L溶液,将HHL溶解在0.1mol/L、pH8.3的硼酸缓冲液(含有0.3mol/L NaCl)中配制成5mmol/L的HHL溶液,在10m L试管中加入100μL 5.0mmol/L的HHL溶液和20μL样品液,混匀后于37℃水浴中保温5m in后,加入20μL的ACE酶液启动反应,混匀后于37℃水浴中保温60min,从水浴锅中取出,加入150μL 1mol/L的HCl终止反应,再加入1.2m L冷冻后的乙酸乙酯,强烈振荡混匀后,静置5m in,然后以4000r/m in离心20m in,用移液管吸取1.0m L的乙酸乙酯层(上层),在110℃烘箱中经1h烘干,最后加入4m L的蒸馏水充分溶解后于228nm处检测吸光值。平行对照管除在反应前先加入150μL 1mol/L的HCl以终止反应外,其余成分、操作步骤同反应管。
ACE抑制率(%)=(Ab-Aa)/(Ab-Ac)×100
式中,Aa是样a的吸光度,样a加入了样品液,与ACE、HHL共同反应的测定值;Ab是样b的吸光度,样b为反应中未加入样品液,反应结束后添加样品液以维持整个反应体系平衡,是ACE与HHL完全反应的参照的测定值;Ac是样c的吸光度,样c在反应前先使ACE失活,再加入样品液,是ACE与HHL反应的空白对照的测定值。
1.2.6 蛋白含量测定 考马斯亮蓝法[15]。
1.2.7 游离氨态氮含量的测定 采用中性甲醛滴定法[16]。分别吸取待测水解液10m L于250m L烧杯中,加蒸馏水60m L,用磁力搅拌器边搅边滴加0.05mol/L NaOH标准溶液至pH为8.20,立即加入甲醛10m L,再用磁力搅拌器边搅边滴加0.05mol/L NaOH至pH为9.20,记录加入甲醛后消耗NaOH标准溶液的体积(m L)。重复实验两次,同时做空白实验。计算公式如下:

1.2.8 水解度的测定 计算公式如下:

式中,N2为酶解后游离氨基氮含量;N1为酶解前游离氨基氮含量;N0为总氮含量[17]。
2 结果与分析
2.1 酶筛选实验
不同蛋白酶酶解液的水解度和ACE抑制率结果见图1。
由图1可见,碱性蛋白酶、风味蛋白酶的酶解液ACE抑制率最高,分别为62.95%和63.42%,但是风味蛋白酶酶解液的水解度为17.50%,较碱性蛋白酶酶解液水解度9.61%高。这可能是因为风味酶是外肽酶和内切酶的混合真菌源性酶,可以快速水解产生分子量较小的肽,碱性蛋白酶是特异性内切酶,水解速率较风味酶慢,可产生分子量中等的肽[18]。因此选用风味蛋白酶作为酶解条件优化的酶制剂。
2.2 单因素实验结果
2.2.1 酶解温度对酶解液的水解度及ACE抑制率的影响 在酶底比3000U/g,底物浓度3%,酶解pH6.5的条件下酶解5h,考察酶解温度对酶解液水解度及ACE抑制率的影响。结果如图2所示,温度从50℃开始上升,在55℃时,水解度和ACE抑制率均有最高值,水解度最大值是16.17%,ACE抑制率最大值为60.14%。随着温度的升高,水解度和ACE抑制率均减小,说明温度对水解度及ACE抑制率影响较大。

图1 不同蛋白酶对水解物的水解度及ACE抑制率的影响Fig.1 The effectof different protease on degree of hydrolysis and ACE inhibitory rate

图2 酶解温度对水解度及ACE抑制率的影响Fig.2 The effectof temperature on degree of hydrolysis and ACE inhibitory rate
2.2.2 酶解pH对酶解液的水解度及ACE抑制率的影响 在酶底比3000U/g,底物浓度3%,酶解温度55℃的条件下酶解5h,考察酶解pH对酶解液水解度及ACE抑制率的影响。如图3所示,pH由5.5变化到7.5,酶解液水解度变化不大,基本维持在11%左右,说明风味蛋白酶最适pH范围较广,且pH对水解物水解度影响较小。ACE抑制率随酶解液pH改变变化也不大,在酶解pH为7时,ACE抑制率有最大值55.02%。综合考虑,酶解pH为7时的酶解效果最好。

图3 酶解pH对水解度及ACE抑制率的影响Fig.3 The effectof pH on degree of hydrolysis and ACE inhibitory rate
2.2.3 酶解时间对酶解液的水解度及ACE抑制率的影响 在酶底比3000U/g,底物浓度3%,pH 6.5,酶解温度55℃的条件下酶解,考察酶解时间对酶解液水解度及ACE抑制率的影响。如图4所示,酶解液水解度随水解时间加长逐步缓慢上升,说明酶解时间对水解度影响较小。ACE抑制率在4h时达到最高值50.70%,之后时间再增加,ACE抑制率下降。

图4 酶解时间对水解度及ACE抑制率的影响Fig.4 The effectof time on degree of hydrolysis and ACE inhibitory rate
2.2.4 酶底比对酶解液的水解度及ACE抑制率的影响 底物浓度3%,酶解pH6.5,酶解温度55℃的条件下酶解5h,考察酶底比对酶解液水解度及ACE抑制率的影响。如图5所示,酶解液水解度随酶底比的增加一直呈上升趋势,并逐渐趋于平缓。ACE抑制率在酶底比为5000U/g时达到最高值55.00%,之后再增加酶底比,ACE抑制率下降。
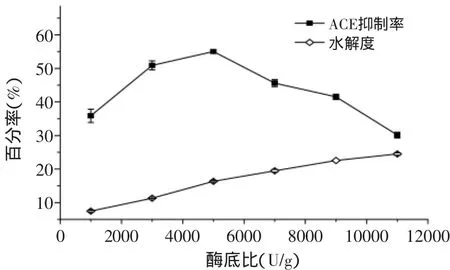
图5 酶底比对水解度及ACE抑制率的影响Fig.5 The effectof enzyme/substrate ratio on degree of hydrolysis and ACE inhibitory rate
2.2.5 底物浓度对酶解液的水解度及ACE抑制率的影响 在酶底比3000U/g,酶解温度55℃,酶解pH 6.5的条件下酶解5h,考察底物浓度对酶解液水解度及ACE抑制率的影响。如图6所示,酶解液水解度随酶底比的增加呈上升趋势,在3%以后上升较缓。ACE抑制率在底物浓度5%时达到最高值57.20%,底物浓度再上升,ACE抑制率下降。综合考虑,选取底物浓度为5%。

图6 底物浓度对水解度及ACE抑制率的影响Fig.6 The effectof substrate concentration on degree of hydrolysis and ACE inhibitory rate
从以上分析结果可以看出,当酶解液的ACE抑制率最大时,水解度并没有达到最大值,而随着水解度的加大,ACE抑制率反而下降,二者不呈线性关系,这与王茵等[19]研究结果一致。这可能是由于水解度提高时,将具有ACE抑制活性的肽进一步水解,导致活性降低[20]。因此本实验在进行酶解制备降血压肽工艺条件优化时,选用ACE抑制率为主要指标。
2.3 响应面法优化猪肩胛骨降血压肽制备工艺
2.3.1 模型建立与方差分析 根据单因素实验结果,采用三因素三水平对酶解液的ACE抑制率进行响应面优化实验,结果见表3。
由表4可知,在该模型中,A、C、AC、B2、C2对ACE抑制率影响显著,即酶底比、水解时间、酶底比与水解时间的交互作用对水解度的ACE抑制率有显著影响,且影响顺序为:A>C>B,即:酶底比>酶解时间>酶解温度;失拟项不显著,并且该模型的R2=0.9654,R2Adj=0.9030,说明该回归方程对实际情况拟合较好,使用该回归方程代替真实的实验点进行分析是可行的。
对表中数据进行回归拟合之后,得到ACE抑制率对酶底比、水解时间、水解温度的二次多项回归方程为:Y=63.54+3.25A-0.27B+1.11C-0.20AB+2.00AC-0.89BC-0.9A2-2.11B2-2.24C2。

表3 响应面实验设计方案及分析结果Table 3 Experimental design and results forresponse surface analysis
由方程预测得到最佳水解度条件是酶底比6900U/g,水解温度53.4℃,水解时间4.71h,此时ACE抑制率为66.93%。为方便验证,将参数修正为pH7.0,底物浓度5%,酶解温度53℃,酶解时间4.5h,酶底比6900U/g,此条件下制备出猪肩胛骨降血压肽的ACE抑制率为65.31%,接近于理论值。
通过ACE抑制率模型的二元多次回归方程所作的响应面曲面图见图7,是酶底比与水解时间(AC)交互作用对水解物ACE抑制率的影响。响应曲面坡度较大,说明响应值对于处理条件较敏感,与表4结果一致。
3 结论
3.1 对比酸性蛋白酶、中性蛋白酶、碱性蛋白酶、胃蛋白酶、胰蛋白酶、风味蛋白酶对酶解液ACE抑制率及水解度的影响,确定风味蛋白酶为最适酶。
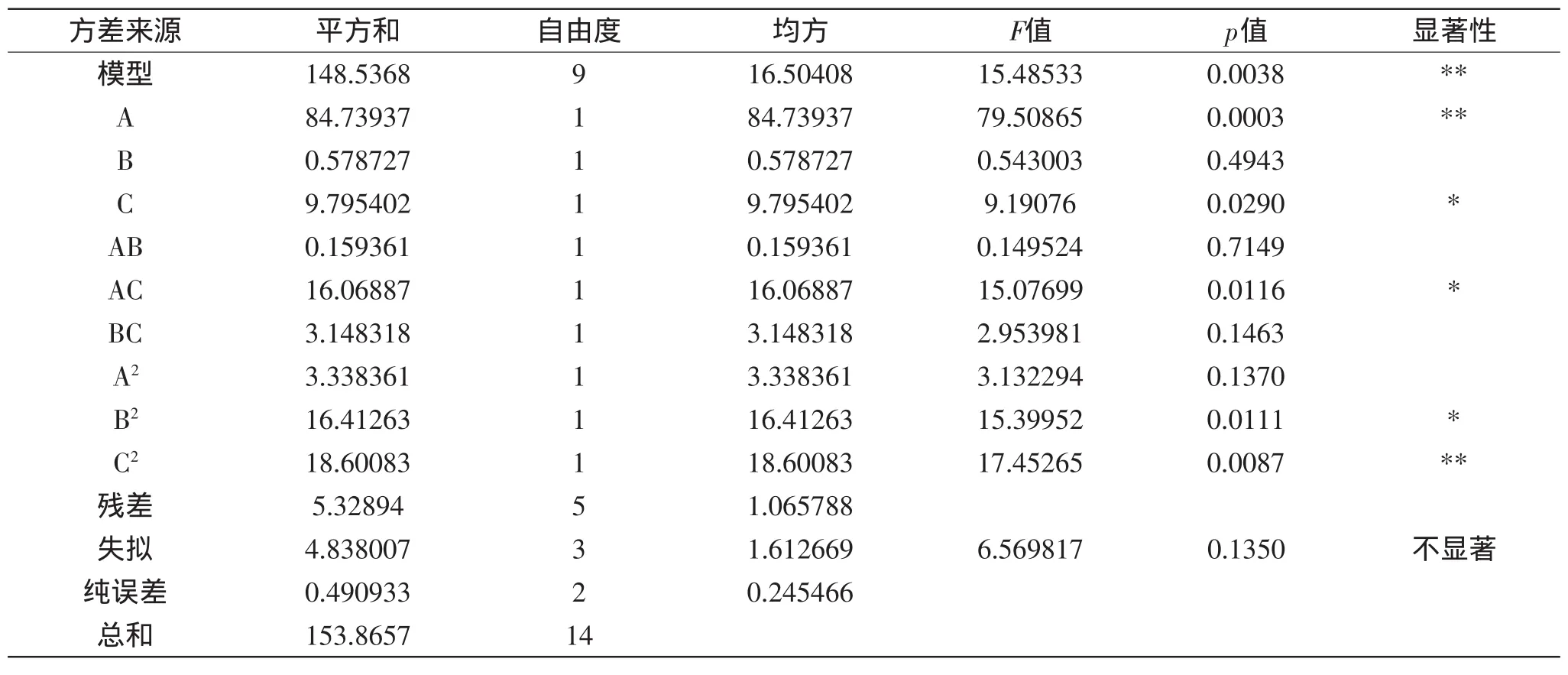
表4 实验结果方差分析表Table 4 Analysis of varlance for the fitted regressionmodel

图7 酶底比与水解时间交互影响水解物ACE抑制率的响应曲面图Flg.7 Response surface showing the effects of hydrolysis time and enzyme/substrate ratio on ACE inhibitory rate
3.2 通过单因素实验考察了酶解pH、酶解温度、酶解时间、底物浓度、酶底比这5个因素对酶解液水解度和ACE抑制率的影响,并通过Box-Behnken模型响应面法优化猪肩胛骨降血压肽制备工艺,得到制备降血压肽最佳酶解条件为pH 7.0、底物浓度5%、酶解温度53℃、酶解时间4.5h、酶底比6900U/g,此时ACE抑制率为65.31%。与理论值接近。
我国畜禽资源丰富,浪费严重,猪肩胛骨的利用率更是极低,本实验确定的猪肩胛骨ACE抑制肽制备工艺可以为猪骨的综合利用提供一定的参考数据。本实验将猪肩胛骨酶解后,只是ACE抑制活性进行主要研究,而酶解液中的其他活性肽有待进一步研究。酶解得到的ACE抑制肽还有待利用其他的分离纯化技术对高活性的猪肩胛骨ACE抑制肽进行进一步分离。
[1]孙蓓,王龙刚.畜禽骨的综合利用现状及发展前景[J].中国调味品,2011,36(4):1-13.
[2]杨巍,成晓瑜,陈文华,等.畜禽骨深加工技术与应用现状[J].肉类研究,2009,23(11):75-79.
[3]V Kamath,SNiketh,A Chandrashekar,et al.Chymotryptic hydrolysates ofa-kafirin,the storage protein of sorghum(Sorghum bicolor) exhibited angiotensin converting enzyme inhibitory activity[J].Food Chemistry,2007,100:306-311.
[4]Blanca Hernández-Ledesma,María del Mar Contreras,Isidra Recio.Antihypertensive peptides:Production,bioavailability and incorporation into foods[J].Advances in Colloid and Interface Science,2011,165(1):23-35.
[5]尹波欢,王燕.食源性降血压肽研究进展[J].农产品加工·学刊,2011,7(7):141-144.
[6]蔡丽华.牛骨酶解制备血管紧张素转换酶抑制肽的研究[D].武汉:华中农业大学.2010.
[7]李诚,张小丽,付刚,等.酶解鸭骨制取ACE抑制肽工艺条件的优化[J].中国酿造,2011,30(8):61-65.
[8]王英超,李天俊,王敏华,等.羊骨酶解物中降血压肽的分离纯化工艺研究[J].食品研究与开发,2007,28(9):7-10.
[9]刘小红,李诚,付刚,等.猪股骨头胶原蛋白降血压肽的分离纯化[J].食品科学,2013:http://www.cnki.net/kcms/detail/ 11.2206.TS.20130702.20131401.20130069.htm l.
[10]王玉霞.鸡骨肽制备及其ACE抑制活性研究[D].北京:中国农业科学院,2011.
[11]Patricia Castellano,María-Concepción Aristoyb,MiguelÁngel Sentandreub,etal.Peptideswith angiotensin Iconverting enzyme(ACE)inhibitory activity generated from porcine skeletalmuscle proteins by the action ofmeat-borne Lactobacillus[J].Journal of Proteomics,2013,89:183-190.
[12]陈硕,李诚,李娜,等.猪股骨头胶原蛋白水解产物的降血压作用[J].食品科学,2013,34(11):285-287.
[13]李娜,李诚,陈硕,等.猪股骨不同部位胶原蛋白水解产物降血压作用[J].食品科学,2013,34(13):289-292.
[14]Cushman DW,Cheung HS.Spectrophotometric assay and properties of the angiotensin-converting enzyme of rabbit lung[J]. Biochemical Pharmacology,1971,20(7):1637-1648.
[15]刘小华,张美霞,于春梅.考马斯亮兰法测定壳聚糖中蛋白的含量[J].中国交通医学杂志.2006,20(2):159-160.
[16]郭蔼光.基础生物化学[M].北京:高等教育出版社,2004:89-92.
[17]GB/T 5009.5-2010食品安全国家标准食品中蛋白质的测定[S].
[18]Fatemeh Bamdad,Jianping Wu,Lingyun Chen.Effects of enzymatic hydrolysis on molecular structure and antioxidant activity of barley hordein[J].Journal of Cereal Science,2011,54(1):20-28.
[19]王茵,刘淑集,吴成业.紫菜降血压肽酶法制备工艺的优化[J].福建水产,2008,12(4):64-68.
[20]Marıa M Yust,Justo Pedroche,Julio Girón-Calle,et al. Production of ace inhibitory peptides by digestion of chickpea legumin with alcalase[J].Food Chemistry,2003,81(3):363-369.
Preparation of antihypertensive peptides from pig scapula protein by enzyme method
CHEN Chang-lin,LICheng*,FU Gang,ZHANG Shu-ying,HUANG Shan-shan,XIAO Lan
(College of Food,Sichuan Agriculture University,Ya’an 625014,China)
Pig scapula p rotein was hyd rolyzed w ith p rotease to p repare antihypertensive pep tides.The sing lefac tor method was used to analyze the effect of the kind of enzyme,time,substrate concentration,enzyme/ substrate ratio,hyd rolysis pH and temperature on deg ree of hyd rolysis and Angiotensin-converting enzyme(ACE)inhibitory activity of pig scapula p rotein hyd rolysate.Operating parameters such as temperature,hyd rolysis time and enzyme/substrate ratio were op tim ized using response surface analysis based on ACE inhibitory rate.The op timal hyd rolysis cond itions of pig scapula pep tide were enzyme/substrate ratio of 6900U/g,hyd rolysis temperature of 53℃,hyd rolysis time of 4.5h.The theoretical value of ACE inhibitory ac tivity was 66.93%,which was c lose to the actual value of 65.31%.
p ig scapula;enzyme;antihypertensive pep tides;response surface
TS209
A
1002-0306(2014)18-0211-05
10.13386/j.issn1002-0306.2014.18.037
2013-12-19 *通讯联系人
陈昌琳(1989-),女,在读硕士研究生,研究方向:功能性食品。
