一株木质纤维素酶高产菌株的选育及产酶条件研究
2014-02-27陈英连张良雨
陈英连,付 正,张良雨,管 斌,孔 青
(1.中国海洋大学,食品科学与工程学院,山东青岛266003)2.山东医学高等专科学校,山东济南250002)
一株木质纤维素酶高产菌株的选育及产酶条件研究
陈英连,付 正,张良雨,管 斌*,孔 青
(1.中国海洋大学,食品科学与工程学院,山东青岛266003)2.山东医学高等专科学校,山东济南250002)
主要通过紫外(UV)和甲基磺酸乙酯(EMS)的交替诱变的方法提高绿色木霉的产酶能力,并成功筛选到了一株产酶活性较高的菌株,其在平板筛选培养基中的透明圈直径与菌落直径之比达到2.1,传代稳定后在产酶培养基中纤维素酶活(CMCase)和滤纸酶活(FDAase)分别达到21.05U/mL和2.4U/mL。之后经培养基的优化进一步提高其酶活,最终诱变菌株在最佳产酶培养基中CMCase达到22.5U/mL,FDAase达到2.52U/mL。
绿色木霉,诱变,纤维素酶,液体发酵
纤维素类物质广泛存在于自然界中,最为常见的为农作物秸秆。这类物质一般未经处理就被丢弃或者直接将其燃烧,对环境产生了很大污染。而如果通过生物方法将其转化,得到可以直接被人类或牲畜利用的可再生的生物资源,这不仅可以解决环境污染问题,还能在一定程度上缓解生物资源的短缺[1]。
木质纤维素类物质其主要成分为纤维素、半纤维素和木质素,这三种成分随植物物种不同含量也有所不同,其中纤维素和半纤维素含量占大部分[1-2]。目前对木质纤维原料的利用主要集中在纤维素和半纤维素的利用,所以原料的预处理即为将木质素分离,得到纤维素半纤维素的混合物,再利用纤维素酶将其分解为还原糖,从而进一步发酵成所需的产物,如酸、酒精、单细胞蛋白等[3]。纤维素酶在生产还原糖这一重要步骤中起到了决定性作用,所以得到高产量的纤维素酶对整个转化过程起到了关键性的作用。纤维素酶来源广泛,很多植物和微生物都可以生产纤维素酶,而通过微生物发酵产纤维素酶由于其成本低、提取过程简便、产量高等优点多年来吸引了大批的国内外研究者。
很多微生物能够产生纤维素酶来分解纤维素成还原糖,研究较多的是丝状真菌中的木霉属、曲霉属、根霉属和漆斑霉属,其中木霉属被广泛应用,潜力较大的为绿色木霉[4-5]。有研究者利用绿色木霉与其他微生物共同培养,分解大米秸秆为还原糖[3,6]。一般直接从自然界分离的原始菌株其酶产量低,需利用生物学方法提高其酶活,包括理化诱变育种、基因工程育种等。其中诱变育种由于其操作简单、速度快及收效显著等特点被广泛利用[7]。Kridztina kovacsa利用物理化学共同诱变的方法显著提高了原始菌株的纤维素酶产量,并利用预处理的柳木生产得到了还原糖[8]。本文以绿色木霉为出发菌株,通过物理化学复合诱变得到了一株木质纤维素酶高产菌株,传代后稳定性良好,进一步通过对其培养基进行了优化,得到产酶最佳培养基。为木质纤维素酶的深入研究提供数据支持。
1 材料与方法
1.1 材料与仪器
绿色木霉(Trichoderma viride 8140) 由中国海洋大学食品科学与工程学院酶工程研究室保藏,该菌株于PDA斜面培养基[5]上在4℃下保存;平板筛选培养基[9]Mandel’s营养盐[10]1L,羧甲基纤维素钠(CMC-Na)5g,Triton X-100 1m L,琼脂15g,pH 5.5;刚果红溶液 刚果红染料1g,蒸馏水1L;NaCl溶液1mol/L;液体发酵培养基[7]Mandel’s营养盐1L,微晶纤维素10g,吐温-80 2m L,pH 5.5;液体限量培养基:葡萄糖2g,(NH4)SO41g,KH2PO42g,H2O 1000m L,pH 6.0。
SPS202F型电子天平 梅特勒-托利多称重设备有限公司:ZDX-35B1型高压消毒锅 上海申安医疗器械厂;XK 24-1060007型电热恒温培养箱、SHZ-C型全温空气恒温振荡器 上海跃进医疗器械厂;PHS-2F型pH计、722N型可见分光光度计 上海精科电子有限公司;BCM-1000型超净工作台 江苏净集团安泰公司;电子万用炉 天津市泰斯特仪器有限公司;LD5-10B型低速离心机 北京雷勃尔离心机有限公司;UV-2802PC型紫外分光光度计 尤尼克仪器有限公司。
1.2 实验方法
1.2.1 菌种培养方法 保藏的绿色木霉菌种接种于PDA斜面进行活化,待形成一层绿色孢子,接种环平板划线,刚果红染色,三角瓶摇瓶复筛后得到酶活较高的一株菌作为出发菌株[11]。用无菌水冲洗斜面孢子,按103个/m L接种量接种于液体发酵培养基,装量为50m L/300m L,于28℃、180r/m in培养8~10d,测定菌体生物量及酶活。
1.2.2 粗酶液提取 取培养6d的发酵液,置于离心管中4000r/min离心10min,取上清液为粗酶液,适当稀释后测定酶活。
1.2.3 葡萄糖标准曲线制作 取8支25m L比色管,分别加入2m L葡萄糖溶液,使葡萄糖含量分别为0、0.2、0.4、0.8、1.0、1.2、1.4、1.6mg,并分别加入2m L DNS,沸水浴5m in,定容至刻度,540nm处测定吸光值,制作吸光值与葡萄糖含量的标准曲线[12]。
1.2.4 菌种诱变[12]
1.2.4.1 采用紫外诱变与硫酸二乙酯物理化学复合诱变 分别进行了两轮处理,PDA斜面培养7d的菌株,生理盐水冲洗,脱脂棉过滤,得到孢子悬液,接入液体限量培养基中,28℃摇床培养8~10h,3000r/m in离心10min去除培养液,生理盐水洗涤2~3次,脱脂棉过滤除去菌丝体,血球板计数法计数[11],调整孢子浓度为108个/m L。采用物理化学复合诱变,其木质纤维素酶高产菌株的育种方案如图1所示。
1.2.4.2 菌种初筛 将诱变后的菌液适当稀释后涂布于平板筛选培养基上,28℃恒温培养3~4d,刚果红染色并用NaCl溶液洗涤,对比透明圈的大小。选择透明圈直径/菌落直径(Hc)≥1.5的菌落进行复筛。

图1 纤维素酶高产菌株的育种过程Fig.1 The developmentof high cellulase producingmutants with UV-lightand EMS treatment
1.2.4.3 菌种复筛[12]初筛后的菌株,接种于液态产酶培养基中,培养7d,取培养液抽滤,得到滤液,5000r/m in,离心10m in,取上清液,适当稀释测定酶活。
1.2.5 诱变菌株部分培养基的优化[9,14-15]对培养基的最佳碳源及其含量、最佳氮源、pH、金属离子进行了优化。
1.2.5.1 碳源的优化 培养基其他成分不变,将培养基的碳源分别设定为10g/L的微晶纤维素,10g微晶纤维素+5g麸皮/L,10g微晶纤维素+10g麸皮/L,10g微晶纤维素+20g麸皮/L,5g微晶纤维素+5g麸皮/L,5g微晶纤维素+10g麸皮/L,5g微晶纤维素+20g麸皮/L,20g麸皮/L。培养6d后测定酶活,确定最佳碳源。
1.2.5.2 氮源的优化 碳源确定不变后,培养基其他成分不变,把培养基中的氮源分别用2g的无机氮源磷酸氢二铵、硫酸铵、氯化铵、硝酸铵和硝酸钠代替。培养6d后测定酶活,确定最佳无机氮源。
1.2.5.3 金属离子的优化 分别研究了镁离子和钙离子对菌株产酶的影响,分别在培养基中添加0、0.1、0.2、0.3、0.4、0.5g/L的硫酸镁,培养7d后测定酶活,确定硫酸镁的添加量。分别在培养基中添加0、0.1、0.2、0.3、0.4、0.5g/L的无水氯化钙,培养7d后测定酶活,确定氯化钙的添加量。
1.2.5.4 pH的优化 从相关文献分析得知,绿色木霉的产酶最适pH范围为4~7,所以设定pH梯度为4、4.5、5、5.5、6、6.5、7。
1.3 测定方法
1.3.1 酶活测定方法
1.3.1.1 β-1.4-葡萄糖内切酶活性(CMCase)的测定[13]向比色管中加入1.5m L的1%的醋酸纤维素钠底物,50℃保温,然后加入0.5m L适当稀释的粗酶液,50℃下准确反应30min,2m LDNS终止反应,沸水浴5min,定容至比色管刻度,混匀,540nm处测定吸光值。
1.3.1.2 滤纸酶活(FDA)的测定[13]向比色管中加入1.5m L pH为4.8的柠檬酸缓冲液和1cm×6cm大的滤纸条,50℃保温,然后加入0.5m L适当稀释的粗酶液,50℃下准确反应60m in,2m L DNS终止反应,沸水浴5min,定容至比色管刻度,混匀,540nm处测定吸光值。

式中:n为0.5m L酶液所生成的葡萄糖毫克数;0.5为所加酶液体积;30/60为反应时间;0.18为mg和μmol的换算;所得酶活乘以稀释倍数即为每毫升培养液的酶活。
1.3.2 菌体生物量的测定 以菌体干重(Dry Cell Weight)指示菌体生物量,取3m L适当稀释的发酵液,加3m L 1mol/L HClO4,沸水浴中准确反应20m in,取出后冷却至室温,冷冻离心机6000r/min离心10min,于紫外分光光度计260nm波长下测OD值,定为A。以离心去除菌体的澄清发酵液经上述实验作为对照调零,则每升发酵液菌体干重DCW=0.65×A×n[1]
式中,n:为发酵液稀释倍数。
2 结果与分析
2.1 葡萄糖标准曲线
根据葡萄糖标准曲线制作方法,葡萄糖标准曲线制作以OD值为纵坐标,以葡萄糖含量为横坐标,如图2所示。葡萄糖标准曲线方程:y=0.5659x-0.013,R2=0.9981。
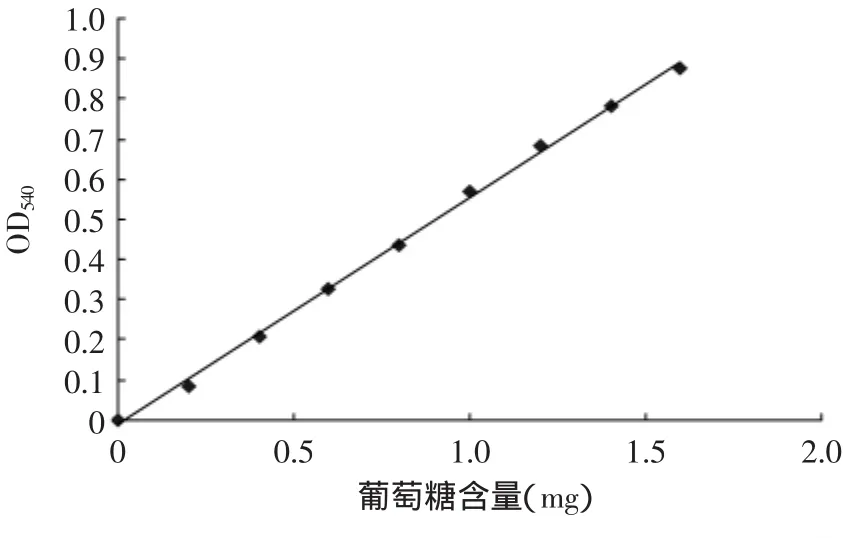
图2 葡萄糖的标准曲线Fig.2 Standard curve of glucose
2.2 平板初筛的结果
出发菌株通过多次复合诱变,每次诱变通过初筛和复筛两部。初筛根据在筛选平面皿(培养基)上形成的透明圈的大小,复筛根据三角瓶摇瓶(液态)培养的酶活,每次诱变后等酶活稳定再进行下步诱变。最终得到菌株T.viride8140UEUE4-80,如图3所示。其透明圈直径/菌落直径=2.1。

图3 诱变菌株在刚果红培养基上透明圈展示Fig.3 Hydrolyzed zone on the selective plate
2.3 摇瓶复筛的结果
将原始菌株与诱变菌株在相同条件下同时液态培养,每天测定CMCase和FDA酶活。其摇瓶复筛结果如图4~图6所示。
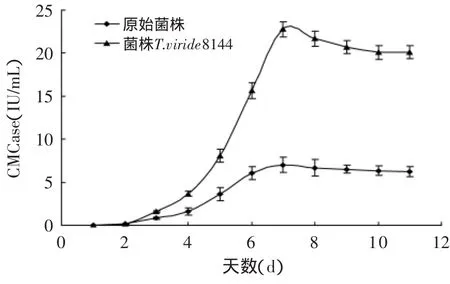
图4 原始菌株与诱变菌株CMCase对比Fig.4 Comparison of enzyme production curve betweenmutant strain and original strain
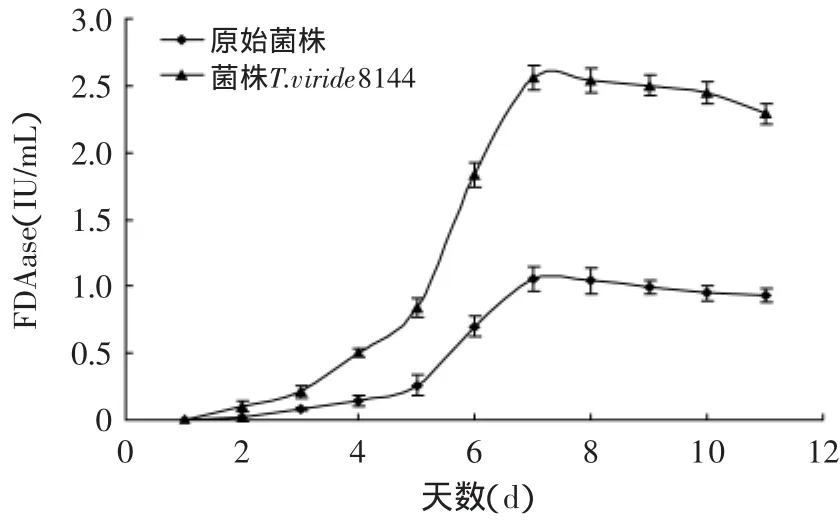
图5 原始菌株与诱变菌株FDAase对比Fig.5 Comparison of enzyme production curve betweenmutant strain and original strain
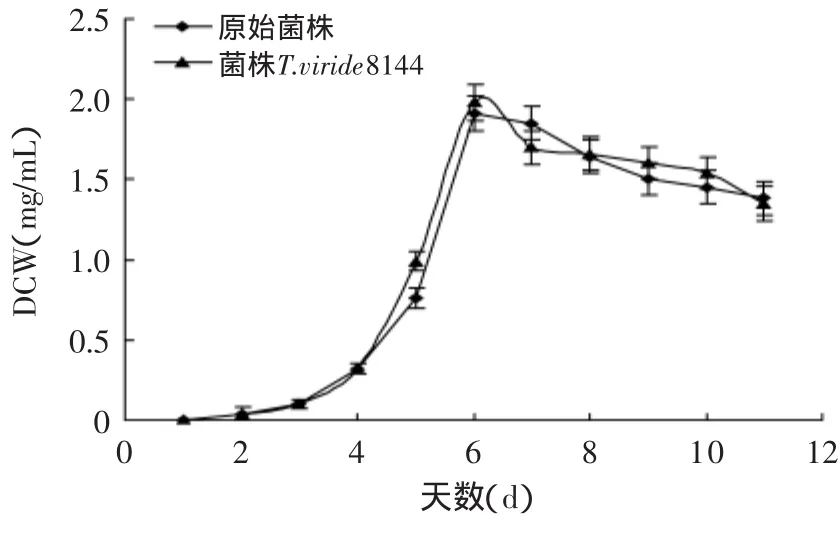
图6 原始菌株与诱变菌株菌体干重(DCW)的对比Fig.6 Comparison of DCW curve betweenmutant strain and original strain
从图4~图6可看出,在液态摇瓶培养条件下,原始菌株与菌株T.viride8140UEUE4-80 CMCase和FDAase的酶活力对比,菌株的生长无明显变化,只是纤维素酶活力得到了较大幅度的提高。这一研究结果说明:诱变并没有改变其生长量,而是改变了该株微生物分泌酶的产量。可能是诱变处理改变了产酶相关基因,从而改变了其酶产量或者其酶活力。诱变株的CMCase比原始菌株提高了2倍,其FDAase力比原始菌株提高了1.5倍。诱变株的最高CMCase和FDAase酶活出现在液态培养的第7d,分别为22.79IU/m L和2.56IU/m L。厦门大学Xinde Jiang等[16]利用EMS和UV同时对绿色木霉出发菌株进行诱变,得到了一株突变株EU2-77,其CMCase达到了16.46IU/m L,FDAase达到了2.19IU/m L,分别比原始菌株提高了1.16倍和1.49倍。与之比较,本文所用EMS和UV的交替诱变方法较为有效,诱变效果比较明显。
2.4 诱变菌株稳定性研究
诱变菌株连续在PDA培养基上传代培养,每传一代都接种于液态摇瓶产酶培养基中培养7d,测定酶活。其实验结果如图7、图8所示。
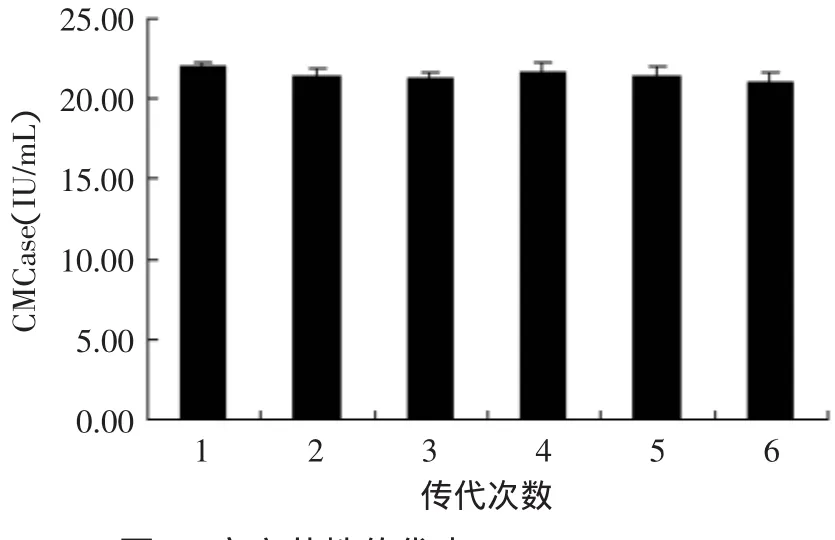
图7 突变菌株传代中CMCase(IU/mL)Fig.7 Effectof passage numbers on enzyme activity
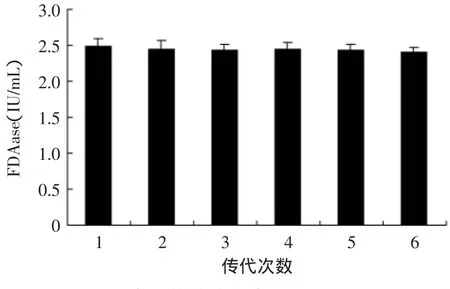
图8 突变菌株传代中FDA(IU/mL)Fig.8 Effectof passage numbers on enzyme activity
由图7、图8可看出,诱变菌株传到第六代时,其菌株酶活力无明显下降,CMCase仅下降了0.92IU/m L,FDAase仅下降了0.09IU/m L,说明诱变基因稳定性良好,并没有产生回复突变,传代中其突变的基因在复制、转录和翻译过程中保持较高的稳定性,突变基因可稳定的传给每个菌株后代,并作为一种稳定的性状进行表达。其菌株产酶稳定性良好,可以用来进行后续研究。
2.5 菌株培养基的优化
2.5.1 培养基中碳源的影响 由图9可看出,当微晶纤维素与麸皮同时加入时,其CMCase和FDA酶活达到最高,为最佳碳源配比。微晶纤维素加入量减少,酶活力下降趋势明显,说明微晶纤维素在培养基中主要诱导两种酶的产生,随麸皮增加其酶活力只出现了稍微的增加,而只加微晶纤维素时比加入5g麸皮时的酶活要高,说明麸皮对酶的诱导作用小于微晶纤维素,可能是由于麸皮中营养成分比较高,含有部分淀粉及其他糖类、良好的氮源等,纤维类物质较少,而促进产酶的主要是纤维类物质的诱导,所以麸皮对产酶的诱导作用很小。
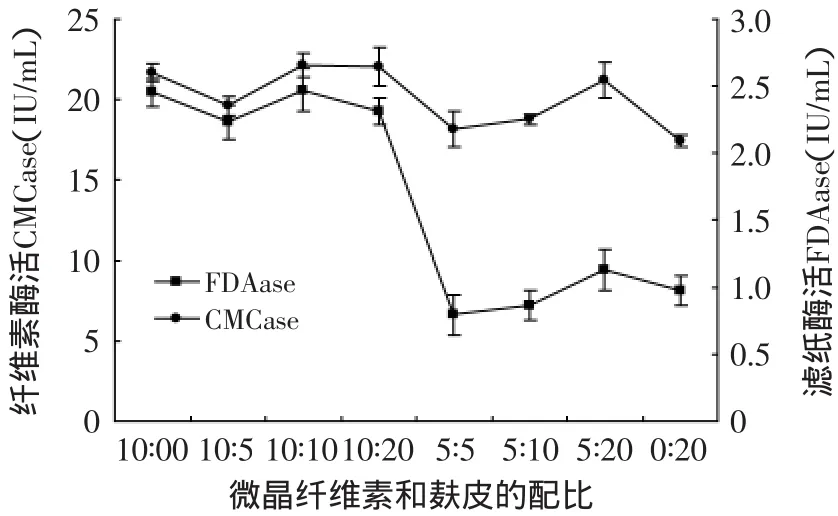
图9 碳源配比对产酶的影响Fig.9 The effectof the ratio of Avicel and bran on enzyme production
2.5.2 培养基中无机氮源的确定 由图10可看出,硫酸铵为其最佳无机氮源,其CMCase和FDAase达到最高,为13.12U/m L和2.09U/m L。在只加无机氮源时其酶活明显比之前降低,所以说明培养基中有机氮源也有重要作用[1,10],加有机氮源尿素和蛋白胨,不仅可以提供营养物质,而且它们的添加对培养过程中培养基的pH起到一定的调节作用,相关文献报道[11]其最佳添加量为尿素0.3g/L、蛋白胨0.75g/L。
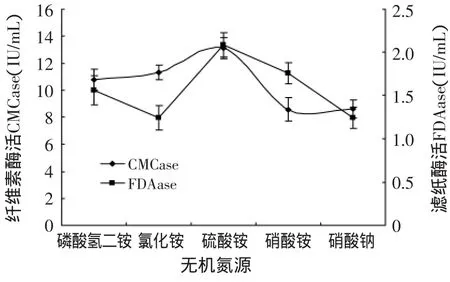
图10 无机氮源对产酶的影响Fig.10 The effectof inorganic nitrogen on enzyme production
2.5.3 金属离子对产酶的影响 在Mandel’s营养盐中镁离子和钙离子作为主要的金属离子影响菌株产酶活性[7],镁离子和钙离子主要是通过影响酶的构象从而影响酶活性。由图11和图12可看出,当镁离子和钙离子添加量为0.3g/L时,其酶活力最高,含量增加或者减少都影响产酶。通过调节培养基最终得到CMCase为22.5U/m L FDAase酶活为2.52U/m L。
2.5.4 培养基的pH对产酶的影响 由图13可看出,当液态培养培养基的pH为6时,其产酶活力最高,为最适pH。这时CMCase达到了23.16U/m L,滤纸酶活达到2.38U/m L。由上图可以看出上述两种酶的最佳产酶pH相同,pH降低或升高都会影响菌株的产酶活力,并且pH升高对产酶的影响明显比pH下降对产酶的影响大,随pH升高其两种酶活都出现了明显下降,这可能和绿色木霉其最适产酶环境为偏酸性培养介质有关。
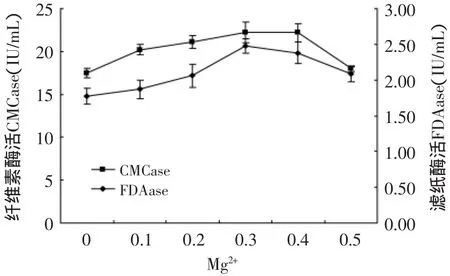
图11 Mg2+对产酶的影响Fig.11 The effectofMg2+on enzyme production
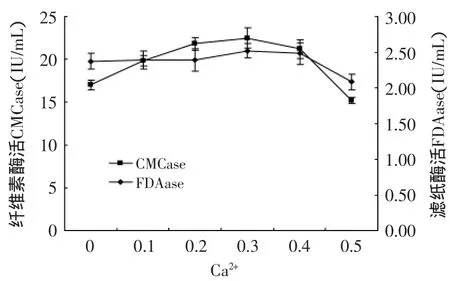
图12 Ca2+对产酶的影响Fig.12 The effectof Ca2+on enzyme production
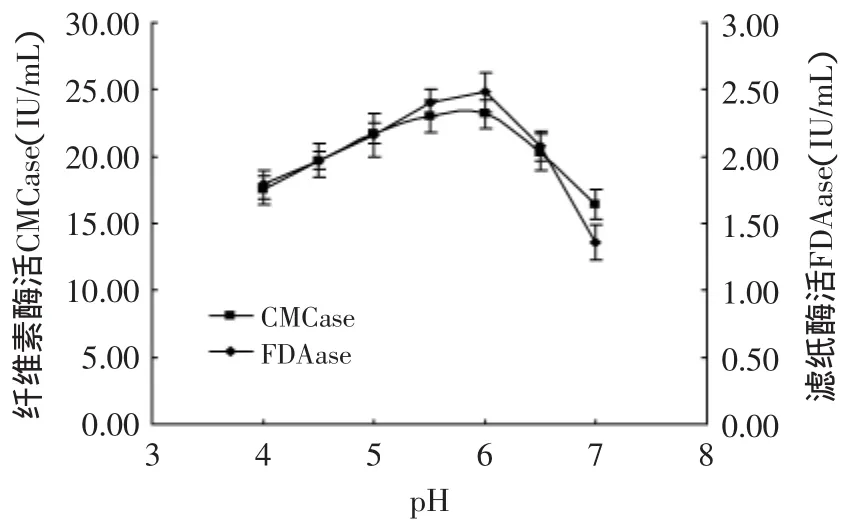
图13 pH对产酶的影响Fig.13 The effectof pH on enzyme production
3 结论
3.1 采用纤维素酶分泌能力较强的野生型菌株、经初步筛选得到生产性菌株(经发酵生产反复训化的菌株)作为出发菌株。
3.2 菌种诱变选用对木霉诱变效果较好的硫酸二乙酯,紫外线作为诱变剂,以新鲜的孢子菌悬液为诱变介质,采用低剂量、反复多次复合诱变处理方法,获得了较高的正突变率。
3.3 经反复多次复合诱变处理和高效的初筛和复筛——“富集培养”,筛选得到了高产纤维素酶变异菌株。在此基础上,又经反复多次纯种分离和摇瓶比较,逐步筛选出了一株产酶稳定性较好的菌种。
3.4 通过对该变异菌株的培养基进行优化培养,获得的最佳培养基配方。利用原始绿色木霉经过诱变,稳定性研究,以及培养基优化,最终得到诱变菌株最佳产酶培养基,其在最佳培养基中CMCase达到22.5U/m L FDAase酶活达到2.52U/m L。
[1]邱向峰.纤维素酶高产菌株的选育及玉米秸秆糖化发酵乳酸的研究[D].青岛:中国海洋大学,2006.
[2]Hendriks A,Zeeman G.Pretreatments to enhance the digestibility of lignocellulosic biomass[J].Bioresource Technology,2009,100(1):10-18.
[3]LüJL,Zhou PJ.Optimal conditions formaximizing production of reducing sugars from microwave-assisted FeCl3pretreated rice straw degraded by Trichoderma viride and Bacillus pumilus[J]. African JournalofMicrobiology Research,2011,31(5):5757-5764. [4]肖舸.绿色木霉的筛选与产纤维素酶发酵条件优化及部分酶学性质研究[D].成都:四川大学,2004.
[5]管斌.复合纤维素酶对杨木SGW浆纤维改性的应用及酶改性机理的研究[D].天津:天津轻工业学院,1998.
[6]Lan TQ,WeiD,Yang ST,etal.Enhanced cellulase production by<i>Trichoderma viride</i>in a rotating fibrous bed bioreactor [J].Bioresource Technology,2013,133:175-182..
[7]李雪峰,侯红萍.选育高产纤维素酶菌种的研究进展[J].酿酒科技,2010(5):92-94.
[8]Kovács K,Megyeri L,Szakacs G,et al.<i>Trichoderma atroviride</i>mutants with enhanced production of cellulase andβ-glucosidase on pretreated willow[J].Enzyme and Microbial Technology,2008,43(1):48-55.
[9]高榕,邓迎达.高生产效率纤维素酶菌株初筛方法的研究[J].纤维素科学与技术,2004,12(3):20-24.
[10]Mandels M,Weber J.The production of cellulases[J].Adv Chem Ser,1969,95:391-414.
[11]钱存柔,黄义秀.微生物学实验教程[M].北京:北京大学出版社,2008:36-57.
[12]沈萍,范秀荣,李光武.微生物学实验[M].第三版.北京:高等教育出版社,2000:25-79.
[13]Eveleigh D E,MandelsM,AndreottiR,etal.Measurementof saccharifying cellulase[J].Biotechnology forBiofuels,2009,2(1):21.
[14]白洪志,杨谦,宋金柱.纤维素降解菌绿色木霉C-08产酶条件研究[J].哈尔滨工业大学学报,2008,40(7):1111-1115.
[15]邵喜霞,韩大勇,张力.绿色木霉合成纤维素酶部分培养条件的优化[J].安徽农业科学,2009,37(23):10893-10894.
[16]Jiang X,Geng A,He N,etal.New isolate of<i>Trichoderma viride</i>strain for enhanced cellulolytic enzyme complex production[J].Journal of Bioscience and Bioengineering,2011,111(2):121-127.
The development of high cellulase production mutant from Trichoderma Viride and study on the condition of enzyme production
CHEN Ying-lian,FU Zheng,ZHANG Liang-yu,GUAN Bin*,KONG Qing
(1.Food Science And Engineering College,Ocean University of China,Qingdao 266003,China;2.Shandong Medical College,Jinan 250002,China)
The cellulase p roduc tion strain T.viride 8140 was treated with UV and EMS.The mutant strain T.viride8140UEUE4-80 was showed to have a higher cellulase activity than others and the Hc of the mutant reached 2.1.After several passages its CMCase and FDAase were stabilized at 21.05U/m L and 2.4U/m L.The conditions of fermentation were studied and the op timal culture med ium was decided.Under the op timal culture med ium,the CMCase and FPAase of the mutant separately reached 22.5,2.52U/m L.
T.viride;mutagenesis;cellulose;liquid fermentation
TS201.3
A
1002-0306(2014)18-0189-05
10.13386/j.issn1002-0306.2014.18.032
2013-12-20 *通讯联系人
陈英连(1989-),女,硕士研究生,主要从事发酵工程方面的研究。
“十二五”农村领域国家科技计划(2013BAD10B02-06);青岛市公共领域科技支撑计划项目(11-2-3-63-nsh);啤酒生物发酵工程国家重点实验室开放课题(K2012002)。
