蜂巢提取液的成分鉴定及抗氧化功效测定
2014-02-27王振斌邵淑萍
王振斌,邵淑萍,孙 平
(江苏大学食品与生物工程学院,江苏镇江212013)
蜂巢提取液的成分鉴定及抗氧化功效测定
王振斌,邵淑萍,孙 平
(江苏大学食品与生物工程学院,江苏镇江212013)
对蜂巢乙醇提取液和水提取液进行了成分鉴定和抗氧化活性的研究。通过对这两种提取液进行GC-MS气质分析,各鉴定出其中17种成分,对两种提取液的总还原力、DPPH·清除率、ABTS+·清除率、超氧阴离子清除率、羟自由基清除率以及油脂抗氧化进行测定,结果表明蜂巢水提液和蜂巢乙醇提取液与化学合成抗氧剂BHT相比均具有较强的抗氧化活性,随着各自浓度的增加,抗氧化活性随之增强,当浓度增加到一定值,清除率趋于稳定,而且蜂巢水提取液的抗氧化效果比乙醇提取液的好,表明蜂巢提取液是一种优良的天然抗氧化剂和自由基清除剂。
蜂巢,成分,抗氧化
蜂巢主要功能成分为黄酮类物质,具有抗氧化、增强免疫、抗炎、祛风镇痛、抑菌杀虫、降血脂、降血压、抗肿瘤、治疗鼻炎等多种生物功效[1]。我国是世界第一的养蜂大国,蜂巢资源丰富,然而利用率却很低,目前主要用作蜂蜡的提取。
蜂巢中的蜂胶、蜂王浆等均是优质的天然抗氧化产物,其中的黄酮、有机酸、维生素、多酚类化合物等均具有抗氧化活性及清除自由基的能力[2]。Yanishliev a N等以猪油作为脂系统模型,证实加入1%或5%的蜂胶可明显抑制氧化作用[3]。张海生等利用超声波辅助提取蜂蛹黄酮并研究得到提取液对超氧阴离子、羟基自由基、烷氧基和烷过氧基均有明显的抑制作用,且均呈现一定的量效关系[4]。Nagai等研究表明蜂王浆清除超氧化物能力仅次于蜂胶,且温度对抗氧化作用影响较小[5]。
本实验在提取蜂巢抗氧化物质的基础上,进行了蜂巢乙醇提取液和水提取液成分的测定,并进一步考察蜂巢乙醇提取液和水提取液的成分以及提取液体外抗氧化作用对羟自由基、超氧阴离子自由基、DPPH自由基和ABTS+自由基等的清除能力及抗氧化能力的影响,为今后深入研究奠定基础。
1 材料与方法
1.1 材料与仪器
1,1-二苯基-2-苦基-肼(三硝基苯肼)(DPPH)购自Sigma公司;没食子酸标准品、芦丁标准品、Folin-Ciocalteu试剂、7.5%Na2CO3溶液、无水乙醇、硝酸铝、亚硝酸钠,冰乙酸、异辛烷、铁氰化钾、三氯乙酸、氯化铁、高硫酸钾、邻苯三酚、浓盐酸、邻菲罗啉 国药集团化学试剂公司,均为分析纯;福临门非转基因葵花籽油 江苏镇江大润发超市。
UV-1601微量紫外分光光度计 北京瑞利分析仪器有限公司;BS124S电子天平 赛多利斯科学仪器有限公司;HH-S2恒温水浴锅 金坛市医疗器械厂。
1.2 蜂巢乙醇提取液和水提液的制备
蜂巢提取液的制备:在预实验的基础上,以溶剂(水、乙醇)和蜂巢粉末质量比30∶1、提取温度40℃的条件下,提取40m in,反复提取三次,合并水提液,浓缩,使其固形物含量达到10%。
1.3 蜂巢提取液的成分鉴定
采用气相色谱法测定其成分。GC:载气为氦气,流量1m L/m in,进样量为1μL,阱温:170℃,阱外套:45℃,传输线:260℃,进样口:250℃,柱温:50℃(保留3m in),以5℃/m in程序升温至100℃(保留8m in),再以10℃/min程序升温至150℃(保留10min),最后以15℃/m in程序升温至260℃(保留7m in)。分流比:50∶1;MS:电子轰击源,扫描范围40~650(m/z),扫描速度0.2s扫全程。结合查阅的有关资料[6],经过质谱解析鉴定,进而分析出样品成分。
1.4 蜂巢提取液的抗氧化功效测定
1.4.1 还原力的测定 将样品溶于去离子水,加入一定量的磷酸缓冲溶液(pH 6.6)和铁氰化钾溶液,50℃恒温水浴20m in,急速冷却后加入一定量的三氯乙酸,离心后取上清液加入氯化铁溶液常温反应5min后,用分光光度计读取吸光度值[7-8]。
1.4.2 DPPH自由基清除能力的测定 参照R Amarowicza和Hatano T[9]的测定方法。按表1方法加样,即取适量提取液样品溶于1m L甲醇中,待完全溶解后加入0.1mol/L的DPPH自由基甲醇溶液3m L,摇匀后于室温下避光反应30m in后于517nm比色。对照组以蒸馏水代替待测液作对比。样品对DPPH自由基的清除能力用下式计算,3次平行求清除率的平均值。
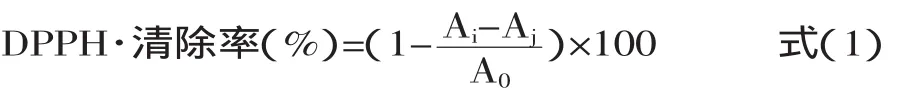
式中,A0—DPPH·与溶剂混合液的吸光度;Ai—DPPH·与样液反应后的吸光度;Aj—样液与溶剂混合液的吸光度。

表1 试剂和样液加样表Table 1 Add amountof sample and DPPH·
以样品质量浓度为横坐标,清除率为纵坐标,计算回归方程及样品的半抑制质量浓度(IC50)。
1.4.3 ABTS+自由基清除率的测定结果 参照Dorman H和Re R等[10-14]的测定方法。将7mmol/L的ABTS溶液与2.45mmol/L高硫酸钾K2S2O8混合后室温下避光反应16h,制备ABTS+自由基储备液,室温避光贮藏,备用。使用前用无水乙醇稀释该ABTS+自由基储备液,使其在734nm波长下吸光度为0.70±0.02,形成ABTS工作液。在30℃下,取3.0m L的ABTS工作液,并添加1m L适当浓度的蜂巢提取液,反应30min,在734nm波长下测定吸光度。每个浓度的样品平行操作3次。按照式(2)计算样品的ABTS+自由基的清除率。以样品质量浓度为横坐标,清除率为纵坐标,计算样品的ABTS+自由基清除率。
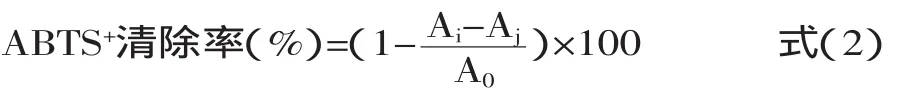
式中:A0—DPPH·与溶剂混合液的吸光,Ai—DPPH·与样液反应后的吸光度,Aj—样液与溶剂混合液的吸光度。

表2 试剂和样液加样表Table 2 Add amount of sample and DPPH·
1.4.4 超氧阴离子自由基(O2-·)清除率的测定 参考郭雪峰等方法进行测定[15-16]。量取pH为8.2的Tris-HCl缓冲液5m L,加入适量待测样品溶液,用双蒸水补充至9.7m L,置于10m L比色管中混匀,在25℃水浴条件下保温20m in,取出后立即加入在25℃预热过的3mmol/L邻苯三酚0.3m L,剧烈振荡以使其充分反应,9m in后于319nm波长处测定其吸光度值A。空白对照以10mmol/L HCl代替邻苯三酚的HCl溶液。
1.4.5 羟自由基(·OH)清除率的测定 精密量取3mmol/L FeSO41m L置10m L比色管中,加入3mmol/L邻菲罗啉1m L和一定浓度的蜂巢提取液0.4m L,再加入4mmol/L的H2O2溶液0.5m L,最后加去离子水至4m L,反应于37℃恒温水浴中进行,准确反应1.5h后,于536nm下测定吸光度值记为A1。按照上述方法,不添加FeSO4溶液、邻菲罗啉指示剂和H2O2溶液的记为A2,不添加蜂巢提取液,记为A3,对照组不添加蜂巢提取液和H2O2溶液,记为A0,以蒸馏水为空白参比。按下式计算样品对·OH的清除率[17]:

1.4.6 蜂巢提取液的油脂抗氧化研究 过氧化值(POV)的测定依据国标GB 5538-2005动植物油脂过氧化值测定方法的测定。葵花籽油,经测定其初始过氧化值为2.27mmol/kg。取15个250m L锥形瓶并各称取100g葵花籽油,分为5组,每组做3个平行实验。之后,将样品放于70℃恒温培养箱中加速氧化,每隔1d测其过氧化值变化。实验期间,注意要把样品搅拌均匀,并交换它们在恒温箱的位置,保证样品实验条件充分一致,以减小实验误差[18-20]。
1.5 实验数据的统计分析方法
通过Origin 7.5软件统计分析方法来比较BHT、蜂巢水提液和蜂巢乙醇提取液的抗氧化活性以及对油脂的抑制作用。
2 结果与分析
2.1 蜂巢提取液的成分鉴定
蜂巢水提液和蜂巢乙醇提取液的成分鉴定结果如图1、图2、表3、表4所示。蜂巢水提液中共鉴定出17种化合物,其中主要有2-丁酮(2.66%)、2,3-丁二酮(16.17%)、3-甲基-丁醇(2.14%)、2-乙基-己醇(8.91%)、苯甲醛(0.70%)、3-蒈烯(0.66%)、2-乙酸苯酯(0.20%)、苯乙醇(0.10%)等。蜂巢乙醇提取液共鉴定出17种化合物,其中主要有环氧丙烯(11.74%)、2,2-二甲甲氧基丙烷(4.14%)、1,6-庚二烯-3,5-二酮(1.17%)、邻苯二甲酸二乙酯(2.36%)、2-乙基-1,3-己二醇(0.65%)、N,N’-二甲基-1,2-乙二胺(0.78%)、十七烷酮(0.51%)、己二酸(18.77%)等。
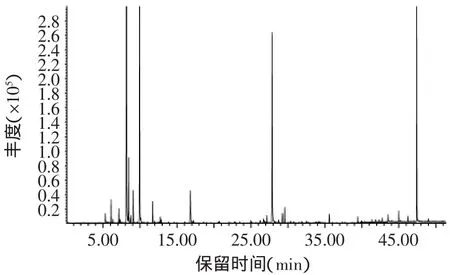
图1 蜂巢水提液的气质图谱Fig.1 The GC-MSof honeycomb water extractings
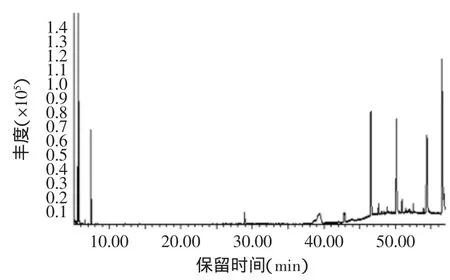
图2 GC-MS法测定蜂巢乙醇提取液的气质图谱Fig.2 The GC-MSof honeycomb ethanol extracting
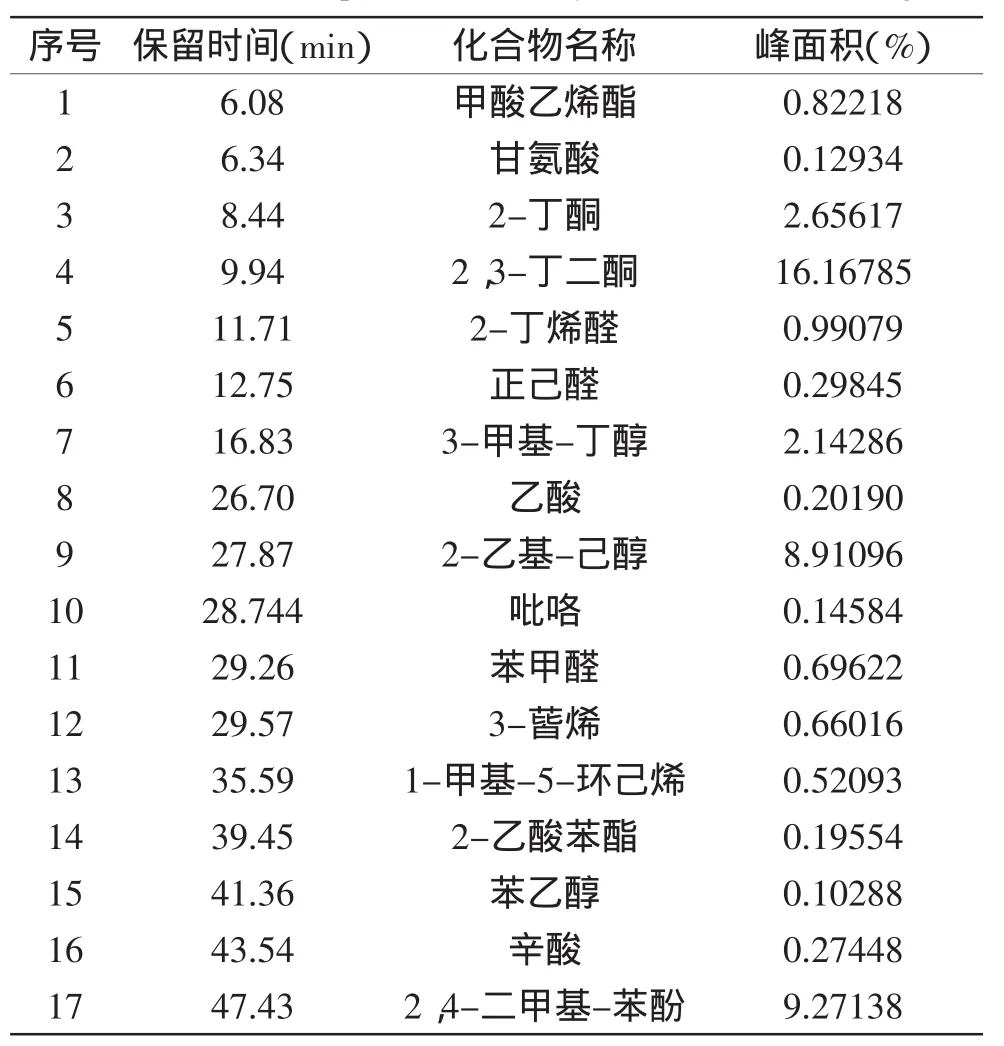
表3 GC-MS法测定蜂巢水提物中的挥发性成分Table 3 The components of honeycomb water extractings
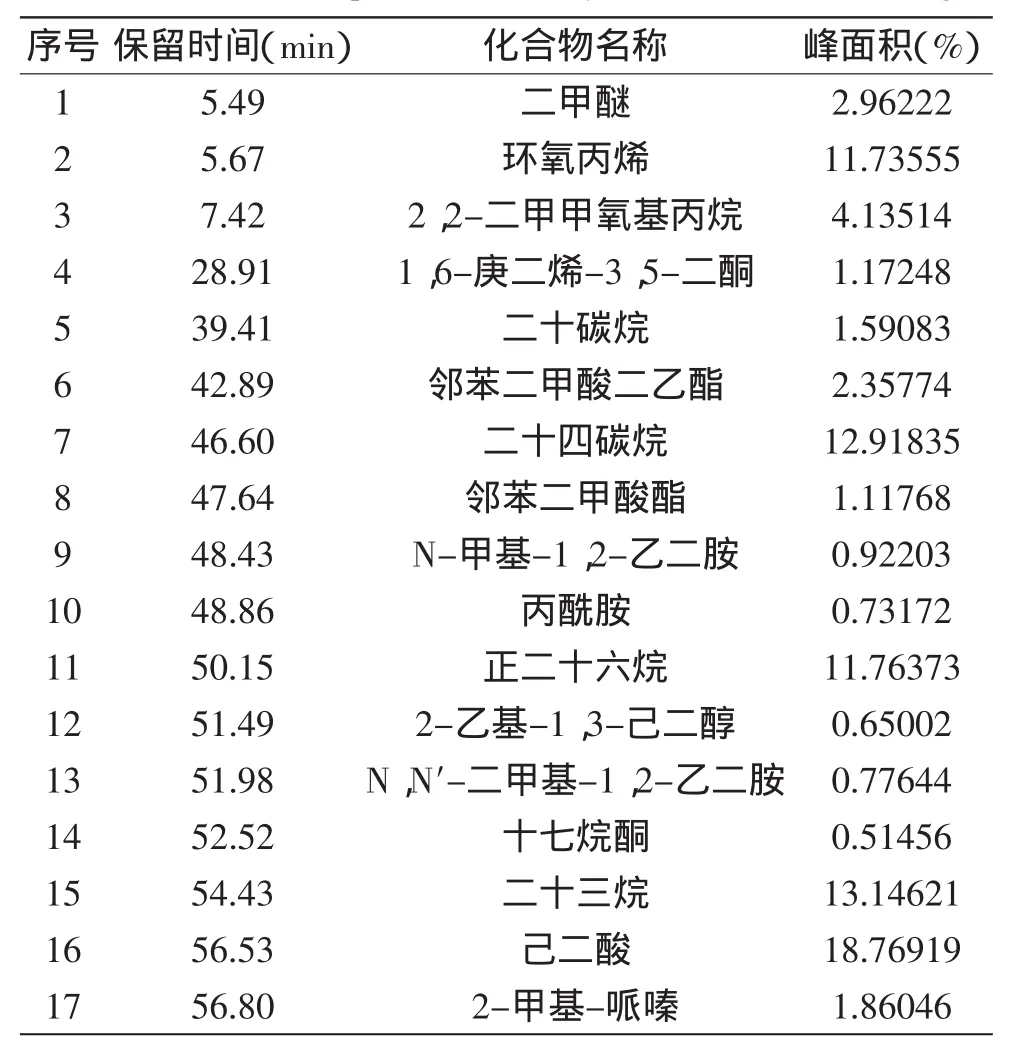
表4 GC-MS法测定蜂巢乙醇提取液中挥发性成分Table 4 The 4 components of honeycomb ethanol extractings
2.2 还原能力测定结果
蜂巢乙醇提取液、蜂巢水提液和合成抗氧化剂二甲基羟基甲苯(BHT)的还原能力测定结果如图3所示。由图3可以看出,蜂巢乙醇提取液、蜂巢水提液和BHT均具有较高的还原力,其中BHT的还原力最强,其次是蜂巢水提液,蜂巢乙醇提取液的还原力较弱。虽然BHT的还原能力较强,但BHT为化学合成添加剂,一般食物中,国标规定最大使用量为0.2g/kg(约0.19mg/m L)(GB 2760-2011),过量添加会引起食品安全问题。蜂巢水提液还原力虽然较弱,但是其来源于天然产物,安全无毒性,可以通过提高添加浓度达到与BHT相同的还原力。
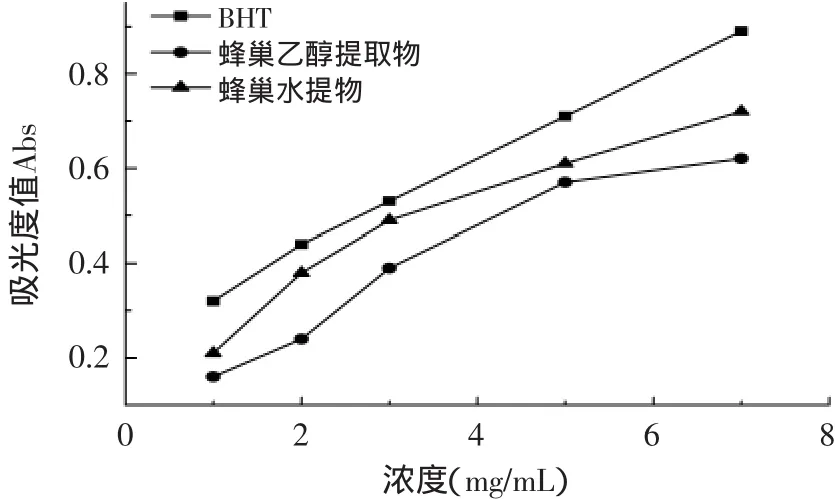
图3 蜂巢提取液的还原能力Fig.3 Deoxidization capability of honeycomb extracts
2.3 DPPH自由基清除率的测定结果
蜂巢乙醇提取液、蜂巢水提液和BHT的DPPH自由基清除能力测定结果如图4所示。由图4可以看出,两种蜂巢提取液对DPPH自由基有一定的清除能力,并且清除率与蜂巢提取液的质量浓度呈正相关性。随着蜂巢提取液浓度的升高,它们对DPPH自由基的清除率也逐渐增大,在各质量浓度下BHT对DPPH自由基的清除率要明显高于蜂巢水提液和蜂巢乙醇提取液。当浓度为4mg/m L时,BHT对DPPH自由基的清除率达到56.3%,而蜂巢水提液和蜂巢乙醇提取液的清除率仅为49.5%和45.7%。
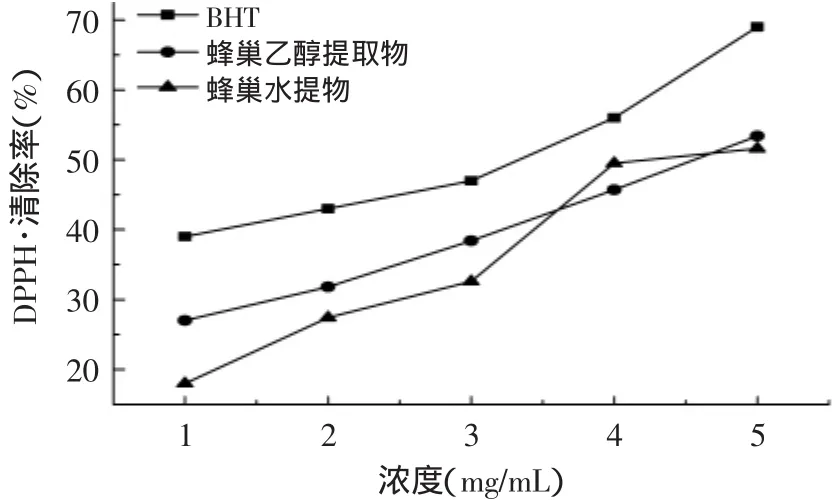
图4 不同浓度蜂巢提取液对DPPH自由基的清除能力Fig.4 Scavenging rate of honeycomb extracts on DPPH free radicals
2.4 ABTS+自由基清除率的测定结果
蜂巢乙醇提取液、蜂巢水提液和BHT对清除ABTS+自由基清除能力测定结果如图5所示。由图5可以看出,BHT的ABTS自由基清除能力最强,能够迅速的将ABTS+·氧化褪色,两种蜂巢提取液对ABTS+·均具有清除能力,且清除率与浓度呈正相关。随着蜂巢提取液浓度的升高,它们对ABTS+·的清除率逐渐增大,其中蜂巢水提物清除ABTS+·能力较强,当其质量浓度达到0.5mg/m L时,清除率达到97.3%,而乙醇提取液在浓度为0.5mg/m L时对ABTS+·的清除率仅为75.8%。

图5 不同浓度蜂巢提取液对ABTS+·清除率Fig.5 Scavenging rates of honeycomb extracts against ABTS free radicals
2.5 超氧阴离子清除率的测定结果
蜂巢乙醇提取液、蜂巢水提液和BHT对超氧阴离子的清除作用结果如图6所示。由图6可以看出,随着浓度的增加,超氧阴离子自由基的清除率均增大。BHT对超氧阴离子的清除作用最强。蜂巢乙醇提取液和蜂巢水提取液的超氧阴离子自由基的清除率基本相当。
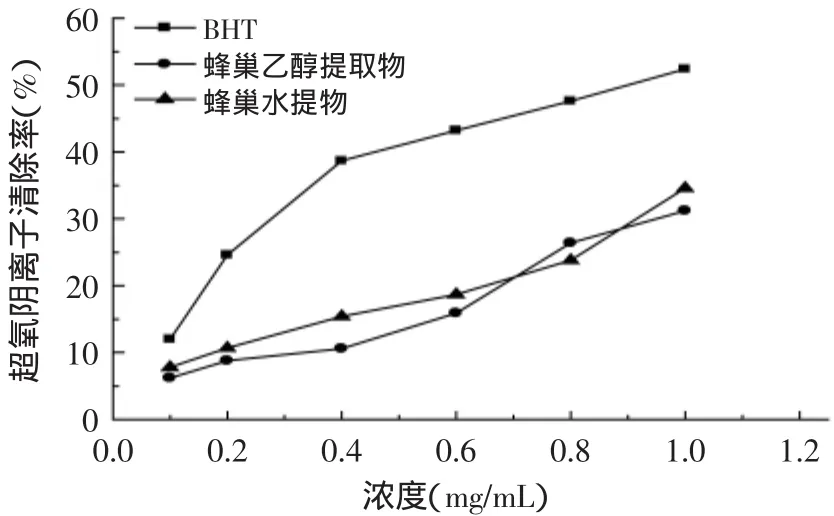
图6 蜂巢提取液对超氧阴离子自由基的清除作用Fig.6 The scavenging effectof honeycomb extracts on superoxide anion free radical
2.6 羟自由基清除率的测定结果
蜂巢乙醇提取液、蜂巢水提液和BHT对羟自由基清除作用的测定结果如图7所示。由图7可以看出,不同蜂巢提取液对羟基自由基清除作用的能力不同,随着浓度的增加清除活性都在升高。BHT对羟自由基清除作用最强,蜂巢水提液较强,蜂巢乙醇提取液对羟自由基清除作用最弱。
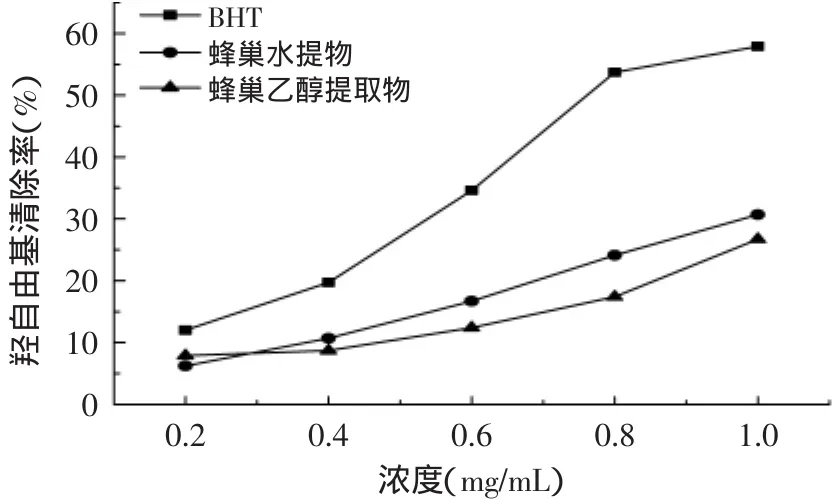
图7 蜂巢提取液对羟自由基的清除作用Fig.7 The scavenging effect of honeycomb on hydroxyl radical
2.7 对油脂过氧化的抑制作用
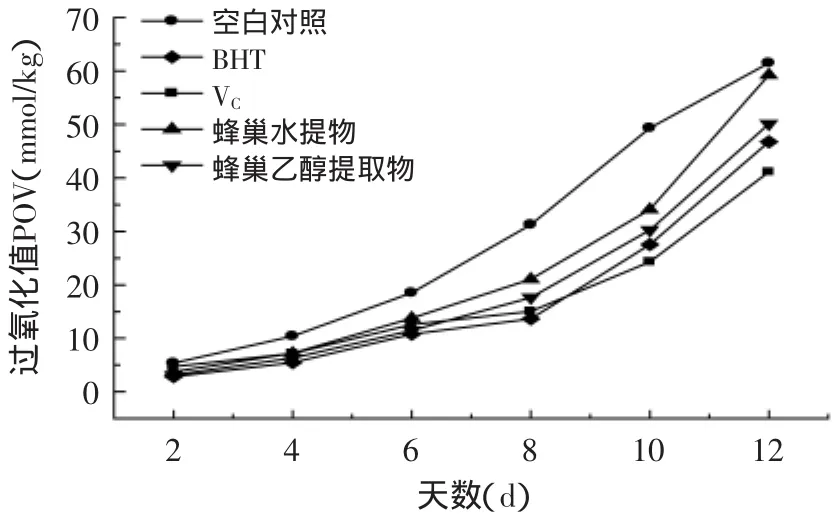
图8 蜂巢提取液对抑制油脂过氧化值的作用Fig.8 The scavenging effectof honeycomb on oil peroxide
蜂巢提取液对油脂过氧化的作用结果如图8所示。由图8可以看出,添加了抗氧化剂BHT和蜂巢提取液的葵花籽油的POV值远低于空白组,且呈缓慢平稳的增长趋势,这说明加入BHT和蜂巢提取液对油脂有很强的抗氧化作用,可以明显减缓油脂氧化。相对于对照组来说,其他各组都有一定的抑制油脂氧化作用。在前期(1~6d),各组的过氧化值差别不大,呈缓慢增长趋势;而到后期(6~12d),各组POV直线上升,增长快速,可见自由基反应快速。相对于BHT,蜂巢的提取液抗氧化效果要微弱一些,尤其是水提物,因为有很多物质难溶于油脂中,使得抗氧化效果差一些。乙醇提取液的效果最好,说明蜂巢提取液在抑制油脂氧化方面有一定作用。
3 结论
3.1 通过对蜂巢水提取液和乙醇提取液的气质(GC-MS)分析,分别鉴定出17种物质。蜂巢提取液中的起抗氧化作用的成分主要是黄酮类物质、有机酸类以及醇类化合物。
3.2 对蜂巢水提液、蜂巢乙醇提取液的还原能力、清除DPPH自由基、清除ABTS+自由基、超氧阴离子清除作用、羟自由基清除作用等抗氧化活性指标进行了分析。结果表明,蜂巢水提取液的抗氧化活性比蜂巢乙醇提取液的效果好,且两者的抗氧化活性均随着浓度的增加而增大。蜂巢水提液和蜂巢乙醇提取液的抗氧化活性较强,且安全无毒,因此具有代替BHT的可能性。蜂巢提取液对油脂过氧化的结果表明,蜂巢水提液和蜂巢乙醇提取液均对油脂有很强的抗氧化作用,后者优于前者,可以明显减缓油脂氧化。
[1]王林,王振斌,孙平,等.蜂巢黄酮的超声波辅助提取及其抗氧化活性研究[J].食品科技,2012,37(9):222-225.
[2]褚亚芳.蜜蜂巢脾杭氧化、抑菌和抗炎活性以及杭生素残留研究[D].杭州:浙江大学,2010.
[3]白凤梅,蔡同一.类黄酮生物活性及其机理的研究进展[J].食品科学,1998(8):11-13.
[4]张海生,陈锦屏.蜂蛹黄酮的提取及体外抗氧化作用的研究[J].食品科学,2008,29(2):158-162.
[5]Nagai T,SakaiM,Inoue R,et al.Antioxidative activities of some comercially honeys.royal jelly and propolis[J].Food Chemistry,2001,75(2):237-240.
[6]Ko M J.Subcriticalwater extraction of flavonol quercetin from onion skin[J].Journal of Food Engineering,2010,102(4):8-14.
[7]Tanaka M,Kuei C W,Nagashima Y.Application of antioxidative Maillard reaction products from histidine and glucose to sardine products[J].Nippon Suisan Gakkaish,1988,54(8):1409-1414.
[8]Kadriye IB,G Tor·Birsen,Demirata R A.Total antioxidant capacity assay using optimized Ferricyanide Prussian bluemethod [J].Food AnalMethods,2010(3):154-168.
[9]R Amarowicz,R B Pegg,PRahimi-Moghaddam.Free-radical scavenging capacity and antioxidant activity of selected plant species from the Canadian prairies[J].Food Chemistry 2004,84(4):551-562.
[10]Hatano T,Kagawa H,Yasuhara T,et al.Two new flavonoids and other constituents in licorice root:their relative astringency and radical scavenging effects[J].Chemical and Pharmaceutical Bulletin,1998,36:2090-2097.
[11]Dorman H,Hiltunen R,Fe(III)reductive and free radical scavenging properties of summer savory(Satureja hortensis L.)extractand subfractions[J].Food Chemistry,2004,88(2):193-199.
[12]Re R,Pellegrini N,Proteggente A,et al.Antioxidant activity applying an improved ABTS radical cation decolorization assay [J].Free Radieal Biology and Medieine,1999,26(9-10):1231-1237.
[13]韩光亮,李翠梅,Cacace E,等.改良的ABTS法及其在优化抗氧化活物质提取中的应用[J].卫生研究,2004,33(5):620-623.
[14]唐丽丽.石榴皮多酚类物质的提取、纯化及抗氧化性研究[D].咸阳:西北农林科技大学,2010.
[15]郭雪峰,岳永德,汤锋,等.用清除超氧阴离子自由基法评价竹叶提取液抗氧化能力[J].光谱学与光谱分析,2008,28(8):1823-1826.
[16]张娅,李宝才,项朋志,等.松茸多糖超声提取液抗氧化活性研究[J].化学与生物工程,2011,28(9):75-82.
[17]朱玉昌.橙汁抗氧化活性成分及总抗氧化能力的研究[D].重庆:西南大学,2006.
[18]汤务霞,陈明涛,阙晓莉.抗氧化剂BHT和维生素E对菜籽油的抗氧化研究[J].中国食品添加剂,2011(3):59-62.
[19]郑晶泉.抗氧化剂抗氧化实验研究进展[J].国外医学:卫生学分册,2000,27(1):37-40.
[20]周向军,高义霞,李娟娟.乳苣多酚提取工艺及抗氧化研究[J].中国酿造,2011(9):118-121.
Identification com pounds and antioxidant activities of honeycomb polyphenolextracts
WANG Zhen-bin,SHAO Shu-ping,SUN Ping
(School of Food and Biological Engineering,Jiangsu University,Zhenjiang 212013,China)
The compounds of aqueous extrac ts and ethanol extracts from honeycomb were identified and the antioxidant activity was studied.By GC-MS techniques,17 com pounds of two extrac ts were analysised respectively.And the totalantioxidant capacity,c learing DPPH·,OH·,ABTS+·and O2-·free radicalof two kinds of extracts were com pared,the results showed that aqueous extracts and ethanol extracts both had strong antioxidant activities,as well as synthetic chem ical antioxidants BHT,the antioxidant activities increased w ith polyphenol concentration,when the concentration of polyphenol reached a certain value,the c learing rate was almost constant and the aqueous extracts’s antioxidant ac tivities was better than ethanol extracts’,which suggested that the honeycomb polyphenol extracts was an excellent natural antioxidant and free rad icals scavenger.
honeycomb;com pound;antioxidantactivity
TS201.1
A
1002-0306(2014)18-0123-05
10.13386/j.issn1002-0306.2014.18.017
2013-12-03
王振斌(1975-),男,博士,副教授,研究方向:生物质能源工程,天然产物分离及应用。
国家星火计划(2011GA690057);镇江市科技支撑项目(NY201010)。
