广东鲂幼鱼对铜、镉胁迫的氧化应激响应及其指示意义
2014-02-25曾艳艺赖子尼杨婉玲高原王超刘乾甫张威振赵李娜
曾艳艺,赖子尼,杨婉玲,高原,王超,刘乾甫,张威振,赵李娜
广东鲂幼鱼对铜、镉胁迫的氧化应激响应及其指示意义
曾艳艺,赖子尼*,杨婉玲,高原,王超,刘乾甫,张威振,赵李娜
中国水产科学研究院珠江水产研究所,珠江流域渔业生态环境监测中心,珠江水域渔业生态环境监测与评价功能实验室,农业部珠江中下游渔业资源环境科学观测实验站,广东 广州,510380
广东鲂(Megalobrama terminalis)是具重要经济价值的珠江流域特有鱼类,已列入国家级水产种质资源保护品种。近年来,随着河流固有生境持续破坏,重金属等水体污染问题不断加剧,以广东鲂为代表的当地特有鱼类资源急剧下降。文章以铜、镉暴露对广东鲂幼鱼48 h的半致死浓度值LC50暴露浓度强度为1个毒性单位(TU)为基准,以室内静水实验法研究了铜、镉离子在低效应浓度、中效应浓度、高效应浓度(分别对应于0.01 TU、0.03 TU和0.11 TU)胁迫对广东鲂幼鱼的氧化应激效应,以期找出适宜的生物标记物,完善珠江水域污染评价与预警体系。结果显示,广东鲂幼鱼MDA、GSH、T-AOC、SOD和CAT(以Pr计)随暴露浓度及暴露时间发生变化,其范围分别在1.08~7.34 nmol·mg-1、0.42~22.82 mg·g-1、0.10~1.32 U·mg-1、2.45~13.24 U·mg-1和0.01~0.09 U·mg-1之间。其中,GSH、MDA和T-AOC在铜、镉暴露后第1天迅速响应至高值,相应的各浓度处理组明显高于对照组。曲线回归结果显示,GSH与暴露浓度c(以TU量计)之间呈显著的二次曲线关系,拟合方程为GSH=-2112(c-0.084)2+18.1,r=0.847,n=10,P=0.012,暴露浓度阈值为0.084 TU。SOD和CAT则在暴露后第4天响应至高值。曲线回归结果显示,SOD与c及CAT与c之间均呈显著的二次曲线关系,拟合方程分别为SOD=-2073(c-0.059)2+14.3,r=0.840,n=10,P=0.014;CAT=-21.2(c-0.056)2+0.102,r=0.877,n=10,P=0.006,相应的暴露浓度阈值分别为0.059 TU和0.056 TU。与暴露浓度呈显著的二次曲线关系的各指标中,GSH响应最为迅速,SOD和CAT的响应最为灵敏,加之SOD与CAT相关性极强,表明GSH、SOD和CAT这3种氧化应激指标可作为珠江流域水体污染的潜在生物标记物。
广东鲂;重金属;氧化应激;毒性单位;生物标记物
1 材料与方法
1.1实验材料
广东鲂生活在水体中下层,喜栖息于江河底质多淤泥或石砾的缓流处;以水生植物及软体动物为食。自然种群的成鱼在每年的3─4月间产卵,仔、幼鱼以浮游生物为食,人工养殖幼鱼可以人工饲料等为食。本次实验广东鲂幼鱼购自广州市吉鲳水产鱼苗繁殖基地,以曝气2 d以上的自来水在实验室内暂养以供实验。鱼苗平均体长2.5±0.2 cm,体重0.35±0.07 g。在室内自然光照下暂养,水体pH7.6~7.8,水温26~28 ℃,硬度126~138 mg(CaCO3)·L-1,溶解氧7.20~7.85 mg·L-1。暂养条件下鱼苗自然死亡率<2%,实验前1 d停止喂食。
1.2试剂药品
药品CuSO4·5H2O、CdCl2·2.5H2O和NaCl2均为分析纯。先分别以去离子水配制浓度为1 g·L-1(均为离子质量浓度,下同)的铜、镉贮备液浓度,实验时以预先经过曝气48 h的自来水配成所需的实验浓度。
1.3毒性单位确定及实验设置
以48 h致半数广东鲂死亡的暴露浓度(48 h LC50)为1个毒性单位,金属暴露浓度以计量单位TU表示。根据等毒性法设置低、中、高3个浓度效应组的铜、镉单一亚急性毒性及联合毒性胁迫广东鲂幼鱼实验,其中联合毒性以1∶1毒性单位配比法设置。预先对该批广东鲂幼鱼进行单一铜、镉48 h急性毒性实验,得出铜的48 h LC50及其95%置信区间为0.8(0.6~1.0)mg·L-1,镉的48 h LC50及其95%置信区间为1.4(1.2~1.7)mg·L-1。依据渔业水质标准(GB11607-89)中相应浓度限值(铜为0.01 mg·L-1;镉为0.005 mg·L-1),该标准是基于多种水生标准测试生物毒性结果制定的安全浓度值,理论上其毒性单位为1% LC50,可认为这两个浓度值对广东鲂的毒性单位数相等,为0.01 TU,故由此确定低铜、镉浓度组;中、高暴露浓度组则根据铜、镉单独暴露对广东鲂48 h LC50的1/30和1/9设置,铜、镉的联合胁迫组以铜、镉各贡献一半毒性单位数的配比方式分别设置低、中、高效应浓度值,故低、中、高暴露浓度分别为0.01 TU、0.03 TU和0.11 TU,各组浓度的配制如表1所示。
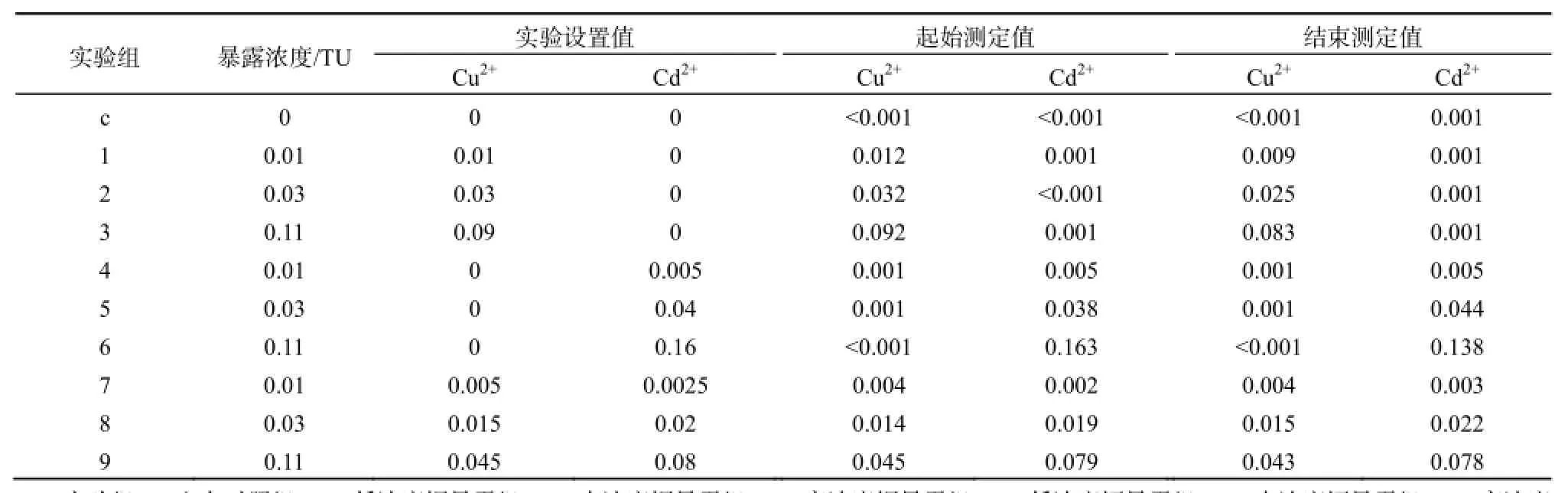
表1 广东鲂幼鱼暴露浓度(TU)设置及实验始末铜、镉质量浓度Table 1 The nominal toxic concentrations (TU) and the determined concentrations of Cu and Cd at the initial and the end of toxic experiment on juvenile M. terminalis mg·L-1
1.4实验过程
由于鱼样品氧化应激指标的测定可能受检测过程中的处理温度和指标分析时限影响较大,因此在实验中分预实验和正式实验进行。预实验的目的是为了确定样品的组内个体差异值范围,分别在玻璃缸中仅以所设的3个中浓度组,实验组2、5和8(见表1)配制体积为20 L的水体,每个浓度的缸
里放入30尾实验鱼,静置实验。分别在实验第1、4和7天从每个缸里取5尾鱼,每尾鱼分别进行蛋白质(protein,Pr)含量、超氧化物歧化酶(superoxide dismutase,SOD)和过氧化氢酶(catalase,CAT)活性、总抗氧化能力(total antioxidant capacity,T-AOC)、谷胱甘肽(glutathione,GSH)和丙二醛(malondialdehyde,MDA)含量等氧化应激指标分析。结果确定了每组样品所测指标的个体之间的差异<10%(n=5)。
正式实验时,在水体体积为10 L的玻璃养殖系统中进行。每个实验组放入10尾广东鲂幼鱼,静置实验。实验期间不投饵、不充气,自然光照,水体理化指标保持与暂养条件相同。正式实验开始后,分别在第1、4、7和14天分别从各处理组中取出2尾鱼,用超纯水冲洗后吸干,将样品存放于-20 ℃超低温冰箱,并在2 h内匀浆,匀浆样品4 ℃保存以待各氧化应激指标分析,其中,CAT、GSH和T-AOC在4 h内分析完毕,SOD和MDA在6 h内分析完毕。此外,在实验初始及实验结束时分别从各处理组取上层水样,以石墨炉原子吸收分光光度法测定其中铜、镉浓度。根据渔业水质标准(GB11607-89)规定的方法利用Agilent AA DUO原子吸收光谱仪测定。
1.5样品的处理
全鱼样品去鳍后(每尾质量约0.3 g)放入小烧杯,以质量体积比约为1∶9的比例先加入0.86%冰冷生理盐水2/3,用洁净小剪迅速将鱼体剪碎成小组织块,将剪碎的组织与生理盐水混合液倒入玻璃匀浆器,再加入余下的1/3生理盐水润洗小烧杯将组织液全量转移至玻璃匀浆器,在冰上研磨5~8 min使组织匀浆化,制成10%左右的匀浆液。将制好的匀浆转移至洁净离心管,在4 ℃、3000 r·min-1离心10 min,弃沉淀留上清液保存在4 ℃,以待进行以下各氧化应激指标测定。
1.6氧化应激指标的测定
Pr含量、T-AOC、SOD、CAT活性及GSH和MDA含量是利用购自南京建成生物工程研究所的试剂盒,结合紫外可见分光光度计测定。其中,Pr测定采用考马斯亮蓝法,用小牛血清蛋白做标准曲线;采用黄嘌呤氧化酶法测定SOD活力,每毫克蛋白在1 ml反应液中SOD抑制率达50%时所对应的SOD量,为1个SOD活力单位;采用H2O2分解法测CAT,每毫克蛋白中CAT每秒钟分解吸光度为0.50~0.55的底物中的H2O2相对量,为一个CAT活力单位;T-AOC采用Fe3+还原法测定,37 ℃时,每分钟每毫克组织蛋白使反应体系的吸光度值每增加0.01时为一个T-AOC单位;采用二硫代二硝基苯甲酸法测定GSH含量,以Pr计,单位为mg·g-1;采用硫代巴比妥酸法(TBA)测定丙二醛(MDA)含量,以Pr计,其单位为nmol·mg-1。各指标的测定步骤参照南京建成生物公司的试剂盒说明书。
1.7数据分析
采用K-S检验确定各变量利用单因素方差分析(ANOVA)和Duncan多重比较不同暴露时间各响应指标之间的均值差异;经K-S检验确定各变量服从正态分布后,利用Excell软件对铜、镉胁迫下广东鲂幼鱼氧化应激效应进行毒性单位与效应关系分析并作图;利用成对样本t检验法分析低、中和高浓度铜、镉单一因子和联合处理组对广东鲂幼鱼的氧化应激效应差异;采用相关分析判别广东鲂幼鱼各响应指标之间的相关性。除特别注明外,统计分析均在SPSS16.0 for Windows下进行。
2 结果
实验期间广东鲂幼鱼无死亡。实验初始和实验结束时各实验组中铜、镉浓度如表1所示,期间铜、镉浓度测定值与实验设定值误差(<20%),在允许范围内。
2.1铜、镉胁迫下广东鲂幼鱼氧化应激指标随暴露时间的变化
广东鲂幼鱼各氧化应激指标随实验暴露时间的变化如表2所示。正式实验期间所有处理组MDA含量(以Pr计,下同)在1.08~7.34 nmol·mg-1之间。暴露第1天后即达高值,显著高于第4、7、14天(df=3,F=38.60,P<0.001),且各处理组明显高于对照组;其后,随暴露时间的延长而下降,并保持相对恒定,且各处理组并未明显高于对照组。意味着广东鲂受亚急性铜、镉浓度暴露后,很快表现出氧化损伤,但随着机体启动抗氧化防御系统后,氧化损伤程度有所下降。
GSH含量(以Pr计,下同)变化较大,在0.42~22.82 mg·g-1之间。其中暴露第1天后迅速至高值,显著高于第4、7、14天(df=3,F=31.99,P<0.001),各处理组亦明显高于对照组,其后均随暴露时间的延长而下降,并保持相对恒定,且各处理组并未明显高于对照组。这意味着广东鲂受亚急性铜、镉浓度暴露后,随着体内氧化压力的产生,机体首先启动以GSH为代表的第一道抗氧化防御防线来清除氧自由基,GSH含量迅速增加,但随着暴露时间的延长,对GSH消耗增加,GSH含量很快降低。
T-AOC是机体总抗氧化压力的指标,T-AOC活力(以Pr计,下同)在0.10~1.32 U·mg-1之间变化,亦是暴露第1天达高值,显著高于第4、7、14
天(df=3,F=22.02,P<0.001),且各处理组明显高于对照组,随后第4、7天逐渐下降,而在第14天又有所回升,但除第1天外,其余时间显示各处理组并未明显高于对照组。
SOD活性(以Pr计,下同)在2.45~13.24 U·mg-1之间变动,随着暴露时间的延长,SOD活性在第4天显著高于其余时间(df=3,F=67.64,P<0.001),且仅在第4天铜、镉不同浓度暴露胁迫组与对照组的SOD水平差异较大,其它时间差异不明显。
CAT活性(以Pr计,下同)变化范围为0.01~0.09 U·mg-1,其与SOD活性变化趋势相似,亦在第4天显著高于其他时间(df=3,F=24.81,P<0.001)。CAT活性亦是在第4天时不同铜、镉浓度处理组明显高于对照组,而在其他时间处理组与对照组的差异不明显。
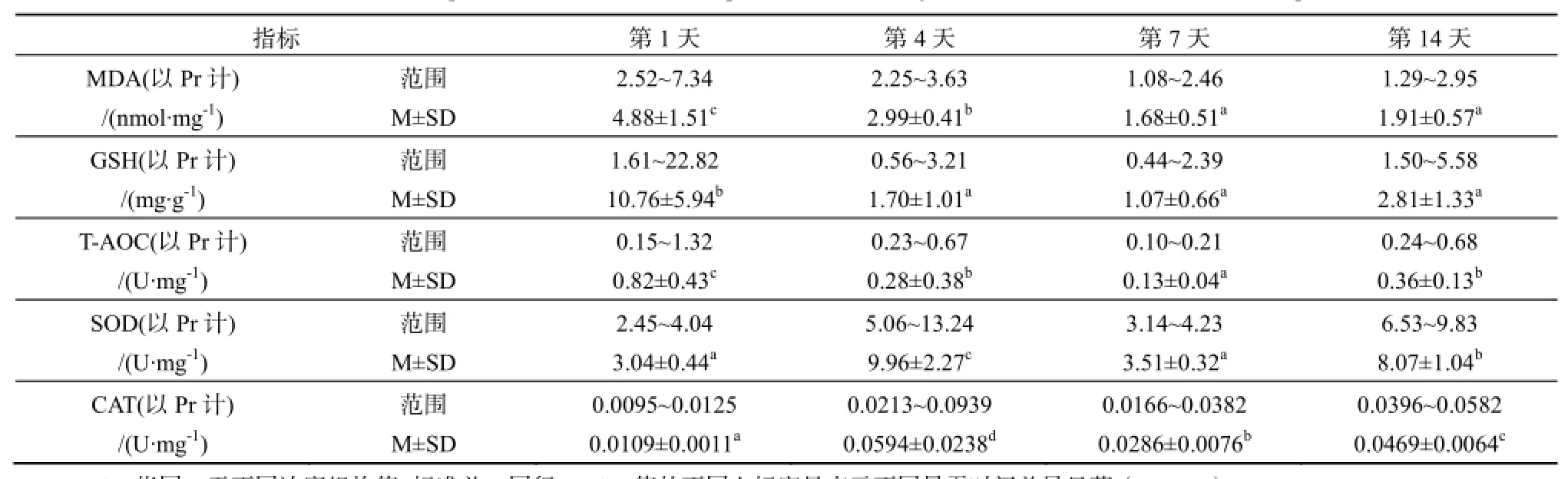
表2 广东鲂幼鱼各氧化应激指标随实验暴露时间的变化响应统计描述Table 2 Statistic description of time-variation of response substances in juvenile M. terminalis to Cu2+, Cd2+exposure
2.2铜、镉胁迫对广东鲂氧化应激响应的剂量—效应关系
实验第1天时GSH、T-AOC和MDA达高值,且各处理组与对照组之间存在明显的差异,故对铜、镉胁迫下第1天的GSH、T-AOC和MDA响应值与暴露浓度(以TU计)进行剂量—效应关系分析,曲线回归分析结果如图1所示。曲线关系式表示为y=A(c-B)2+C,其中y为各氧化应激响应指标,A为系数,c为暴露浓度(以TU计),B为相应氧化应激响应指标达到最大时对应的暴露浓度,C为相应氧化应激指标的最大值(下同)。广东鲂幼鱼GSH与暴露浓度之间呈显著(P<0.05)的二次曲线关系(P=0.012),且在暴露浓度为0.084 TU时GSH含量最高,对应于铜、镉单一因子暴露的浓度分别为0.067、0.118 mg·L-1,对应的联合暴露浓度为0.034 mg·L-1铜与0.059 mg·L-1镉。尽管T-AOC和MDA与暴露浓度呈一定的二次曲线关系,但在统计学上不显著(P>0.05)。
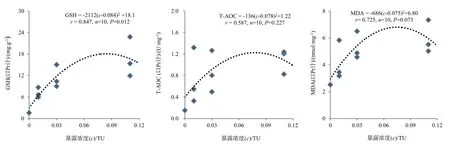
图1 铜、镉暴露浓度与广东鲂幼鱼GSH、T-AOC、MDA水平的剂量—效应关系Fig. 1 The concentration-effect relationships between GSH , T-AOC, MDA levels in juvenile M. terminalis and Cu2+, Cd2+exposure concentrations
实验第4天时SOD和CAT达到最大,且各处理组与对照组之间存在明显的差异,从而对铜、镉胁迫下第4天的SOD、CAT活性与铜、镉暴露浓度(以TU计)进行剂量—效应回归分析,结果如图2所示。广东鲂幼鱼SOD和CAT活性与暴露浓度呈显著(P<0.05)的二次曲线关系,P值分别为0.014和0.006;SOD在暴露浓度为0.059 TU时达到最大,对应的铜、镉单一因子暴露浓度分别为0.047和0.082 mg·L-1,对应的联合暴露浓度为0.024 mg·L-1
铜与0.041 mg·L-1镉。CAT在暴露浓度为0.056 TU时达到最大,对应的铜、镉单一因子暴露浓度分别为0.045和0.078 mg·L-1,对应的联合暴露浓度为0.022 mg·L-1铜与0.039 mg·L-1镉。
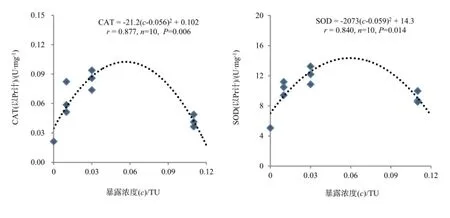
图2 铜、镉暴露浓度与广东鲂幼鱼CAT、SOD活性的剂量—响应关系Fig. 2 The concentration-effect relationships between CAT, SOD activities in juvenile M. terminalis and Cu2+, Cd2+exposure concentrations
2.3铜和镉胁迫对广东鲂幼鱼氧化应激响应的联合效应
进行成对样本t检验前,分别求铜、镉单一因子低、中和高浓度毒性胁迫下的SOD、CAT活性、T-AOC及GSH和MDA均值(如低浓度组的SODa计算公式为:SODa=1/2(SOD1+SOD4),其中1和4为实验组号,见表1),连同对应的铜和镉联合处理组低、中、高浓度组各指标(如低浓度组SODd=SOD7)进行各单独变量K-S检验,各变量均服从正态分布(n=12,P>0.05)。进而对相应的单一铜、镉低、中、高浓度暴露组各指标均值与联合处理组各指标实测值进行成对样本t检验,结果如表3所示。尽管各变量在单一毒性均值与联合毒性实测值虽有差异,但检验的P值均大于0.05。意味着铜、镉联合胁迫与铜、镉单独作用效应差异无显著的统计学意义,即铜、镉对广东鲂幼鱼的氧化毒性及抗氧化防御响应可能是协同或弱协同作用,拮抗和增强作用均不显著。
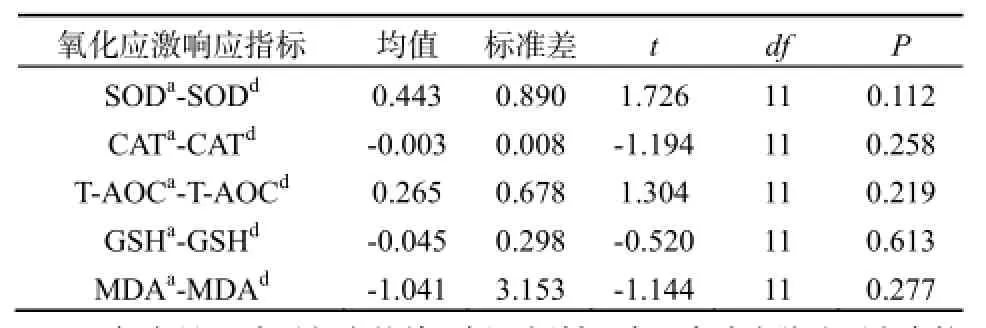
表3 铜、镉单一因子和联合毒性胁迫下广东鲂幼鱼氧化应激响应指标成对样本t检验结果Table 3 The results of paired-sample T test on oxidative stress and responses of juvenile M.terminalis to single and combined exposure of Cu2+and Cd2+
2.4铜、镉胁迫下广东鲂幼鱼氧化应激响应指标之间的关系
由于各指标值不完全服从正态分布,其两两间采用Spearman相关分析,结果如表4所示:广东鲂幼鱼SOD与CAT活性呈极显著的正相关关系,但SOD与其它3个指标无显著的相关性;MDA含量与T-AOC、GSH含量亦呈极显著的正相关关系,同时T-AOC与GSH含量亦呈极显著的正相关关系;但CAT活性与MDA和GSH含量存在显著的负相关关系,而其它指标两两之间的线性关系不显著。
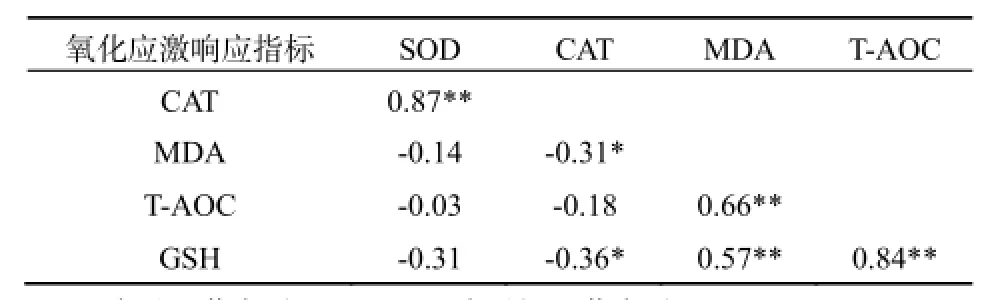
表4 铜、镉胁迫下广东鲂幼鱼氧化应激指标两两间的Spearman相关系数Table 4 Spearman correlation coefficients of MDA, GSH, SOD, CAT and T-AOC of juvenile M. terminalis to Cu2+, Cd2+exposure
3 讨论
重金属胁迫下,鱼类往往会产生不同程度的氧化应激响应,这时机体活性氧自由基增多,超出自身清除能力,导致机体氧化和抗氧化系统失衡,表现在其维生素C、维生素E、GSH等非酶抗氧化产物,SOD、CAT等抗氧化酶等被诱导或消耗(Martinez-Alvarez等,2005)。此时,机体往往伴随着不同程度的脂质过氧化损伤,MDA是机体内ROS攻击生物膜中的多不饱和脂肪酸形成的脂质过氧化物,MDA的量可反映机体内脂质过氧化的程度,间接地反映出机体氧化损伤的程度(Guel等,2004)。
现阶段的研究表明,鱼类氧化应激响应在鱼的不同种类中呈现特定的时间变化趋势(Srikanth等,
2013)。一般情况下,鱼体率先利用维生素C、维生素E、GSH等小分子非酶抗氧化产物清除过多的ROS,构成鱼类抗氧化防御的第一道防线,当这些非酶抗氧化产物不足以清除过多的ROS时,鱼体则启动合成抗氧化酶以减少超负荷的氧化压力,达动态平衡(Martinez-Alvarez等,2005)。本研究中广东鲂幼鱼暴露于亚急性铜、镉后第1天,其GSH含量快速增加,MDA水平也快速增加,表明在亚急性铜、镉胁迫下广东鲂幼鱼较快产生氧化压力,而机体也快速启动第一道防线;此外,广东鲂幼鱼的总抗氧化能力T-AOC也在第1天快速增加亦可作为广东鲂幼鱼机体快速启动抗氧化防御的佐证。随着暴露时间的延长,GSH的消耗量增大,因此广东鲂幼鱼体内的GSH水平迅速降低,相反SOD、CAT酶等活性增强(在第4天最强),此后的14 d内,广东鲂的氧化压力与抗氧化防御响应达到较稳定的动态平衡状态,氧化损伤与各抗氧化应激指标均有所下降(如表2所示)。而Pandey等(2008)对翠鳢(Channa punctate)的研究发现,在重金属暴露30 d之间,翠鳢的SOD和GSH含量呈下降趋势,CAT也在暴露7 d后开始下降。另外,砷对翠鳢的90 d胁迫研究显示了GSH的波动变化特征,暴露前7 d,GSH含量增加,而到第60天则下降,到第90天时又有所恢复(Allen和Rana,2004)。然而,短期(96 h)急性铜暴露(5.5 mg·L-1Cu)致使长须鱼丹(Esomus danricus)抗氧化防御机制受损,表现在SOD和CAT在暴露期间持续下降,MDA水平持续增加(Vutukuru等,2006)。可见,鱼类种类、暴露金属种类、暴露方式等差异均可致使鱼体内氧化应激响应的差异。因此,在利用鱼类的氧化应激响应指标作为重金属污染的生物标记物前,应尽可能均一化毒物浓度,掌握该生物标记物的动态变化规律,排除其他影响因素的干扰。
氧化应激指标作为污染生物标记物的另一重要前提条件是:其诱导需与污染暴露剂量存在特定的剂量—响应关系。本研究中,在亚急性铜、镉暴露下广东鲂幼鱼最敏感时期的氧化应激响应与暴露浓度之间符合二次曲线关系,这与以往报道镉暴露下鲢组织中SOD中的抛物线关系一致(吕景才等,2002),而二次曲线顶点所对应的暴露浓度值可被认为是鱼体对重金属污染从适应到中毒反应的阈值,低于该阈值时的金属暴露是鱼体适应性反应,而高于阈值时的抑制作用可能是中毒反应的前兆。尽管广东鲂各氧化应激指标最高时对应的中毒反应阈值有些微差异,但各氧化应激响应指标中,又属SOD和CAT活性最为灵敏,这两者分别在暴露浓度为0.056 TU和0.059 TU时达最高值,小于该暴露浓度阈值的铜、镉重金属暴露均会随着暴露浓度的增加,SOD和CAT响应值增加,而我国现有的渔业水质标准(GB11607-89)对铜、镉规定的暴露浓度之和为0.02 TU,位于本研究的响应指标中毒阈值以内,理论上SOD和CAT水平可作为污染程度的指示。而GSH则响应最为迅速,暴露第1天后即迅速响应。因此,对于重金属铜、镉暴露而言,广东鲂幼鱼机体GSH属于快速响应生物标记物,而SOD和CAT属于灵敏响应标记物。
广东鲂幼鱼在铜、镉胁迫下的氧化应激响应之间存在密切的关系(如表3所示)。其中,SOD与CAT活性之间相关性最强,相关系数高达0.87(n=40),这极可能与氧化压力下SOD和CAT的催化作用机制有关。当抗氧化底物缺乏时,鱼体内SOD结合CAT共同构成了机体应对氧化压力的另一道防线,通常情况下CAT活性的增强或减弱会和SOD保持一致,因为这两种酶互相协作,同步反应(Asagba等,2008)。其中,SOD的抗氧化防御是将超氧阴离子自由基(O2˙-)歧化为O2和H2O2,CAT则进一步催化H2O2转化成H2O和O2,从而在一定程度上阻止氧化损伤的发生,维持机体氧化与抗氧化防御动态平衡(Roméo等,2000)。这在对其他种类如叉尾鮰(Wallago attu)(Pandey等,2003),尖齿胡鲶(Clarias gariepinus)(Asagba等,2008)、奥尼罗非(Oreochromis niloticus)(Atli等,2006)的研究中亦得到验证。然而,另一些研究则发现CAT的诱导或是抑制与SOD并不同步(Sampain等,2008),这可能与机体应对氧化压力产生的CAT巯基易被金属结合后失活的速度和效率差异有关(Kono和Fridovich,1982)。此外,T-AOC与GSH含量的相关系数亦高达0.84,这意味着对广东鲂而言,GSH在其总抗氧化活力当中发挥重要的作用,因此GSH含量的变化决定着其T-AOC变化趋势。T-AOC是机体总的抗氧化能力的指标,包括GSH及GSH以外的酶促和非酶促抗氧化体系产物的总抗氧化能力。GSH是由谷氨酸、甘氨酸和半胱氨酸组成的一种三肽,是组织中主要的非蛋白的巯基化合物。它可以清除细胞内的O2˙-、H2O2、LOOH等自由基(Srikanth等,2013)。GSH含量迅速升高是广东鲂应对重金属产生ROS的胁迫的一种快速自我保护机制。广东鲂幼鱼在亚急性铜、镉胁迫下应激指标的正、负相关性则反映出机体应对氧化胁迫的相互依赖或代偿作用的动态变化。
本研究中铜、镉联合暴露对广东鲂幼鱼的胁迫作用效果表明了他们之间潜在协同作用的方式,而Roméo等(2000)的研究则表明铜、镉胁迫下欧洲鲈(Dicentrarchus labrax)的抗氧化压力响应不同。
今后可通过广东鲂幼鱼组织、器官的响应研究进一步验证并阐明铜、镉对广东鲂幼鱼的联合作用方式及其作用机制。
4 结论
本文探讨了珠江流域特有鱼类广东鲂幼鱼在应对水体亚急性铜、镉胁迫时的机体氧化应激响应。GSH对铜、镉暴露则在第1天后即迅速响应至高值,SOD与CAT则在暴露第4天显示高值。GSH、SOD和CAT被诱导至高值期间与重金属铜、镉暴露浓度呈显著的二次曲线关系。其中,SOD与CAT则在暴露浓度为0.05~0.06 TU时即灵敏响应,且SOD与CAT之间具强相关性,可作为水体污染的潜在生物标记物。
但广东鲂幼鱼的氧化应激响应随胁迫时间的动态变化较大,故在将其应用于自然环境中重金属污染的指示前仍需开展进一步研究,尤其在各种重金属联合毒性作用方式,及以毒性单位均一化法确定毒物暴露浓度与响应指标之间的剂量—效应关系及其影响因素方面的研究需要进一步深入。
致谢:
衷心感谢中科院南海海洋研究所张黎研究员对本文英文摘要的润色。
ALLEN T, RANA S. 2004. Effect of arsenic (AsIII) on glutathione-dependent enzymes in liver and kidney of the freshwater fish Channa punctatus [J].Biological Trace Element Research, 100(1): 39-48.
ASAGBA S O, ERIYAMREMU G E, IGBERAESE M E. 2008. Bioaccumulation of cadmium and its biochemical effect on selected tissues of the catfish (Clarias gariepinus) [J]. Fish Physiology and Biochemistry, 34(1): 61-69.
ATLI G and CANLI M. 2010. Response of antioxidant system of freshwater fish Oreochromis niloticus to acute and chronic metal (Cd, Cu, Cr, Zn, Fe) exposures [J]. Ecotoxicology and Environmental Safety, 73(8): 1884-1889.
ATLI G, ALPTEKIN O, TÜKEL S, et al. 2006. Response of catalase activity to Ag+, Cd2+, Cr6+, Cu2+and Zn2+in five tissues of freshwater fish Oreochromis niloticus [J]. Comparative Biochemistry and Physiology, Part C: Toxicology and Pharmacology, 143(2): 218-224.
GIARI L, MANERA M, SIMONI E, et al. 2007. Cellular alterations in different organs of European sea bass Dicentrarchus labrax (L.) exposed to cadmium [J]. Chemosphere, 67(6): 1171-1181.
GUEL S, BELGE-KURUTAS E, YILDIZ E, et al. 2004. Pollution correlated modifications of liver antioxidant systems and histopathology of fish (Cyprinidae) living in Seyhan Dam Lake, Turkey [J]. Environmental International, 30(5): 605-609.
KONO Y, FRIDOVICH I. 1982. Superoxide radical inhibits catalase [J]. Journal of Biological Chemistry, 257(10): 5751-5754.
LIU X J, LUO Z, LI C H, et al. 2011. Antioxidant responses, hepatic intermediary metabolism, histology and ultrastructure in Synechogobius hasta exposed to waterborne cadmium [J]. Ecotoxicology and Environmental Safety, 74(5): 1156-1163.
MARTINEZ-ALVAREZ R M, MORALES A E, SANZ A. 2005. Antioxidant defenses in fish: biotic and abiotic factors [J]. Reviews in Fish Biology and Fisheries, 15(1-2): 75-88.
PANDEY S, PARVEZ S, ANSARI R A, et al. 2008. Effects of exposure to multiple trace metals on biochemical, histological and ultrastructural features of gills of a freshwater fish, Channa punctata Bloch [J].Chemico-Biological Interactions, 174(3): 183-192.
PANDEY S, PARVEZ S, SAYEED I, et al. 2003. Biomarkers of oxidative stress: a comparative study of river Yamuna fish Wallago attu (Bl. &Schn.) [J]. Science of the Total Environment, 309(1-3): 105-115.
ROMÉO M N, BENNANI N, GNASSIA-BARELLI M, et al. 2000. Cadmium and copper display different responses towards oxidative stress in the kidney of the sea bass Dicentrarchus labrax [J]. Aquatic Toxicology, 48(2): 185-194.
SAMPAIO F G S, BOIJINK C D L, OBA E T, et al. 2008. Antioxidant defenses and biochemical changes in pacu (Piaractus mesopotamicus) in response to single and combined copper and hypoxia exposure [J].Comparative Biochemistry and Physiology, Part C: Toxicology and Pharmacology, 147(1): 43-51.
SIKDER M T, KIHARA Y, YASUDA M, et al. 2013. River water pollution in developed and developing countries: judge and assessment of physicochemical characteristics and selected dissolved metal concentration [J]. Clean Soil, Air, Water, 41(1): 60-68.
SRIKANTH K, PEREIRA E, DUARTE A C, et al. 2013. Glutathione and its dependent enzymes' modulatory responses to toxic metals and metalloids in fish: a review [J]. Environmental Science and Pollution Research, 20(4): 2133-2149.
VUTUKURU S S, SUMA C, MADHAVI K R, et al. 2006. Acute effects of copper on superoxide dismutase, catalase and lipid peroxidation in the freshwater teleost fish, Esomus danricus [J]. Fish Physiology and Biochemistry, 32(3): 221-229.
ZENG Y Y, LAI Z N, GU B H, et al. 2014. Heavy metal accumulation patterns in tissues of Guangdong bream (Megalobrama terminalis) from the Pearl river, China [J]. Fresenius Environmental Bulletin, 23(3 a): 851-858.
曹亮. 2010. 铜、镉对褐牙鲆(Paralichthys olivaceus)早期发育阶段的毒理效应[D]. 青岛: 中国科学院海洋研究所.
李捷, 李新辉, 贾晓平, 等. 2010. 西江鱼类群落多样性及其演变[J]. 中国水产科学, 17(2): 298-311.
李琳, 李新辉, 杨继平, 等. 2013. 氮和磷营养盐对广东鲂仔鱼的毒性研究[J]. 安徽农业科学, 41(23): 9628-9630.
陆奎贤. 1990. 珠江水系渔业资源[M]. 广州: 广东科技出版社: 146-150.
吕景才, 宋晓阳, 王凡, 等. 2002. 镉污染对鲢抗氧化防御系统影响研究[J]. 西南农业大学学报, 24(6): 491-493.
许淑英, 谢刚, 祁宝伦, 等. 1998. 广东鲂鱼苗对水产药物敏感性的试验[J]. 水利渔业, (4): 4-5.
中国水产科学研究院珠江水产研究所等. 1990. 广东淡水鱼类志[M]. 广州: 广东科学技术出版社: 98-100.
曾艳艺, 赖子尼, 杨婉玲, 等. 2014. 铜和镉对珠江天然仔鱼和幼鱼的毒性效应及其潜在生态风险[J]. 生态毒理学报, 9(1): 49-55.
Responses towards Oxidative Stress of Juvenile Guangdong Bream Megalobrama terminalis to Cu2+and Cd2+Exposure
ZENG Yanyi, LAI Zini*, YANG Wanling, GAO Yuan, WANG Chao, LIU Qianfu, ZHANG Weizhen, ZHAO Lina
Fishery Eco-environment Monitoring and Evaluation Function Laboratory of the Pearl River Valley, Experimental Station for Scientific Observation on Fishery Resources and Environment in the Middle and Lower Reaches of Pearl River, Pearl River Fishery Research Institute, Chinese Academy of Fishery Sciences, Guangzhou 510380, China
Guangdong bream (Megalobrama terminalis) is an endemic fish species with great economic value in the Pearl River watershed. It has been listed in the National Aquatic Germ-plasma Resources Conservation Project in China. However, as the natural habitats of the fishes is continuously destroyed, and heavy metals and other water pollution problems are aggravated, many endemic fish resources represented by Guangdong bream is sharply declined in recent years. In this study, a series static bioassay were carried out on Guangdong bream juvenile in order to find the appropriate biomarkers to improve the evaluation and early warning system for pollution in the Pearl River watershed. The fish were exposed to the separated or combined Cu2+and Cd2+at low, medium, and high toxic concentrations responding to 0.01 TU, 0.03 TU and 0.11 TU, respectively(1 TU, toxic unit is the 48 h LC50of Cu2+or Cd2+in Guangdong bream juvenile) for 14 days. The substances and enzymes towards to oxidative stress including malondialdehyde (MDA), glutathione (GSH), superoxide dismutase (SOD), catalase (CAT), and total antioxidant capacity (T-AOC) were determined on day 1, 4, 7, and 14 during the exposure period. The results show that MDA, GSH concentrations and T-AOC, SOD and CAT activities (all of the five substances were calculated by protein content, similarly hereinafter) in the juvenile bream were within the range of 1.08~7.34 nmol·mg-1, 0.42~22.82 mg·g-1, 0.10~1.32 U·mg-1, 2.45~13.24 U·mg-1and 0.01~0.09 U·mg-1, respectively, and varied according to exposure time and exposure concentrations.. The concentrations of GSH, MDA and the T-AOC activity in the fish were significantly increased after Cu2+and Cd2+exposure, and rapidly reached the peak on day 1. The relationship between GSH level and the exposure concentration (c, in the unit of TU) of Cu2+and Cd2+were well fitted with the conic curves GSH=-2112(c-0.084)2+18.1, r=0.847, n=10, P=0.012 on day 1, and the toxic concentration threshold was calculated as 0.084 TU. The other two substances SOD and CAT activities were also significantly elevated after Cu2+and Cd2+exposure and reached the peak on day 4. The relationships between SOD, CAT activities and the exposure toxic units of Cu2+and Cd2+were also well fitted with the conic curves SOD=-2073(c-0.059)2+14.3, r=0.840, n=10, P=0.014; CAT=-21.2(c-0.056)2+0.102, r=0.877, n=10, P=0.006, respectively on day 4, and the thresholds concentrations were 0.059 TU to SOD and 0.056 TU to CAT. In summary, GSH was the most rapid response substance to the exposure, while SOD and CAT activities were more sensitive to the exposure and more correlated to each other. This study suggests that GSH, SOD and CAT in the juvenile M. terminalis could be developed as potential biomarkers for water pollution in the Pearl River watershed.
Megalobrama terminalis; heavy metal; oxidative stress and response; toxic unit; biomarker
X171.5
A
1674-5906(2014)12-1972-08
广东省海洋渔业科技推广专项(201101I02);2015年农业部部门预算(物种资源保护)项目(C977)
曾艳艺(1983年生),女,助理研究员,博士,研究方向为水域重金属污染生态与毒理。E-mail: yanyizeng84@163.com
*通讯作者:E-mail: znlai01@163.com
2014-09-12
曾艳艺,赖子尼,杨婉玲,高原,王超,刘乾甫,张威振,赵李娜. 广东鲂幼鱼对铜、镉胁迫的氧化应激响应及其指示意义[J]. 生态环境学报, 2014, 23(12): 1972-1979.
ZENG Yanyi, LAI Zini, YANG Wanling, GAO Yuan, WANG Chao, LIU Qianfu, ZHANG Weizhen, ZHAO Lina. Responses towards Oxidative Stress of Juvenile Guangdong Bream Megalobrama terminalis to Cu2+and Cd2+Exposure [J]. Ecology and Environmental Sciences, 2014, 23(12): 1972-1979.
河流重金属污染及其对水域生态系统的危害日益严重,已引起全球范围的普遍关注(Sikder等,2013)。鱼类作为河流生态系统的重要组成部分,在受重金属污染时,其氧化应激响应指标比形态可见症状的反应要灵敏、迅速,可作为污染指示。在受重金属胁迫的氧化压力下,鱼类为保护自身免受氧毒性损伤启动一套抗氧化防御系统,以维持体内活性氧代谢的平衡。鱼类的抗氧化防御系统包括小分子非酶抗氧化剂如谷胱甘肽、维生素C、维生素E,及超氧化物歧化酶、过氧化氢酶、过氧化物酶、谷胱甘肽还原酶等抗氧化物酶(Martinez-Alvarez等,2005)。以往的大量研究结果表明,重金属胁迫下,鱼类的抗氧化防御响应在不同鱼及其发育生长阶段的差异性显著(Giari等,2007;Asagba等,2008;Atli和Canli,2010;Liu等,2011;Liu等,2011;曹亮,2010)。广东鲂(Megalobrama terminalis),隶属鲤形目、鲤科、鲌亚科、鲂属,是具重要经济价值的珠江流域特有鱼类(中国水产科学研究院珠江水产研究所等,1990)。但自80年代以来,以广东鲂为代表的当地特有鱼类资源急剧下降(陆奎贤,1990),除航道建设、采砂、水坝等工程项目破坏鱼类固有的栖息地及阻断洄游通道外,水环境污染可能也是重要的原因(李捷等,2010)。作者所在的珠江流域渔业生态环境监测中心长期跟踪监测珠江中下游水环境状况发现,铜和镉是该水域主要重金属污染物,这主要与珠江上游
重金属相关工、矿业迅猛发展过程中废液、废渣等排放有关。这些重金属污染物大部分沉积于江底,随江水、洪水冲刷向下游迁移,并在河口富集,而河口又是珠江鱼类早期生长育肥的场所,长此以往,必然对当地鱼类,尤其是对重金属敏感的仔稚幼鱼,产生毒性效应。此外,谢文平等对珠三角鱼类养殖池塘水和底泥的调查中亦发现铜、镉污染的情况较为严重(谢文平等,2014)。然而,国内外有关环境污染因子对广东鲂的生态毒理研究资料缺乏,仅有少量报道(许淑英等,1998;李琳等,2013;曾艳艺等,2014;Zeng等,2014)。为此,作者在延续铜和镉对珠江天然仔鱼和幼鱼的急性毒性效应研究的基础上,以该流域特有种类广东鲂幼鱼为实验对象,进一步开展了铜、镉亚急性胁迫对其氧化应激效应的研究,以期找出适宜的生物标记物,完善珠江流域污染评价与预警体系,从而为珠江鱼类资源的保护提供科学依据。
