白介素1β基因多态性与新疆维吾尔族人群抑郁症的相关性研究
2014-02-25胡楠楠傅松年王江涛党海红
胡楠楠,傅松年,王江涛,党海红
抑郁症又称抑郁障碍,是一种较为常见的精神类疾病,症状以情绪低落、兴趣减退、活动减少为主,严重者伴有自杀倾向,已经占到疾病负担的第四位[1]。目前抑郁症已成为影响大众心理健康的严重问题,具有较高的致残率,严重影响生活质量,给家庭和社会带来巨大的负担[2]。抑郁症是一种环境因素与遗传因素相互作用的复杂疾病,其发病机制至今尚未明确,但有关细胞因子的假说在抑郁症发病机制中越来越受到重视。研究提示特定的细胞因子可以促进大脑产生神经化学物质及神经内分泌激素,引起神经免疫和行为的改变[3]。作为细胞因子家族成员之一的白介素1β(IL-1β)在免疫系统中起致炎作用。人类的IL-1β基因定位于第2号染色体长臂,由7个外显子和6个内含子组成,长度约7 020 bp。rs1143634位于IL-1β基因5号外显子上402的位置,等位基因由C突变为T,编码的105号氨基酸(TTC-TTT)仍为苯丙氨酸,但等位基因突变可能引起其他编码氨基酸的碱基发生颠倒、置换、缺失或者插入突变,从而导致血清中IL-1β水平和/或活性改变影响抑郁症的发生。rs3136558位于IL-1β基因3号内含子上,等位基因由C突变为T,虽不编码氨基酸,但可能影响mRNA的转录及表达,导致氨基酸的改变,并通过改变血清中IL-1β水平和/或活性影响抑郁症的发生。IL-1β基因多态性是否与抑郁症相关,国外已有报道,但尚未得出一致性结论。因此,本研究采用聚合酶链反应-限制性片段长度多态性方法,研究新疆地区维吾尔族抑郁症患者和健康人群的IL-1β基因多态性分布,从遗传学角度探讨IL-1β基因多态性与抑郁症的相关性。
1 资料与方法
1.1 临床资料 选取2012年1月—2013年10月在新疆医科大学第一附属医院心理医学科住院的维吾尔族抑郁症患者100例为抑郁症组,其中男32例,女68例;平均年龄(40.1±11.4)岁。符合精神疾病的诊断和统计手册(DSM-IV)关于抑郁症的命名和诊断标准〔汉密尔顿抑郁量表(HAMD) >17分〕,且经两名副高级以上职称医师诊断。另选取同时期体检中心体检的无精神疾病史、无精神病药物治疗史、无物质滥用史、无神经系统疾病或损伤史的120例健康人为对照组,其中男48例,女72例;平均年龄(42.5±11.9)岁。均为在新疆地区长期居住的维吾尔族非血缘个体,纳入研究前均签署知情同意书。
1.2 方法
1.2.1 DNA提取及PCR扩增 空腹抽取静脉血5 ml,充分抗凝处理后-80 ℃保存,采用全血基因组提取试剂盒〔天根生化科技(北京)有限公司〕提取外周静脉血白细胞DNA。rs1143634位点:引物设计采用Primer premier 5.0 软件,上游引物:5′-AACTCCCTCACTCTTTCTCAGG-3′,下游引物:5′- GGACCAGACATCACCAAGC-3′〔由生工生物工程(上海)有限公司合成〕,并选择相应内切酶Taq Ⅰ。反应体系为20 μl,包括:2×PowerTaq PCR MasterMix(上海莱枫生物科技有限公司),引物P1、P2各0.5 μl (10 pmol/μl),DNA模板2 μl,不足部分由双蒸水补足。PCR扩增条件:94 ℃预变性3 min,94 ℃变性30 s,59 ℃退火30 s,72 ℃延伸30 s,循环30次,最后72 ℃延伸5 min。rs3136558位点:引物设计采用Primer premier 5.0 软件,上游引物:5′-ATTCTCCTTCCTCAGTCTCCTG-3′,下游引物:5′-CCCTGGCTGTAGTGGTGGTC -3′ 〔由生工生物工程(上海)有限公司合成〕,并选择相应内切酶Dpn Ⅱ。反应体系为20 μl,包括:2×PowerTaq PCR MasterMix(上海莱枫生物科技有限公司),引物P1、P2各0.5 μl (10 pmol/μl),DNA模板2 μl,不足部分由双蒸水补足。PCR扩增条件:94 ℃预变性3 min,94 ℃变性30 s,61 ℃退火30 s,72 ℃延伸30 s,循环30次,最后72 ℃延伸5 min。
1.2.2 酶切分型 rs1143634位点分型:Taq Ⅰ(识别片段T ^ CAG)酶切体系共20 μl,包括10 μl PCR产物,10×缓冲液2 μl,Taq Ⅰ内切酶5 U(10 U/μl)( New England Biolabs公司),剩余由双蒸水补足;37 ℃水浴6 h,2%琼脂糖凝胶(核酸染料GELVIEW染色),110 V电泳30 min,在紫外线下观察,并摄影保存。将PCR后的酶切产物与DNA片段长度标准物比较以鉴定基因型。最后挑选上述3种基因型共10例进行PCR产物测序,再次验证。rs3136558位点分型:Dpn Ⅱ(识别片段 ^GATC)酶切体系共20 μl,包括10 μl PCR产物,10×缓冲液2 μl,Dpn Ⅱ内切酶5 U(10 U/μl)( New England Biolabs公司),剩余由双蒸水补足;37 ℃水浴6 h,2%琼脂糖凝胶(核酸染料GELVIEW染色),110 V电泳30 min,在紫外线下观察,并摄影保存。将PCR后的酶切产物与DNA片段长度标准物比较以鉴定基因型。最后挑选上述3种基因型共10例进行PCR产物测序,再次验证。

2 结果
2.1 Hardy-Weinberg平衡检验 IL-1β基因rs1143634位点基因型在抑郁症组和对照组χ2值分别为2.87和3.60 (P>0.05),rs3136558位点基因型在抑郁症组和对照组χ2值分别为3.49和3.59 (P>0.05),符合Hardy-Weinberg平衡,具有群体代表性。
2.2 两组IL-1β基因rs1143634位点基因型及等位基因频率分布 抑郁症组和对照组rs1143634位点CC、CT和TT基因型分布比较,差异无统计学意义(χ2=0.369,P=0.831);C和T等位基因频率比较,差异亦无统计学意义(χ2=0.428,P=0.513,见表1)。
2.3 两组IL-1β基因rs3136558位点基因型及等位基因频率分布 抑郁症组和对照组rs3136558位点CC、CT和TT基因型分布比较,差异无统计学意义(χ2=0.011,P=0.945);C和T等位基因频率比较,差异亦无统计学意义(χ2=0.074,P=0.785,见表2)。
2.4 IL-1β基因rs1143634位点基因多态性分析 将提取的全血基因经PCR扩增后,获得的特异性产物片段长度为454 bp。再经Taq Ⅰ酶切后,T等位基因无酶切位点仍为一条带(454 bp),C等位基因被切为2个片段(353、101 bp)。故3种基因型分别为TT基因型(454 bp)、CT基因型(454、353、101 bp)、CC基因型(353、101 bp)(见图1)。3种基因型测序结果见图2。
表1 两组IL-1β基因rs1143634位点基因型及等位基因频率分布比较〔n(%)〕
Table1 Comparison of the genotype and the allele frequency distribution of IL-1β gene rs1143634 site between two groups

组别例数基因型CC CT TT等位基因频率C T对照组12087(725)27(225)6(50)201(838)39(162)抑郁症组10076(760)20(200)4(40)172(860)28(140)
表2 两组IL-1β基因rs3136558位点基因型及等位基因频率分布比较〔n(%)〕
Table2 Comparison of the genotype and the allele frequency distribution of IL-1β gene rs3136558 site between two groups

组别例数基因型CC CT TT基因频率C T对照组12011(92)65(542)44(366)87(362)153(638)抑郁症组1008(80)54(540)38(380)70(350)130(650)

注:1为TT型,2、4、5、6为CT型,3、7为CC型
图1 IL-1β基因rs1143634位点酶切结果
Figure1 The result of restriction endonuclease digestion of IL-1β gene rs1143634 site

图2 IL-1β基因rs1143634位点3种基因型测序结果
Figure2 The sequencing result of 3 genotypes of IL-1β gene rs1143634 site
2.5 IL-1β基因rs3136558位点基因多态性分析 将提取的全血基因经PCR扩增后,获得的特异性产物片段长度为421 bp。再经Dpn Ⅱ酶切后,C等位基因无酶切位点仍为一条带(411 bp),T等位基因被切为2个片段(205、206 bp)。故3种基因型分别为CC基因型(411 bp)、CT基因型(411、206、205 bp)、TT基因型(206、205 bp)(见图3)。3种基因型测序结果见图4。
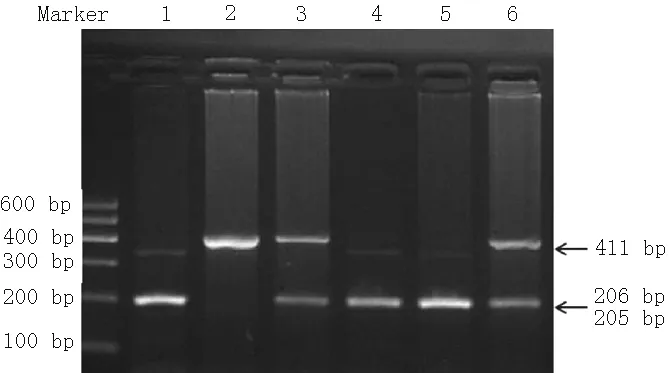
注:2为CC型,3、6为CT型,1、4、5为TT型
图3 IL-1β基因rs3136558位点酶切结果
Figure3 The result of restriction endonuclease digestion of IL-1β gene rs3136558 site

图4 IL-1β基因rs3136558位点3种基因型测序结果
Figure4 The sequencing result of 3 genotypes of IL-1β gene rs3136558 site
3 讨论
IL-1β是细胞因子家族的成员之一,细胞因子是一类传递细胞间信息、具有免疫调节和效应功能的蛋白质或小分子多肽。分类上,根据功能不同,可分为白介素(IL)、干扰素(IFN)、肿瘤坏死因子(TNF)、集落刺激因子(CSF)、趋化因子家族等。随着精神神经免疫学的发展,细胞因子与抑郁症的发病机制成为研究热点。Miller等[5]研究认为细胞因子在抑郁症的发病机制中起着重要作用。Khairova等[6]研究提示特定的细胞因子可以促进大脑产生神经化学物质及神经内分泌激素,从而引起神经免疫和行为的改变,可能导致抑郁症的发生。细胞因子可能导致抑郁症发病机制的几种假说[7]:(1)细胞因子与脑5-羟色胺(5-HT)系统:Stone等[8]研究发现犬尿酸旁路在人体内的重要作用,细胞因子可激活吲哚胺2,3-双加氧酶(IDO),该酶分解5-HT的前体色氨酸(TRP),降低TRP的血浓度,使合成5-HT的原料减少,导致脑内5-HT含量下降,从而引起抑郁症状的产生。(2)细胞因子与下丘脑-垂体-肾上腺轴(HPA):前炎性因子的高表达可以导致免疫应答及HPA轴的激活,并且前炎性因子可以通过扰乱负反馈抑制皮质激素的循环导致HPA轴的异常活跃[9],从而导致抑郁症状的产生。(3)细胞因子与神经可塑性:细胞因子可能通过损伤情绪中枢的神经可塑性产生抑郁症状[6]。
位于IL-1β基因启动子区、编码区的一些SNP位点已经被报道[10-12]。Rosa等[13]研究显示rs1143634位点的基因多态性与精神分裂症的抑郁症状相关。目前尚未见维吾尔族人群的相关报道,本研究选取新疆维吾尔族人群为研究对象,结果发现抑郁症组和对照组rs1143634位点CC、CT和TT基因型频率分别为76.0%、20.0%、4.0%和72.5%、22.5%、5.0%,rs1143634位点抑郁症组与对照组基因频率相似。抑郁症组和对照组rs3136558位点CC、CT和TT基因型频率分别为8.0%、54.0%、38.0%和9.2%、54.2%、36.6%,rs3136558位点抑郁症组与对照组基因频率相似。
其他外文文献也有认为IL-1β基因与抑郁症缺乏相关性的报道。Misener等[14]研究并未发现IL-1β基因多态性和抑郁症具有相关性。Misener等[11]研究结论不支持IL-1β基因与情绪障碍的早期发病相关。Yu等[15]研究认为IL-1β基因-511C/T位点的基因多态性和抑郁症缺乏相关性。上述有关IL-1β基因多态性与抑郁症的关联性报道结果不一致有可能与各研究所纳入的研究人群不一致有关,提示基因分布具有人群和地域差异性。
本研究未测定血清IL-1β水平,未能反映IL-1β基因多态性与血清IL-1β水平的相关性。也未选取新疆其他民族做比较,且样本量较小,因此尚不能肯定IL-1β基因多态性与新疆维吾尔族人群抑郁症缺乏相关性。
本研究报道了新疆维吾尔族人群中IL-1β基因rs1143634、rs3136558位点基因多态性与抑郁症的相关性。在丰富了新疆地区不同民族遗传标本库的同时,为探讨抑郁症的发病机制及抑郁症的诊疗提供了新的思路和方法。
1 Vos T,Flaxman AD,Naghavi M,et al.Years lived with disability (YLDs) for 1160 sequelae of 289 diseases and injuries 1990—2010:a systematic analysis for the Global Burden of Disease Study 2010[J].Lancet,2012,380(9859):2163-2196.
2 Ferrari AJ,Charlson FJ,Norman RE,et al.Burden of depressive disorders by country,sex,age,and year:findings from the global burden of disease study 2010[J].PLoS Med,2013,10(11):e1001547.
3 Audet MC,Anisman H.Interplay between pro-inflammatory cytokines and growth factors in depressive illnesses[J].Front Cell Neurosci,2013,7:68.
4 Shi YY,He L.SHEsis,a powerful software platform for analyses of linkage disequilibrium,haplotype construction,and genetic association at polymorphism loci[J].Cell Res,2005,15(2):97-98.
5 Miller AH,Maletic V,Raison CL.Inflammation and its discontents:the role of cytokines in the pathophysiology of major depression[J].Biol Psychiatry,2009,65(9):732-741.
6 Khairova RA,Machado-Vieira R,Du J,et al.A potential role for pro-inflammatory cytokines in regulating synaptic plasticity in major depressive disorder[J].Int J Neuropsychopharmacol,2009,12(4):561-578.
7 王东林,林文娟.细胞因子与抑郁症发病机制研究进展[J].中国神经精神疾病杂志,2007,33(9):572-573.
8 Stone TW,Darlington LG.Endogenous kynurenines as targets for drug discovery and development[J].Nat Rev,2002,1(8):609-620.
9 Schiepers OJ,Wichers MC,Maes M.Cytokines and major depression[J].Pro Neuro psychopharmacol Biol Psychiatry,2005,29(2):201-217.
10 Hwang JP,Tsai SJ,Hong CJ,et al.Interleukin-1 beta -511C/T genetic polymorphism is associated with age of onset of geriatric depression[J].Neuromolecular Med,2009,11(4):322-327.
11 Misener VL,Gomez L,Wigg KG,et al.Tagging SNP association study of the IL-1beta gene (IL1B) and childhood-onset mood disorders[J].Am J Med Genet B Neuropsychiatr Genet,2009,150B(5):653-659.
12 Borkowska P,Kucia K,Rzezniczek S,et al.Interleukin-1beta promoter (-31T/C and -511C/T) polymorphisms in major recurrent depression[J].J Mol Neurosci,2011,44(1):12-16.
13 Rosa A,Peralta V,Papiol S,et al.Interleukin-1β (IL-1β) gene and increased risk for the depressive symptom-dimension in schizophrenia spectrum disorders[J].Am J Med Genet B Neuropsychiatr Genet,2004,124B(1):10-14.
14 Misener VL,Gomez L,Wigg KG,et al.Cytokine genes TNF,IL1A,IL1B,IL6,IL1RN and IL10,and childhood-onset mood disorders[J].Neuropsychobiology,2008,58(2):71-80.
15 Yu YW,Chen TJ,Hong CJ,et al.Association study of the interleukin-1β(C-511T) genetic polymorphisms with major depressive disorder,associated symtomatology,and antidepressant response[J].Neuropsychopharmacology,2003,28(6):1182-1185.
