烟草靶斑病菌(Rhizoctonia solani)细胞壁降解酶活性分析及其致病作用
2014-02-23赵艳琴吴元华伏颖赵秀香陈建光
赵艳琴,吴元华,伏颖,赵秀香,陈建光
1.沈阳农业大学植物保护学院,沈阳市东陵路120号 110866
2.内蒙古民族大学农学院,内蒙古自治区通辽市霍林河大街22号 028000
3.沈阳市疾病防控中心,沈阳市皇姑区岐山中路37号 110031
烟草靶斑病菌(Rhizoctonia solani)细胞壁降解酶活性分析及其致病作用
赵艳琴1,2,吴元华*1,伏颖3,赵秀香1,陈建光1
1.沈阳农业大学植物保护学院,沈阳市东陵路120号 110866
2.内蒙古民族大学农学院,内蒙古自治区通辽市霍林河大街22号 028000
3.沈阳市疾病防控中心,沈阳市皇姑区岐山中路37号 110031
为揭示烟草靶斑病菌细胞壁降解酶的致病机理,进行了烟草靶斑病菌细胞壁降解酶活性变化、产酶条件及对叶片损伤作用的研究。结果表明:烟草靶斑病菌在烟草活体内、外均可产生果胶酶及纤维素酶,其中烟草组织活体外以多聚半乳糖醛酸酶(PG)和果胶甲基半乳糖醛酸酶(PMG)活性最高,而在烟草活体内羧甲基纤维素酶(Cx)和β-葡萄糖苷酶活性最高,且强致病力菌株的产酶能力强于弱致病力菌株;产酶条件研究表明,培养10 d产生的Cx和β-葡萄糖苷酶的活性最强,而培养12 d产生的PG、PMG、多聚半乳糖醛酸反式消除酶(PGTE)和果胶甲基反式消除酶(PMTE)的活性最强;最适宜产生CWDEs的条件为25℃下,pH 5~6连续黑暗的静止培养环境;烟草靶斑病菌产生的细胞壁降解酶可导致烟草叶片明显受损,其损伤作用大小表现为混合酶明显高于单一酶,且果胶酶对烟草叶片的损伤作用高于纤维素酶。
烟草靶斑病;立枯丝核菌;细胞壁降解酶;产酶条件;致病作用
植物病原菌在与寄主植物互作的过程中,病原菌会分泌一系列降解酶,以突破寄主植物的细胞壁等屏障,这类酶包括果胶降解酶和纤维素酶。立枯丝核菌(Rhizoctonia solani kühn)是一种植物病原菌,可以引起多种植物病害,其引起的烟草靶斑病是烟草生产上的重要病害之一[1]。2006年烟草靶斑病在我国辽宁丹东地区首次大面积发生,部分地块产量损失高达90%以上[2],此后在黑龙江、广西等地也有发生。尽管国内外学者对烟草靶斑病已进行了大量研究,但多集中在烟草靶斑病的生物学、生态学、遗传多样性及化学防治等方面[3-5],对该病原菌致病机制的研究报道却较少[6-7]。目前的研究表明细胞壁降解酶是重要的致病因子之一[8-11],但鲜见对立枯丝核菌(R.solani)细胞壁降解酶致病作用的报道[12-13],未见有关烟草靶斑病菌产生细胞壁降解酶的报道。为此,进行了烟草靶斑病菌细胞壁降解酶活性、产酶条件及其对烟草叶片损伤作用试验,旨在明确烟草靶斑病菌的致病机理。
1 材料与方法
1.1 试验材料
供试菌株为烟草靶斑病菌(R.solani)菌株YC-9及弱致病力菌株LF-1,本试验室保存;供试烟草品种为NC89。
1.2 烟草靶斑病菌细胞壁降解酶的提取及纯化
[14]的方法采用改良查氏培养液于28℃静置培养烟草靶斑病菌15 d后过滤获得粗酶液;用硫酸铵沉淀法对人工培养粗酶液进行纯化[15],并将酶液保存于-20℃下备用。
细胞壁降解酶的活体内提取:于接种烟草靶斑病菌后5 d切取烟草叶片病斑处、病健交界处、健处各直径为3 mm的组织圆片备用;将各样品按每克鲜组织加入4 mL NaCl(l mol·L-1)提取液,研磨后3500 r/min离心15 min,按照李宝聚等[16]的方法提取细胞壁降解酶,酶液保存于-20℃备用。
1.3 细胞壁降解酶活性测定
于520 nm处测定反应混合液释放的还原糖含量,计算人工培养获得的及烟草活体内获得的Cx、β-葡萄糖苷酶、PG、PMG的活性,以30℃下每分钟每毫克蛋白酶催化底物释放1.0 μg还原糖为一个酶活性单位[15];并参考文献[16]的方法在232 nm处测定PGTE和PMTE的酶活性,定义每分钟每毫克蛋白酶催化底物释放1.0 μmol不饱和醛酸为一个酶活性单位。
1.4 不同致病力烟草靶斑病菌产酶能力比较
将烟草靶斑病菌强致病力菌株YC-9及弱致病力菌株LF-1分别进行培养,于培养2,4,6,8,10,12,14和16 d后提取粗酶液,并测定PG,PMG,PMTE,PGTE,Cx和β-葡萄糖苷酶活性,比较不同致病力菌株的产酶能力。
1.5 病菌细胞壁降解酶的致病作用
分别培养10和12 d后提取果胶酶和纤维素酶,纯化备用。取8叶期的烟草叶片分别滴加果胶酶液和纤维素酶液各20 μL于针刺部位,置于28℃光照培养箱覆膜保湿,以酶提取缓冲液为对照,12 h后观察记录病变情况;另以果胶酶液和纤维素酶液以及二者等体积混合酶液处理烟草叶片,取各酶液10 mL置于试管中,另取直径5 mm的烟叶圆片10片浸入各酶液,28℃静置处理6 h后,以蒸馏水处理为对照(CK),采用电导仪(DD-ⅡA型)测定样品的电导率,将各样品煮沸后冷却再次测量电导率,并计算相对电导率[15],比较相对电导率反映的果胶酶及纤维素酶的损失作用。

2 结果与分析

表1 活体外烟草靶斑病菌产生的细胞壁降解酶活性①Tab.1Activity of cell wall degrading enzymes produced in vitro from R.solani
2.1 活体外人工离体培养烟草靶斑病菌产生的细胞壁降解酶活性分析
由表1可知,烟草靶斑病菌于培养液中能产生4种果胶酶,即PG,PMG,PGTE和PMTE,以及2种纤维素酶,即Cx和β-葡萄糖苷酶,这6种酶中PG活性最高,为1117.99 U·mg-1,与其他酶活性差异达极显著水平,PMG和PMTE最低,仅为1.45 U·mg-1。因此,烟草活体外培养时PG和PMG是烟草靶斑病菌产生的主要细胞壁降解酶。
2.2 不同致病力烟草靶斑病菌菌株的产酶能力比较
由图1可知,活体外强弱致病力菌株的产酶能力明显不同。对强弱致病力菌株的PG和PMG活性测定结果表明各酶变化规律基本一致。在培养2~10 d内,强致病力菌株YC-9的产PG和PMG酶量比弱致病力菌株LF-1略高,在培养12 d时YC-9的产酶量骤然上升,PG活性达到LF-1的6.71倍,PMG活性达到LF-1产酶活性的5.84倍;之后两种酶活性逐渐下降,到16 d时与LF-1无明显差异。这表明强致病力菌株YC-9产PG和PMG酶能力强于弱致病力菌株。
仅在培养10~12 d时,YC-9的PGTE活性明显高于LF-1;而在培养10~12 d时强致病力菌株YC-9的PMTE活性显著高于LF-1,在12 d时菌株YC-9的PMTE活性达到高峰(1.7611 U·mg-1),是LF-1酶活性的6.84倍,之后下降至较低水平,而LF-1在此过程中基本保持稳定不变。这表明强致病力菌株YC-9产PGTE和PMTE能力强于弱致病力菌株。
Cx的酶活性在培养期间强弱致病力菌株均表现出先上升后下降的趋势,在2~10 d时YC-9的酶活性比LF-1略高;在培养10 d时强致病力菌株YC-9达到酶活性高峰,此后开始下降;而弱致病力菌株LF-1的酶活性在第12天出现高峰后开始下降,12 d以后略高于菌株YC-9,这表明弱致病力菌株LF-1的Cx酶活性高峰出现的时间滞后于强致病力菌株YC-9。
在培养期间菌株LF-1的β-葡萄糖苷酶活性没有被测出,而菌株YC-9的β-葡萄糖苷酶却表现出较高的活性,并于第10天达到酶活性高峰,表明弱致病力菌株LF-1不能产生β-葡萄糖苷酶,由此推测这可能是其对烟草的致病力明显降低的原因[17]。
2.3 烟草活体内病菌产生的细胞壁降解酶活性
2.3.1 接种后烟叶组织中细胞壁降解酶的活性变化
由表2可知,烟草与靶斑病菌互作后,病斑的不同部位均检测出PG,PMG,PGTE和PMTE 4种果胶酶以及Cx和β-葡萄糖苷酶2种纤维素酶,在病斑组织各部位均表现为Cx和β-葡萄糖苷酶的活性最高,PG和PMG次之,PGTE和PMTE活性最低;各种酶也均表现出病健交界处酶活性最高,病斑处次之,病斑外侧健康叶片组织中最低。与活体外培养相比,在活体内的病菌各种酶的活性远低于活体外培养的酶活性,二者无明显相关性。

图1 强弱致病力菌株产酶活性比较Fig.1Comparison of enzyme activity between strong and weak pathogenicity strains
2.3.2 接种后烟叶中细胞壁降解酶的活性变化
由图2可知,随着接种时间的延长,各种细胞壁降解酶的活性变化均呈现出波动增加后趋于稳定的趋势,且各取样时间点处理样品的酶活性均高于对照。其中,Cx、β-葡萄糖苷酶、PG和PMG活性在接种后第2天出现一次小高峰后下降,在第4天后再次升高,于第6天达到最高,之后下降至第8天再次上升,升至第14天后略有下降,至第18天仍保持较高活性;在接种后的全过程中,两种纤维素酶即β-葡萄糖苷酶和Cx的活性最高,而PG和PMG次之,PGTE和PMTE活性最低。这表明在与烟草互作的过程中为了克服烟草的抗性,各种细胞壁降解酶进行了复杂的生理生化反应,最终导致发病。
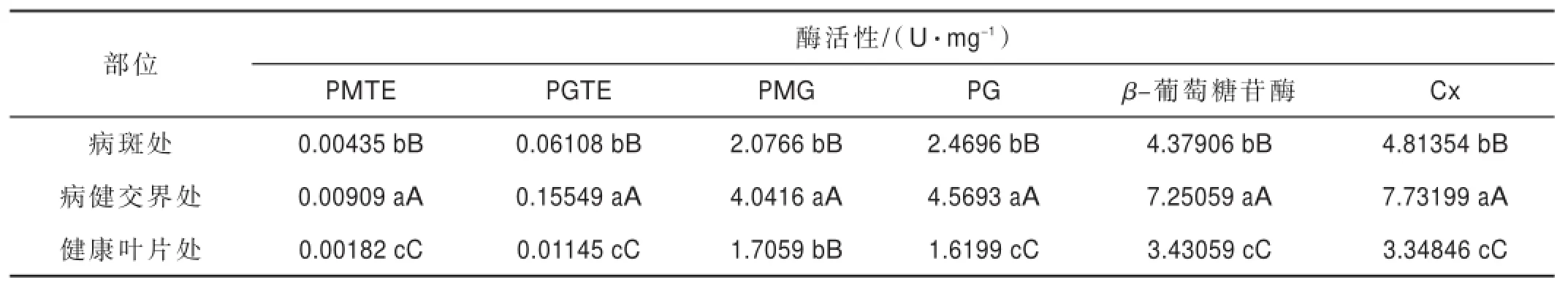
表2 不同部位细胞壁降解酶的活性Tab.2Activities of cell wall degrading enzymes produced in different parts

图2 接种后烟叶内细胞壁降解酶活性的变化Fig.2Activities of cell wall degrading enzymes produced in vivo from R.solani
2.4 烟草靶斑病菌细胞壁降解酶的致病作用
2.4.1 对烟草叶片损伤作用的观察
由图3可以看出,果胶酶及纤维素酶均能造成烟草叶片明显损伤,其中果胶酶可使叶片出现边缘明显的较大褐色病斑,而接种纤维素酶仅使叶片产生较小的淡黄色病斑,表明均能对烟草叶片产生致病作用。

图3 烟草靶斑病菌果胶酶及纤维素酶对烟草叶片的损伤作用Fig.3Effects of cell wall degrading enzymes of R.solani on tobacco leaf
2.4.2 对烟草细胞膜透性的影响
通常相对电导率越大,表明电解物质泄露越多,细胞膜损伤愈严重。表3结果表明烟草靶斑病菌产生的果胶酶、纤维素酶及二者等体积混合酶的相对电导率均明显高于对照,且混合酶液处理的相对电导率最大,果胶酶处理次之,纤维素酶处理的电导率最小。表明果胶酶及纤维素酶共同作用对烟草组织的破坏作用增强,致病作用较单一酶更强。

表3 烟草靶斑病菌细胞壁降解酶对烟草叶片损伤作用Tab.3Comparison of damage effect of cell wall degrading enzymes of R.solani on tobacco leave
3 结论与讨论
烟草靶斑病菌在人工培养条件下,可以产生6种细胞壁降解酶,其中PG,PMG和Cx活性较高,与陈夕军等[12]和陈捷等[13]分别对水稻纹枯病菌和玉米纹枯病菌细胞壁降解酶的测定结果基本一致。在人工培养条件下,不同致病力菌株的产酶能力比较表明,强致病力菌株产酶能力强于弱致病力菌株,这可能与其致病力差异有关。
烟草靶斑病菌细胞壁降解酶在烟草活体内与人工培养条件下活性差别较大,烟草活体内的细胞壁降解酶活性较低,与刘志恒等[15]对黄瓜棒孢叶斑病菌细胞壁降解酶的研究结果基本一致;活体接种中各细胞壁降解酶均表现出酶活性的起伏变化,这可能是由于病菌在与烟草互作过程中,烟草表现出一定程度的抵抗作用从而导致酶活性在上升的同时又有波动变化;烟草叶片不同病斑部位酶活性不同,烟草病健交界处细胞壁降解酶活性高于病斑其他部位,且纤维素酶活性明显高于果胶酶,这可能是由于致病过程中纤维素酶的作用大于果胶酶的作用造成的。
烟草靶斑病菌产生的细胞壁降解酶能够损伤烟草叶片并引起与病害相似的症状,且果胶酶的破坏作用明显大于纤维素酶,其对烟草细胞膜损伤作用明显,混合酶对烟草细胞膜的损伤作用高于单一酶,在烟草靶斑病菌致病过程中二者共同发挥了致病作用。陈夕军等[12]和杨媚等[18]研究发现水稻纹枯病菌的果胶酶和纤维素酶单独和混合处理都能对水稻叶片细胞膜造成明显的损伤,本试验与其结果基本一致。
参考文献
[1]谈文.国外近年暴发流行的一种新病——烟草靶斑病[J].烟草科技,1995(2):41-42
[2]吴元华,王左斌,刘志恒,等.我国烟草新病害——靶斑病[J].中国烟草学报,2006,12(6):22.
[3]吴元华,赵艳琴,赵秀香,等.烟草靶斑病病原鉴定及生物学特性研究[J].沈阳农业大学学报,2012,43(5):521-527.
[4]伏颖,吴元华,穆凌霄,等.烟草靶斑病菌基因组DNA提取及RAPD反应体系的优化[J].烟草科技,2011(11):71-75,78.
[5]王左斌,吴元华,赵秀香,等.嘧肽菌净对烟草靶斑病的抑菌作用及田间药效试验[J].烟草科技,2007(9):61-64.
[6]伏颖.烟草靶斑病菌遗传分化、侵染特性及致病机理研究[D].沈阳:沈阳农业大学,2011.
[7]赵艳琴,伏颖,赵秀香,等.烟草靶斑病菌粗毒素提取、生物活性及其理化性质研究[J].烟草科技,2013(4):81-84.
[8]赵蕾,张天宇.植物病原菌产生的降解酶及其作用[J].微生物学通讯,2002,29(1):89-93.
[9]Ronald P,de Vries,Jaap Visser. Aspergillus enzymes involved in degradation of plant cell wall polysaccharides [J].Microbiol Mol Biol Rev,2001,65(4):497-522.
[10]Idnurm A,Howlett B J.Pathogenicity genes of phytopathogenic fungi[J].Mol Plant Pathol,2001,2:241-255.
[11]Sanchez L M,Doke N,Ban Y,et al.Involvement of suppressor glucans and plant epidermal cells in host-selective pathogenesis of Phytophthora capsici[J].Phytopathology,1994,140:153-164.
[12]陈夕军,张红,徐敬友,等.水稻纹枯病菌胞壁降解酶的产生及致病作用[J].江苏农业学报,2006,22(1):24-28.
[13]陈捷,唐朝荣,邹庆道,等.玉米纹枯病菌致病因子的研究[J].沈阳农业大学学报,1999,30(3):189-194.
[14]Marcus L,Schejter A. Single step chromatographic purification and characterization of the endo polygalacturonases and pectinesterases of the fungus Botrytis cinerea Pers. [J].Physiol Plant Pathol,1983,23:1213.
[15]刘志恒,亓烨,黄欣阳,等.黄瓜棒孢叶斑病(褐斑病)病菌细胞壁降解酶产生条件及活性分析[J].中国蔬菜,2011(8):76-80.
[16]李宝聚,周长力,赵奎华,等.黄瓜黑星病菌致病机理的研究:II.细胞壁降解酶及其在致病中的作用[J].植物病理学报,2000,30(1):13-18.
[17]赵艳琴,吴元华,伏颖,等.烟草靶斑病菌(Rhizoctonia solani)致病力分化研究[J].沈阳农业大学学报,2013,44(4):471-474.
[18]杨媚,杨迎青,郑丽,等.水稻纹枯病菌细胞壁降解酶组分分析、活性测定及其致病作用[J].中国水稻科学,2012,26(5):600-606.
Activity Pathogenic Effect of Cell Wall Degrading Enzyme in Tobacco Target Spot Pathogen Rhizoctonia solani
ZHAO Yanqin1,2,WU Yuanhua*1,FU Ying3,ZHAO Xiuxiang1,and CHEN Jianguang1
1.College of Plant Protection,Shenyang Agricultural University,Shenyang 110866,China
2.College of Agriculture,Inner Mongolia University for the Nationalities,Tongliao 028000,Inner Mongolia, China
3.Shenyang Center for Disease Prevention and Control,Shenyang 110031,China
In order to reveal the pathogenic mechanism of cell wall degrading enzymes(CWDEs)in tobacco target spot disease pathogen,Rhizoctonia solani(R.solani)was studied in terms of their activities,production condition and damage effect.The results showed that R.solani in tobacco could produce pectinase and cellulase both inside and outside a living body.Outside the living body,the activities of polygalacturonase(PG)and pectin methylgalactuionase(PMG)were the highest;inside the living body,the activities of carboxymethyl cellulase(Cx)and β-glucosidase were the highest,and the enzyme production ability of strains with strong pathogenicity was stronger than that of strains with weak pathogenicity.Cx and β-glucosidase cultured for 10 days reached their highest activities,while PG,PMG,polygalacturonic acid transeliminase(PGTE)and pectin methyltranseliminase(PMTE)cultured for 12 days reached their highest activities.The appropriate conditions for producing CWDEs were:temperature 25℃,pH value 5-6,still culture in the dark.The CWDEs in R.solanicould obviously damage tobacco leaves,the damage caused by a mix of said enzymes was more serious than that caused by a single enzyme,and the damage caused by pectinase was more serious than that caused by cellulase.
Tobacco target spot;Rhizoctonia solani;Cell wall degrading enzyme;Enzyme production condition; Pathogenic effect
S432.41
A
1002-0861(2014)11-0084-05
国家烟草专卖局科技项目“全国烟草有害生物调查研究”[国烟办综(2010)182号];辽宁省烟草专卖局科技攻关项目“辽宁省烟草有害生物调查研究”[辽烟计(2010)86号]。
赵艳琴(1978—),博士,讲师,主要从事植物病原真菌学研究。E-mail:zhaoyanqin782828@qq.com;*
吴元华E-mail:wuyh09@vip.sina.com
2014-05-16
责任编辑:董志坚E-mail:dzj@tobaccoinfo.com.cn电话:0371-67672650
