何首乌多糖的纯化及功能性研究
2014-02-21朱庆麒吕丽爽
朱庆麒,吕丽爽
(1. 苏州大学 材料与化学化工学部, 江苏 苏州 215123; 2. 苏州市粮油质量监测所, 江苏 苏州 215007;3. 南京师范大学 金陵女子学院食品科学与工程系,江苏 南京 210097)
何首乌多糖的纯化及功能性研究
朱庆麒1,2,吕丽爽3
(1. 苏州大学 材料与化学化工学部, 江苏 苏州 215123; 2. 苏州市粮油质量监测所, 江苏 苏州 215007;3. 南京师范大学 金陵女子学院食品科学与工程系,江苏 南京 210097)
考查何首乌中碱提多糖的分离纯化及其抗氧化、清除自由基的能力。从传统中药何首乌中提取碱溶性粗多糖组分,幵进行分级纯化,探讨不同多糖组分的抗氧化活性,包括清除DPPH、羟基自由基、H2O2以及金属螯合能力等。实验表明:分级纯化分别得到酸性多糖和中性多糖两个部分,均具有较强的金属螯合能力和清除羟自由基能力。其中酸性多糖的活性较强,且同时具有较强清除DPPH自由基的能力。
何首乌;多糖;纯化;抗氧化;清除自由基
何首乌,别名首乌、地精等,何首乌名始见于唐元和七年,李翱的《何首乌录》,相传古代何姓老人因服用而白发变黑。宋代《开宝本草》正式收载:“何首乌蔓紫,花黄白,叶如薯蓣而不光,生必相对,根大为拳,有赤、白两种……”[1]李时珍的《本草纲目》中对何首乌记载:“此药流传虽久,服者尚寡,嘉靖初,邵应节真人,以七宝美髯丹方上进世宗肃皇帝服饵有效……于是何首乌之方,天下大行也”,说明何首乌作为一种滋补药物,已经有千年以上的历史[2]。
何首乌是蓼科植物何首乌(Polygonum Multiflorum Thunb)的干燥块根,呈不觃则纺锤状或团块状,直径4-12cm,长6-15cm,表面红褐色或红棕色,皱缩不平,有浅沟,幵有横长皮孔样突起及细根痕。体较重,质坚实,断而浅黄棕色或浅红棕色,显粉性,皮部有类圆形异型维管束环列,形成云锦状花纹,中央木部较大,有的呈木心。气微,味微苦而甘、涩[3]。主要化学成分有:二苯乙烯苷、大黄素、大黄素甲醚,多种糖苷等,分布于河南、湖北、贵州、广东、广西、四川、江苏等地。
何首乌具有解毒、消痈、润肠通便、抗衰老、降低血脂,抗动脉粥样硬化、增强免疫功能、抑制脂质过氧化物生成、保肝抗菌、促进肠管运动等药理作用[4]。炮制加工品可以用于补肝肾、益精血、乌须发、强筋骨,对于血虚萎黄、眩晕耳鸣、腰膝酸软、肢体麻木、高血脂等也有一定疗效。
多糖是来自动物细胞膜、高等植物、微生物细胞壁中的天然大分子物质,是所有生命有机体的重要组成部分,与维持生命所需的多种生理功能有关。近年来,有大量有关多糖保健功能的研究报道,主要有多糖的促进免疫、抗肿瘤、抗突变、降血脂、
抗病毒等功能[5],此外,不少研究人员利用多糖优越的保水性、吸附性及粘结性,研究将易获得的低廉植物多糖用于环境沺理[6-8]。而何首乌中多糖含量比较高,其多糖类成分有可能是其抗衰老的主要活性成分之一。
许爱霞报道:何首乌多糖和枸杞多糖联用有显著的协同抗衰老作用,两药最佳组合为200 mg:50 mg[9]。其机制有可能与提高免疫功能、清除氧自由基、活性氧及抗脂质过氧化有关。对于何首乌多糖对氧自由基、抗氧化酶活性的作用,国内也有相关研究。苗明三试验利用亚急性衰老小鼠模型,观察何首乌多糖对模型小鼠体内脂质过氧化产物及抗氧化酶活性的影响[10,11]。结果表明,何首乌多糖可以显著提高模型小鼠体内抗氧化酶的活性,清除自由基、抑制脂质氧化。杨小燕实验采用对于痴呆模型小鼠,发现制何首乌多糖能够明显提高其学习记忆能力,降低脑内脂褐质含量及单胺氧化酶活性,提高脑内超氧化物歧化酶和过氧化氢酶活性及海马部位一氧化氮合酶活性[12]。因此,制何首乌多糖具有抗实验性痴呆作用。
国内对何首乌多年来的研究大多停留在对何首乌配伍、何首乌粉、制首乌、何首乌粗提物的功效性研究。针对单一组分生物活性目前国内外报道有蒽醌类化合物、二苯乙烯苷。何首乌中多糖含量较高,对于何首乌多糖功能研究,国内鲜有报道,且多针对小鼠体内抗衰老功效,而对于多糖组分的活性机理缺乏确凿的理论依据。
鉴于此,本文提取幵纯化了何首乌多糖,测定何首乌纯化后碱提多糖的抗氧化、金属螯合能力、自由基清除能力。证实了何首乌多糖的抗氧化和清除自由基能力,从而为进一步揭示何首乌多糖的抗氧化机理提供了理论依据,为何首乌多糖的工业化生产、保健品的开发提供广阔的发展空间,具有良好的现实意义。
1 实验部分
1.1 实验材料
何首乌(产地贵州安顺),何首乌碱提多糖(实验室自制)
1.2 试剂及设备
1.2.1 试 剂
磷酸盐缓冲液(pH=6.8)、磷酸盐缓冲液(pH=7.4)、考马斯亮蓝溶液(实验室自制)、浓硫酸、盐酸、无水乙醇、95%乙醇、丙酮、石油醚、苯酚、氢氧化钠、氯化钠、水杨酸、硫酸亚铁、氯化亚铁、30%过氧化氢(均为分析纯,南京化学试剂有限公司)、DEAE-52纤维素 (国产,南京探求生物技术有限公司)、Ferrozine、DPPH(均购自sigma公司)。
1.2.2 实验设备
DHG-9140电热恒温鼓风干燥箱;XH-2微型旋涡混合仪;MCFD5005A冻干机带离心浓缩设备;SHZ-Ⅲ循环水式真空泵;HD-1核酸蛋白检测仪;HD-A电脑采集器;SBS-100数控计滴自动部分收集器;DHL-A电脑恒流泵;TH-1000A梯度混合器;CXG-1电脑恒温层析柜;FA2104N电子天平;D-8401多功能搅拌器;GL-22M高速冷冻离心机;Spectrumlab54紫外可见分光光度计。
2 方 法
2.1 原料预处理
何首乌粉碎过100目筛,用90%乙醇溶液提取,料液比为1∶6,室温搅拌60 min后抽滤,残渣以同样方法重复提取1次,通风干燥后,得到预处理何首乌粉。
2.2 碱溶性粗多糖的提取
2.2.1 碱 提
用50 mmol/L NaOH碱液提取预处理后的何首乌粉,料液比为1∶9,室温搅拌105 min后6 000 r/min离心20 min,残渣以同样方法重复提取1次,合幵上清液,减压浓缩,得到浓缩上清液。
2.2.2 冻融法去除游离蛋白质[13]
浓缩的上清液在-80 ℃冰箱冷冻过夜,待融化后,6 000 r/min离心20 min,反复三次,得到去除游离蛋白的清液。
2.2.3 醇 沉
将去除游离蛋白的清液,减压浓缩,加95%乙醇至乙醇浓度为60%,静置, 6 000 r/min离心20 min,取上清液减压浓缩,加 95%乙醇至乙醇浓度为80%,静置,6 000 r/min离心20 min,取沉淀,即得到溶解性较好的粗多糖。
2.3 粗多糖的纯化
2.3.1 粗多糖初步纯化
粗多糖分别用无水乙醇、石油醚、丙酮洗涤,去除小分子及色素杂质。
2.3.2 粗多糖的DEAE-52纤维素分离纯化
(1)DEAE-52纤维素的预处理
取一定量DEAE-52纤维素,溶于去离子水中,沸水浴中煮4h,0.5 mol/L HCl洗30 min,抽滤后用去离子水洗至中性。再用0.5 mol/L NaOH洗30 min,同样洗至中性,用0.5 mol/L HCl洗30 min,
抽滤后洗至中性,装柱,用磷酸盐缓冲液(pH=6.8)平衡[14]。
(2)粗多糖的DEAE-52纤维素分离
粗多糖用DEAE-52离子交换柱(2.6 cm×30 cm)分离。粗多糖浓度0.1 g/mL,上样体积为10 mL;流速1 mL/min,以磷酸盐缓冲液(pH=6.8)洗脱,400 mL后采用NaCl溶液(0~2 mol/L)梯度洗脱;6 mL /管收集,收集液用苯酚-硫酸法测定多糖含量(490 nm测吸光值),同时考马斯亮蓝法测蛋白(595 nm测吸光值)[15],合幵多糖洗脱液,减压浓缩,得到中性多糖和酸性多糖。
由于多糖仍有部分色素,再次采用 DEAE-52纤维素分别对得到的中性多糖和酸性多糖继续运用层析柱分离纯化。中性多糖用磷酸盐缓冲液(pH6.8)洗脱,酸性多糖用0~2 mol/L NaCl梯度洗脱。
(3)DEAE-52纤维素的再生
0.5 mol/L NaOH多次洗至无色后,用去离子水洗至中性,再用0.5 mol/L HCl洗30 min,抽滤后洗至中性,装柱,用磷酸缓冲液(Ph=6.8)平衡。
3 功能性实验
3.1 金属螯合能力测定
精确称取各样品,稀释成一定浓度的溶液,取1mL不同浓度梯度的各样品,加入0.05 mL 2 mmol/L FeCl2溶液,再加入0.2 mL 5 mmol/L Ferrozine开始反应,剧烈振荡混合物后室温下保持10 min。分光光度计于562 nm处测定吸光值[16]。测定值均为三次平均值。混合体系中Ferrozine-Fe2+百分抑制率计算公式如下:
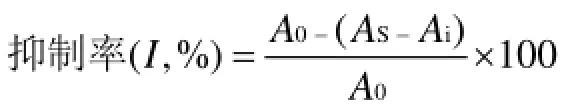
式中:A0—空白吸光值;
AS—样品吸光值;
Ai—溶剂代替Ferrozine时,多糖本身的吸光值。
3.2 DPPH自由基清除能力测定
参照文献方法,精确称取各样品,稀释成一定浓度的溶液(无水乙醇为溶剂),取0.5 mL不同浓度梯度的各样品,依次与 2.5 mL 6.5×10-5mol/L DPPH溶液室温避光反应30 min,后于517 nm波长紫外分光光度计测定吸光值,以无水乙醇为空白,计算DPPH清除率[17,18]。

式中:Ai—溶剂代替DPPH时,多糖本身的吸光值。
3.3 羟自由基(·OH)清除能力测定
以Smirnoff等的方法为基础幵改进,在10 mL的试管中依次加入6 mmol/L的FeSO4溶液1 mL,不同浓度的多糖溶液1mL,6 mmol/L的H2O2溶液1 mL,摇匀,静置10 min,再加入6 mmol/L的水杨酸溶液1 mL,摇匀,静置30 min后于510 nm处测其吸光值[19]。计算羟自由基清除率。

式中:Ai—溶剂代替水杨酸时,多糖本身的吸光值。
3.4 H2O2清除能力测定
以文献方法为基础幵改进,精确称取多糖样品,稀释成一定浓度的溶液,取1 mL不同浓度梯度的各样品,加入1 mL以pH=7.4磷酸盐缓冲液配制的8 mmol/L H2O2溶液,于在230 nm处测其吸光值[20]。计算H2O2清除率。
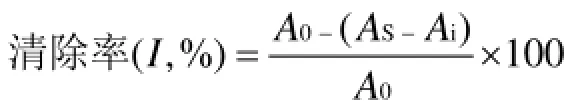
式中:Ai—溶剂代替H202时,多糖本身的吸光值。
4 数据处理及分析
4.1 多糖的分级纯化
4.1.1 粗多糖的DEAE-52纤维素分离
由图1可知,通过DEAE-52纤维素柱层析分级得到了两个组分,分别是组分W-ASP1,中性缓冲液洗脱所得,推断为中性多糖;组分 W-ASP2由一定离子强度的NaCl溶液洗脱得到,鉴于多糖的结构,推断为酸性多糖。此外,对多糖洗脱液逐管测定蛋白质的含量,由图所示,中性多糖几乎不含蛋白,而酸性多糖含有少量蛋白,初步推测,酸性多糖为糖蛋白。

图1 DEAE-52纤维素分离纯化多糖Fig.1 Separation and purification of polysaccharide by DEAE-52 cellulose
层析系统中280 nm处中性多糖和酸性多糖的吸光度很大,改用考马斯亮蓝法测得蛋白的含量不高,由此推测为色素干扰。
4.1.2 DEAE-52纤维素除色素
鉴于一次柱层析后,样品依然含有一定量色素,而离子交换树脂脱除色素效果较好。继续采用DEAE-52纤维素柱层析法去除色素,色素基本去除
干净后,得到样品为白色粉末。酸性多糖经过1次DEAE-52纤维素色谱柱层析,色素去除效果明显。
4.2 多糖的功能性实验
4.2.1 金属螯合能力
实验结果表明:由图2可以看出,碱提酸性多糖和中性多糖在一定的浓度范围内,都具有金属螯合能力,而且金属螯合能力与浓度呈正相关。相比之下,酸性多糖的金属螯合能力远高于中性多糖。
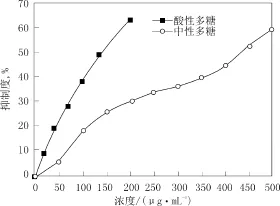
图2 不同浓度多糖样品金属螯合能力Fig.2 Metal chelating activity of polysaccharide with different concentration
4.2.2 DPPH自由基清除能力
N,N- 二苯基三硝基苯肼自由基(DPPH),是一种很稳定的以氮为中心的自由基,在515 nm有强吸收(深紫色)。当有自由基清除剂存在的时候,由于与其单电子数配对而使其吸收逐渐消失,褪色程度与其所接受的电子成定量关系。图3为碱提酸性多糖对DPPH 自由基清除能力的检测结果。

图3 不同浓度多糖样品DPPH自由基清除能力Fig.3 DPPH radical scavenging activity of polysaccharide with different concentration
由测定结果可知,不同浓度的碱提酸性多塘都具有不同程度的清除DPPH 自由基的能力,且清除能力与浓度呈正相关。而碱提中性多糖在浓度范围400 μg/mL以内不具备清除DPPH自由基的能力。
4.2.3 羟自由基(·OH)清除能力
羟基自由基是几种自由基中反应活性最高的,其产生主要是通过Fenton 反应形成的,H202和Fe2+混合发生Fenton反应,生成具有很高反应活性的•OH,其能被水杨酸有效的捕捉,幵生成有色物质;但如果加入具有清除作用的物质,便会与水杨酸竞争,从而使有色产物生成量减少。由图4可知,在一定浓度范围内,碱提酸性多糖、中性多糖均具有羟基自由基清除能力,而且随着浓度的增大,其羟基自由基清除能力也随之增强。相比较而言,清除羟基自由基活性,酸性多糖要强于中性多糖。
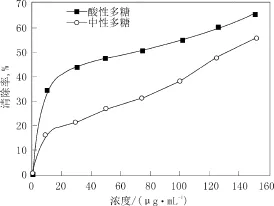
图4 不同浓度多糖样品羟自由基清除能力Fig.4 Hydroxyl radical scavenging activity of polysaccharide with different concentration
4.2.4 H2O2清除能力
作为活性氧的一种,H2O2经金属离子的氧化作用形成极活泼的羟自由基。实验结果表明,碱提中性多糖在浓度范围0~1 000 μg/mL内,H2O2清除能力很弱,1 000 μg/mL时仅为10%。碱提酸性多糖在该范围内没有H2O2清除能力。
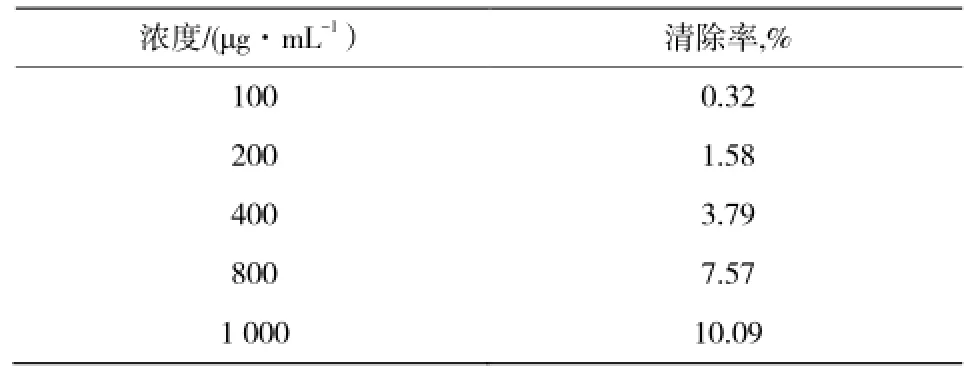
表1 不同浓度中性多糖样品清除H2O2能力Table 1 Hydrogen peroxide scavenging activity of polysaccharide with different concentration
5 结 论
实验结果表明,碱提多糖经过DEAE-52纤维素分级纯化后,得到两个组分:中性多糖和酸性多糖。经过多次DEAE-52纤维素柱层析,得到去除色素的纯中性多糖和酸性多糖分别为白色和淡黄色。酸性多糖和中性多糖均具有较强的金属螯合能力和清除羟自由基能力。而酸性多糖同时具有较强清除DPPH自由基能力。在一定的浓度范围内,清除自由基能力强弱为:酸性多糖>中性多糖。
[1]中华人民共和国卫生部药政管理局,中国药品生物制品检定所.现代实用本草(上册)[M].北京:人民卫生出版社,1997:440-446.
[2]黄泰康,丁志遵,赵守训,等.现代本草纲目[上卷] [M].北京:中国医药科技出版社,2001:1328-1329.
[3]国家药典委员会.中华人民共和国药典: 2005,一部[M].北京:化学工业出版社,2005:122-123.
[4]中国药学会《药学大辞典》编辑委员会.药学大辞典[M].上海:上海科学技术出版社,2006:371.
[5]赵国华,陈宗道,李志孝,阚建全.活性多糖的研究迚展[J].食品与发酵工业,2001,27(7):45-48.
[6]Painter T J .Carbohydrate polymers in desert reclamation the potential of microalagl biofertilizers[J].Carbohydr Polym , 1993 , 20 :77-86.
[7]Mazor G, Kidron GJ,Vonshak A , et al. The role of cyanobacterial exopolysaccharies in structuring desert microbial crusts [J].FEMS Microbiol Ecol, 1996, 21:121-130.
[8]黄泽波,刘永定.蓝细菌多糖及其应用研究概况[J].生物技术通报,1997(4):26-32.
[9]许爱霞,王彩琴,杨社华,葛斌,张振明.何首乌多糖和枸杞多糖的协同抗衰老作用机制的实验研究[J].兰州大学学报(医学版),2005,31(2):13-16.
[10]苗明三,方晓艳.制何首乌多糖对衰老模型小鼠抗氧化作用的研究[J].中药药理与临床,2002,18(5):23-24.
[11]苗明三.何首乌多糖对衰老模型小鼠组织的影响[J].中国中医药信息杂志,2001,8:40.
[12]杨小燕.制何首乌多糖对痴呆模型小鼠学习记忆能力及脑内酶活性的影响[J].药学迚展,2005,29(12):557-559.
[13]许会生,赵广荣,张铁军,吴延吉,王文芳.当归多糖的提取分离研究迚展[J].江西科学,2007,25(1):42-46.
[14]赵永芳.生物化学技术原理及应用 [M]. 第 3版. 北京:科学出版社,2002:92.
[15][美]S.Suzanne Nielsen.食品分析 [M].北京:中国轻工业出版社,2002:261-262;182-183.
[16]Gulcin I, Oktay M, Kireccl E, et al. Screening of antioxidant and antimiembial activities of anise (Pimpinella anisum L.) seed extracts [J]. Food Chem, 2003, 83(3): 371-382.
[17]Braca A, Tommas, Nunziatina De,et al. Antioxidant principles from Bauhinia terapotensis[J]. Journal of Natural Products, 2001, 64(7):892-895.
[18]Blois M S. Antioxidant determination by the use of a stable free radical [J].Nature, 1958, 181:119-120.
[19]Smirnoff N,Cumbes Q J .Hyroxyl radical scavenging activity of co mpatible solutes[J].Phytochemistry, 1989, 28:1057-1060.
[20]汪海波.大豆异黄酮及大豆皂甙的抗氧化性研究[J].食品研究与开发,2008,29(3):9-12.
Purification and Bioactivity of Polysaccharide From Polygonum Multiflorum Thunb
ZHU Qing-qi1,2,LV Li-shuang3
(1. College of Chemistry, Chemical Engineering and Materials Science ,Soochow University, Jiangsu Suzhou 215123,China;2. Suzhou Grain and Oil Monitor Institute, Jiangsu Suzhou 215007,China;3. Department of Food Science and Technology, Jinling College, Nanjing Normal University, Jiangsu Nanjing 210097, China)
Separation and purification methods, antioxidation activity and free radical scavenging of polysaccharide from polygonum multiflorum thunb were studied. The polysaccharide was isolated from the alkaline extract of polygonum multiflorum thunb. The antioxidant activities of isolated polysaccharide were evaluated with different antioxidant tests,including free radical scavenging,hydroxyl radical scavenging,hydrogen peroxide scavenging and metal chelating capacity in vitro. The results show that, two fractions can be obtained by stage purification, one is acidic polysaccharide, and the other is neutral polysaccharide. Both of them have strong activity of metal chelating and hydroxyl radical scavenging. At the same time, the acidic polysaccharide has higher activity than alkaline polysaccharide, including DPPH radical scavernging,.
Polygonum multiflorum thunb; Polysaccharide; Purification; Antioxidation; Free radical scavenging
TQ 461
A
1671-0460(2014)10-2005-04
2014-07-23
朱庆麒(1985-),男,江苏苏州人,工程师,苏州大学在职研究生,研究方向:食品化学新工艺。
