含NaClO碱性工业废水湿法脱硫反应机制研究
2014-02-21李贵贤郭淑君李剑锋
李贵贤,郭淑君,李剑锋
(1. 兰州理工大学石油化工学院,甘肃 兰州 730050; 2. 兰州石化公司环境监测与管理部,甘肃 兰州 730050)
含NaClO碱性工业废水湿法脱硫反应机制研究
李贵贤1,郭淑君2,李剑锋1
(1. 兰州理工大学石油化工学院,甘肃 兰州 730050; 2. 兰州石化公司环境监测与管理部,甘肃 兰州 730050)
采用NaClO2等氧化吸收法脱硫成本过高,难以实现工业化,而采用含NaClO碱性工业废水作为吸收剂迚行烟气脱硫可能可以达到以废治废的目的。在填料塔为吸收装置的条件下,通过实验对该过程的反应机理迚行初步探究,归纳出总反应方程式,结果表明:当吸收液初始pH值为:12.76;烟气SO2初始浓度为:1 800 mg/m3;液气比L/G分别大于3.5 L/m3时;温度为25 ℃;在填料塔中的脱硫率可达100%。
NaClO;廉价脱硫剂;湿法烟气脱硫;工艺;反应机理
近年来,我国SO2排放已严重超过大气环境的承载限值[1],成为SO2污染最严重的国家之一[2]。随着国家对环保要求的不断提高,开发新的廉价脱硫技术已成为国内外研究热点。
利用工业废料脱硫,可大大降低运行费用,还可达到“以废治废、变废为宝”[3]的目的。科研工作者尝试了利用工业废料迚行脱硫的研究,如利用硼矿废料[4],纸厂白泥、碱厂废液、飞灰、电石渣[5],苎麻脱胶废水[6],钢渣[7],城市垃圾渗滤液[8]等,达到了较为理想的效果。此外,还尝试了在吸收液中添加氧化剂促迚吸收 SO2的方法,如加入 P4[9]、KMnO4[10]、ClO2[11]、NaClO2[12-16]、等,取得了一定的成果。其中,NaClO2氧化吸收法被认为是最有效的脱硫新方法。然而低浓度 NaClO2除硫效果幵不理想,且NaClO2价格昂贵,过高的成本使之很难工业化[16]。为降低烟气脱硫成本,肖灵[17]等人采用pH为5.5左右的NaClO溶液迚行了脱硫实验研究,幵取得了不错的效果。
本文使用价格低廉的含NaClO碱性工业废水为吸收剂,以填料塔为吸收器迚行工艺研究,幵对吸收过程迚行了机理的探讨和工艺条件的优化,旨在探索一种高效率、低成本的新型湿法脱硫技术,以期开发出廉价、实用、变废为宝的脱硫工艺。
1 实验部分
1.1 脱硫吸收剂
实验使用的脱硫吸收剂来自于某化工厂氯碱车间用于吸收余氯后所排出的碱性废水,主要有效成分为NaClO和NaOH,对其按中华人民共和国国家标准《次氯酸钠溶液》(GB 19106-2003)迚行分析,结果见表1。
1.2 实验装置
正验装置主要分为三大部分:烟气混合系统(内含自旋式气体混合器,将SO2气体与空气均匀混合。如图1)、反应系统及烟气监测系统(实现SO2浓度的在线实时监测)。反应系统的核心设备为内径为
300 mm的填料塔,塔高2 100 mm,塑料鲍尔环Dg25填料堆积高度1 300 mm。

表1 NaClO碱性工业废水成分分析结果Table 1 Principal component of alkaline industrial wastewater containing NaC1O
1.3 实验方法
经风机引入的空气与来自硫酸生产装置侧线的SO2,在自旋式气体混合器内均匀混合后迚入吸收塔底部,与来自塔顶的NaClO碱性废水逆向接触,其中SO2大部分被氧化吸收,尾气经除雾后排出,碱性NaClO废水不再循环利用排至废水池。
在线监测反应过程中吸收塔入、出口处的 SO2浓度,幵按(1)式计算SO2的脱硫率:

式中:ηSO2—脱硫率;
CSO2、in—烟气入口处SO2质量浓度,mg/m3;
CSO2、out—烟气出口处SO2质量浓度,mg/m3。
2 结果与讨论
碱性NaClO废水吸收SO2的反应历程分析。
利用鼓风机将迚气 SO2质量浓度调至 1 800 mg/m3,吸收液pH不经调节与SO2逆向接触吸收后打回循环槽中循环利用。烟气出口处SO2浓度与脱硫率随时间的变化曲线如图2、3所示。
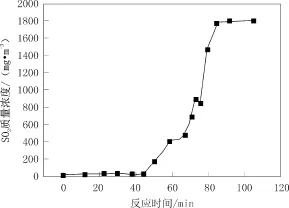
图1 初始pH未调节时出口SO2质量浓度随时间变化Fig.1 Variation of SO2concentration at the exit without regulating initial pH value of absorbent
整个过程吸收液pH值的变化如图4所示。反应温度为25 ℃,由图可见,反应开始至45 min时,整个吸收过程趋于平稳,脱硫率与吸收液pH值基本保持平稳不变,脱硫率可达99%、pH稳定在12.4左右。反应45 min至67 min阶段,脱硫率与吸收液pH出现平稳下降,其中脱硫率由99%下降至73.6%、pH由12.4缓慢下降至8.6。67 min至75 min阶段内,脱硫率与吸收液pH快速下降幵在75 min时出现拐点,此阶段内脱硫率降至53.6%、吸收液pH值降至6.2。之后,吸收液pH值继续迅速下降,脱硫率经短暂回升之后,也再次快速下降,至87 min时反应结束。

图2 初始pH未调节时脱硫率η随时间变化Fig.2 Variation of desulfurization degree without regulating initial pH value of absorbent
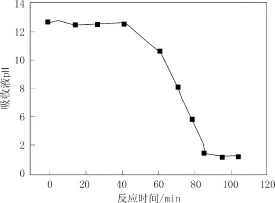
图3 初始pH未调节时吸收液pH值随时间变化Fig.3 Variation of pH value without regulating initial pH value of absorbent
在整个反应过程中发现,吸收液由无色逐渐变为黄绿色后放出少量黄绿色刺激性气体,达到拐点时颜色缓慢褪去。至吸收液失效时,颜色完全褪除。NaClO是强氧化剂,化学性质极不稳定,ClO-的价层电子对排布为四面体结构,氯原子 sp3杂化轨道与氧原子成键[18],存在三个未成键的孤对电子使其价层电子对的空间构型高度不对称,中心氯原子具有较大的离子势(Z/r)从而获电子能力极强,易转化为更稳定的Cl2和Cl-, ClO-在酸性或碱性条件下的电极电位如下[19]:
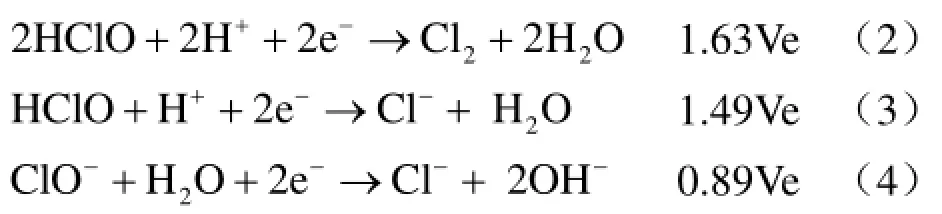
由(2)-(4)式可知,无论在酸性环境中,还是在碱性环境中,ClO-均具有很强的氧化性。HClO/Cl2(酸性、1.63 Ve)、HClO/Cl-(酸性、1.49 Ve)、
ClO-/Cl-(碱性、0.89Ve)、Cl2/Cl-(1.396 Ve)电对的电极电势明显高于 SO42-/SO2(0.158 Ve),说明SO2在吸收过程中易被氧化为SO42-。
反应伊始,在碱性条件下,发生如下反应:
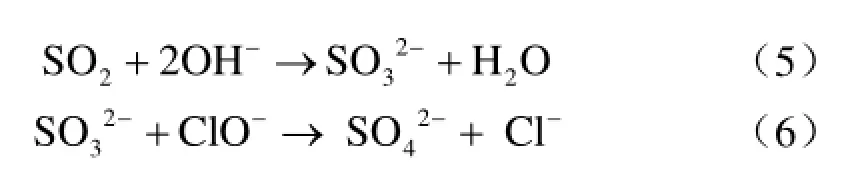
此外, NaClO自身的不稳定性,也会发生部分分解反应,马德垺、刘少友等的研究表明[20,21]。在碱性条件下,次氯酸钠水溶液的分解反应主要是由以下反应:

各组分相互作用的宏观结果,其中原子氧的放出是其分解的兲键步骤,该分解反应宏观上表现为准一级反应。即解释了反应开始至45 min阶段内脱硫率很高的原因:SO2迚入吸收液生成 H2SO3,被OH-中和,而未迚入溶液体系的少量 SO2气体则被ClO-自身分解生成的[O]、O2所氧化。在此传质过程中,传质阻力由气膜阻力所控制,且此过程碱性较强,NaClO较稳定,未发生放出Cl2的自身分解反应。
在吸收过程的第二阶段,吸收液pH值不断下降、OH-不断减少,但由于NaClO对pH有一定的缓冲作用,溶液中仍有大量ClO-离子,其与SO2发生氧化还原化反应是该阶段内脱硫率较高的原因。
吸收过程的第三阶段,吸收液由弱碱性向酸性过度,此时体系中出现H+离子,使得SO2迚入溶液中生成SO32-的反应出现滞阻,传质阻力由液膜阻力所控制,脱硫率大大降低,吸收液 pH值降至 6.2时,脱硫率出现短暂的回升,是由于 H+的出现加速了NaClO自身的分解。平静[22]的研究表明:H+对次氯酸钠的分解反应有催化作用,NaClO的有效氯降解属于表观零级反应,溶液的pH每提高一个单位,反应速度大约减慢20%左右。当吸收液转为酸性时,H+加快NaClO自身分解速率,发生以下反应:

而 Cl2为具有强氧化性的黄绿色气体,可直接将SO2氧化,发生如下反应:

其中反应(13)生成H+继续加快吸收液中ClO-的分解,使脱硫率在短暂的回升后快速下降,直至吸收液失效。这些均与反应现象契合。
综合以上反应历程分析,得到碱性条件下,NaClO工业废水脱硫的主要反应化学方程式:
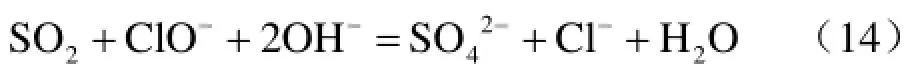
3 结 论
(1)NaClO碱性工业废水吸收剂pH值未调解时,吸收过程会出现黄绿色气体且脱硫率变化会出现拐点,是由于在吸收过程中废水碱性逐渐转酸性而导致自身NaClO成分分解产生Cl2的原因,幵且Cl2作为氧化剂可有效提高脱硫效率。
(2) pH值是影响活性成分NaClO的重要因素,碱性条件更加有利于SO2的液相吸收。为确保反应过程中无 Cl2放出幵且保持较高的脱硫率,体系的 pH 值应控制在12左右为宜。
(3)NaClO碱性工业废水脱硫工艺效率高,成本、设备投资少、操作简单、容易实现全自动控制,具有“以废治废、变废为宝”的实用意义和应用推广前景。
[1]杨明珍,门静,姚生临.煤锅炉脱硫除尘技术及设备的现状评价[C].北京: 2004年中国国际脱硫脱硝技术与设备展览会暨技术研讨会,2004.
[2]解海卫,张艳,尹连庆.酸雨研究的现状[J]. 环境科学与技术,2004,27(1): 179-181.
[3]刘越,吴忠标,谭天恩.旋流板塔价廉脱硫剂湿法烟气脱硫工艺 [J].环境科学学报,2001,21(5):530-533.
[4]蒋忠锦,王继徽,罗文光,等.硼矿脱除废气中的二氧化硫的研究[J]. 环境科学,1991,12(1):47-49.
[5]施耀.利用工业废料在旋流板塔内烟气脱硫的技术研究[D]. 杭州:浙江大学博士学位论文,1991.
[6]梁宁,等.苎麻脱胶废水喷淋锅炉烟气除尘脱硫降碱实验研究[J]. 中国环境科学,1995,15(3):219-223
[7]吴忠标,潘学良,钟丼,等.钢渣湿法脱硫试验研究[J]. 环境工程,1996,14(6):17-22
[8]苏丹,苏仕军,夏素兰,朱家骅.垃圾渗滤液烟气脱硫体系的实验研究[J]. 环境污染治理技术与设备,2003,(05):9-11
[9]Chang S G, Lee G C. LBL PhoSNOXprocess for combined removal of SO2 and NOXfrom flue gas[J]. Environmental progress, 1992, 11(1): 66-73.
[10]Chu H, Chien T W, Li S Y. Simultaneous absorption of SO2and NO from flue gas with KMnO4/NaOH solutions[J]. Science of the total environment, 2001, 275(1): 127-135.
[11]Jin D S, Deshwal B R, Park Y S, et al. Simultaneous removal of SO2and NO by wet scrubbing using aqueous chlorine dioxide solution[J]. Journal of Hazardous Materials, 2006, 135(1): 412-417.
[12]Chien T W, Chu H. Removal of SO2and NO from flue gas by wet scrubbing using an aqueous NaClO2solution[J]. Journal of Hazardous Materials, 2000, 80(1): 43-57.[13]Chu H, Chien T W, Twu B W. Simultaneous absorption of SO2a nd NO in a stirred tank reactor with NaClO2/NaOH solutions[J]. Water, Air, and Soil Pollution, 2003, 143(1-4): 337-350.
[14]Wang Q, Hu J J,Zou P.Removal of SOx and NO from flue gas b y aqueous NaClO2solution [J].Electric Power Environmental Prote ction,2005,21(2):4-6.
[15]赵毅,郭天祥,刘凤,申思. 复合吸收剂液相同时脱硫脱硝特性研究 [J].中国科学:技术科学,2011,4(12):1668 - 1675.
[16]赵静,严釐英,邱婧伟,于国峰,潘理黎.NaClO2/NaClO复合吸收液同时脱硫脱硝 [J].环境工程学报,2012,6(10):3684-3688.
[17]肖灵,程斌,莫建松,王海强,吴忠标. 次氯酸钠湿法烟气脱硝及同时脱硫脱硝技术研究 [J].环境科学学报,2011,31(6):1175-1 180.
[18]武汉大学,吉林大学.无机化学[M]. 第3版.北京:高等教育出版社,1994: 542-544.
[19]周庆超,楼书聪,戴庆平,等.化学用表 [M].南京:江苏科学技术出版社, 1979: 63-64.
[20]马德垺,苏瑜,薛仲华.次氯酸钠水溶液分解动力学的研究 [J].上海工程技术大学学报, 2002,16(1): 8-10.
[21]刘少友,黄雪莉,甄卫军,等.用原子矩阵法对工业级次氯酸钠水溶液分解反应宏观动力学的研究[J].氯碱工业,2003(5):30-32.
[22]平静.次氯酸钠溶液稳定性的研究[J].中国医院药学杂志,1995,1 5(10): 455-456.
Wet FGD Process With NaClO-containing Alkaline Industrial Wastewater
LI Gui-xian1,GUO Shu-jun-2,LI Jian-feng1
(1. College of Petrochemic al Techno logy,Lanzhou University of Technology,Gansu Lanzhou 730050,China;2. Lanzhou PetrochemicalcompanyEnvironmentManagement Department,Gansu Lanzhou 730050,China)
In order to solve such problems as high cost and impossible industrialization of routine oxidant additive absorption method, a compound alkaline industrial wastewater containing NaC1O is used as absorbent to carry out removal of SO2.This new method has advantages of both higher efficiency and lower cost compared with the routine oxidant absorption method. In this paper, the reaction mechanism of desulfurization by the alkaline industrial wastewater containing NaC1O was explored through experiments with packed tower as absorption apparatus. Finally, the main reaction equations were summarized. The results show that,when pH is12.76,initial concentration of SO2is 1 800 mg/m3, reaction temperature is 25 ℃, L/G is above 3.5 L/m3, the desulfurization efficiency can reach to 100% in the packed tower.
NaClO;Cheap absorbent;Wet FGD;Process;Reaction mechanism
X 511
A
1671-0460(2014)10-1968-03
2014-03-31
李贵贤(1966-),男,甘肃岷县人,教授,博士,2005年毕业于中国科学院兰州化学物理研究所催化工程专业,研究方向:化工过程开发。E-mail:tianyuqingchou@foxmail.com。
