响应面法优化蛹虫草菌固体发酵五味子药渣发酵条件
2014-02-21贺晓玉李英伦
贺晓玉,罗 杰,李英伦
(四川农业大学动物医学院,四川雅安625014)
随着中医药事业的迅速发展,中药渣废弃量日益增加。这些药渣被视为废物,采取堆放、填埋、焚烧等方式处理,不仅资金投入大,污染环境,更是一种极大的资源浪费[1];更为严重的是,部分中药药渣再次进入药材市场,以次充好,真伪难辨,损害药品生产企业以及消费者的利益。中药主要有植物、动物以及部分矿物药,其中植物类药材占87%以上。植物类中药渣中含有大量粗纤维、粗蛋白、粗脂肪、糖类、氨基酸等营养物质,以及钙、镁、铁、磷等多种无机元素[2];而且由于中药提取工艺比较单一,许多药用活性成分仍残留在药渣中[3]。据报道,中药制药过程中有效成分的提取率一般为30%~70%,大量活性成分仍残留在药渣中[4]。
目前,有关中药渣综合利用技术的研究很多,例如作为食用菌(平菇,香菇等)的培养基[5-6]、栽培蔬菜[7]、制造絮凝剂或吸附剂处理废水[8]、用作动物饲料添加剂[9-11],发酵生产乙醇[12]等,但大多属于探索性研究,真正能够投入实际应用的技术不多,能够大规模的消化中药渣,变废为宝,减轻环境压力的技术更少。
鉴于此,本实验采用药用真菌双向固体发酵技术[13],以蛹虫草菌为发酵菌种,发酵五味子药渣,并采用响应面法优化发酵条件,旨在寻求一条综合利用五味子药渣的有效途径,为中药渣的回收再利用提供参考。
1 材料与方法
1.1 材料与仪器
蛹虫草菌[Cordycepsmilitaris(L.)Link] 山东省东方虫草科技园提供,并经中国科学院微生物研究所鉴定;五味子药渣 雅安三九药业有限公司提供;虫草素标准品(批号:MUST-11072701) 四川省药品检验所,含量≥98%;甲醇 北京京科瑞达生物科技有限公司,色谱纯;葡萄糖、重蒸酚、浓硫酸 国药集团化学试剂有限公司,均为分析纯。
HZS-H水浴振荡器 哈尔滨市东明医疗器械厂;SPX型生化培养箱 宁波东南仪器有限公司; LDZX-50KBS立式压力蒸汽灭菌器 上海申安医疗器械厂;SHB-3循环多用真空泵 郑州杜甫仪器厂; HH-4数显恒温水浴锅 国华电器有限公司; UV-2000型紫外可见分光光度计 优尼柯上海仪器有限公司;高效液相色谱仪(LC-2010C HT) SHIMADZU CORPORATION;pHS-25型酸度计 成都方舟科技开发公司。
1.2 实验方法
1.2.1 药渣处理 将五味子药渣置于烘箱中,50℃烘干至恒重,粉碎过20目筛,备用。
1.2.2 培养基制备 菌种活化培养基(PDA):马铃薯20%(煮后过滤取汁),葡萄糖2%,酵母膏0.5%,蛋白胨0.5%,KH2PO40.2%,MgSO40.1%,琼脂2%,蒸馏水1000m L,pH自然[14]。液体菌种培养基:葡萄糖2%,酵母膏0.5%,蛋白胨0.5%,KH2PO40.2%,MgSO40.1%,蒸馏水1000m L,pH自然[15]。
1.2.3 菌种活化 在超净工作台上按无菌操作,将蛹虫草菌种接种到PDA斜面培养基上,置于生化培养箱中25℃避光培养6d,制成活化菌种[16]。
1.2.4 种子液制备 在装有200m L液体种子培养基的500m L三角瓶中,放入6粒直径为3~6mm的玻璃珠,按照无菌操作,接入大小约为5mm×5mm的经活化后的蛹虫草斜面菌块,25℃,120r/min振荡避光培养6d,制成种子液[17]。
1.2.5 单因素实验确定因素水平范围 将发酵基础条件定为:水料比[蒸馏水体积(m L):五味子药渣重量(g)]为2m L/g、基质(五味子药渣)重量为40g、接种量[种子液体积(m L):五味子药渣重量(g)]为10%、发酵温度为25℃、发酵时间为9d[18]。在此基础条件下,分别考察各因素的变化对发酵产物中虫草素和多糖含量的影响。按照以下因素水平设计实验:水料比:0.5、1、1.5、2、2.5、3m L/g;基质重量:10、20、30、40、50、60g;接种量:5%、10%、15%、20%、25%、30%、35%;发酵温度:20、22、24、26、28、30℃;发酵时间:5、7、9、11、13、15、17、19d。上述各处理组均用虫草瓶盛装培养基,并按照无菌操作方法,接种蛹虫草菌种子液后,置于生化培养箱中避光培养。发酵终止后将各组发酵产物(整个培养基质)置于烘箱中,50℃下烘干至恒重,粉碎,并充分混匀,用于检测虫草素及多糖含量。
1.2.6 响应面法优化发酵条件 在单因素实验的基础上,采用Box-Benhnken(BBD)实验设计,以水料比(A)、基质重量(B)、接种量(C)、发酵温度(D)4个显著性因素为考察变量,以发酵产物中虫草素含量为响应值(Y),进行4因素3水平实验,实验因素及水平见表1。并应用Design-expert V8.0.5b软件进行数据分析,建立数学回归模型确定最佳发酵条件。
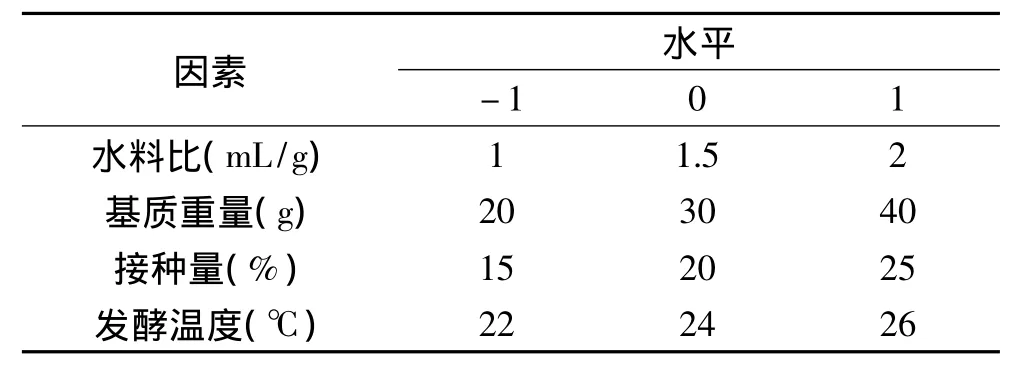
表1 Box-Benhnken实验设计因素及水平Table1 Factor-levels for Box-Benhnken
1.2.7 虫草素及多糖含量测定 多糖含量测定:称取5g经烘干后的发酵产物样品,采用水热回流提取法提取多糖,即加10倍量水,80℃热回流提取1.5h,重复3次。合并提取液,过滤、浓缩至1∶1(g/m L),加3倍量的分析纯乙醇沉淀,离心,倾出上清液,再用乙醇洗沉淀2次,离心,低温干燥,即得多糖粗品[19]。采用浓硫酸-苯酚法[20]测定多糖含量,以分析纯葡萄糖为多糖标准品绘制标准曲线,得回归方程Y= 0.0078X-0.061(R2=0.9992),根据该方程计算发酵产物中多糖含量。
虫草素含量测定:称取2.5g经烘干后的发酵产物样品,加入90%甲醇50m L,70℃ 回流提取40m in后,过滤取滤液,再加入90%甲醇定容至50m L。采用高效液相色谱法(HPLC)测定虫草素含量,色谱条件为:Diamonsil C18柱(4.6mm×150mm,5μm),以磷酸盐缓冲液(pH6.5)(取0.01mol/L磷酸二氢钠68.5m L与0.01mol/L磷酸氢二钠31.5m L,混合)-甲醇(17∶3)为流动相,流速为1m L/m in,检测波长为260nm,进样量为10μL,柱温为30℃[21-22]。以虫草素标准品绘制标准曲线,得回归方程Y=34473X+34135(R2=0.9988),根据该方程计算发酵产物中虫草素含量。
1.2.8 数据统计与分析 本实验数据均为5个平行样的平均值,采用 Excel 2003及 Design Expert V8.0.5b数据分析软件分析。
2 结果及分析
2.1 单因素实验结果及分析
由图1a~图1e可以看出,水料比、基质重量、接种量、发酵温度4个因素对蛹虫草菌固体发酵五味子药渣产物中虫草素含量的影响较大(成倍增减);而各因素对发酵产物中多糖含量的影响相对较小(变化不大),这是由于蛹虫草菌在生长过程中一方面要分解利用培养基中多糖,另一方面又代谢产生多糖的缘故,进而发酵基质中多糖含量比较稳定。
由图1a可知,水料比对虫草素含量的影响很大,当水料比为1.5m L/g时,发酵产物中虫草素含量最高。水料比在0.5~1.5m L/g范围内,发酵产物中虫草素含量迅速增加;当水料比高于1.5m L/g时,虫草素含量显著降低,可能是由于过高的含水量导致培养基黏度增加,多孔性降低,减少了培养基质内气体的交换,造成局部缺氧,不利于蛹虫草菌对中药渣的降解利用。
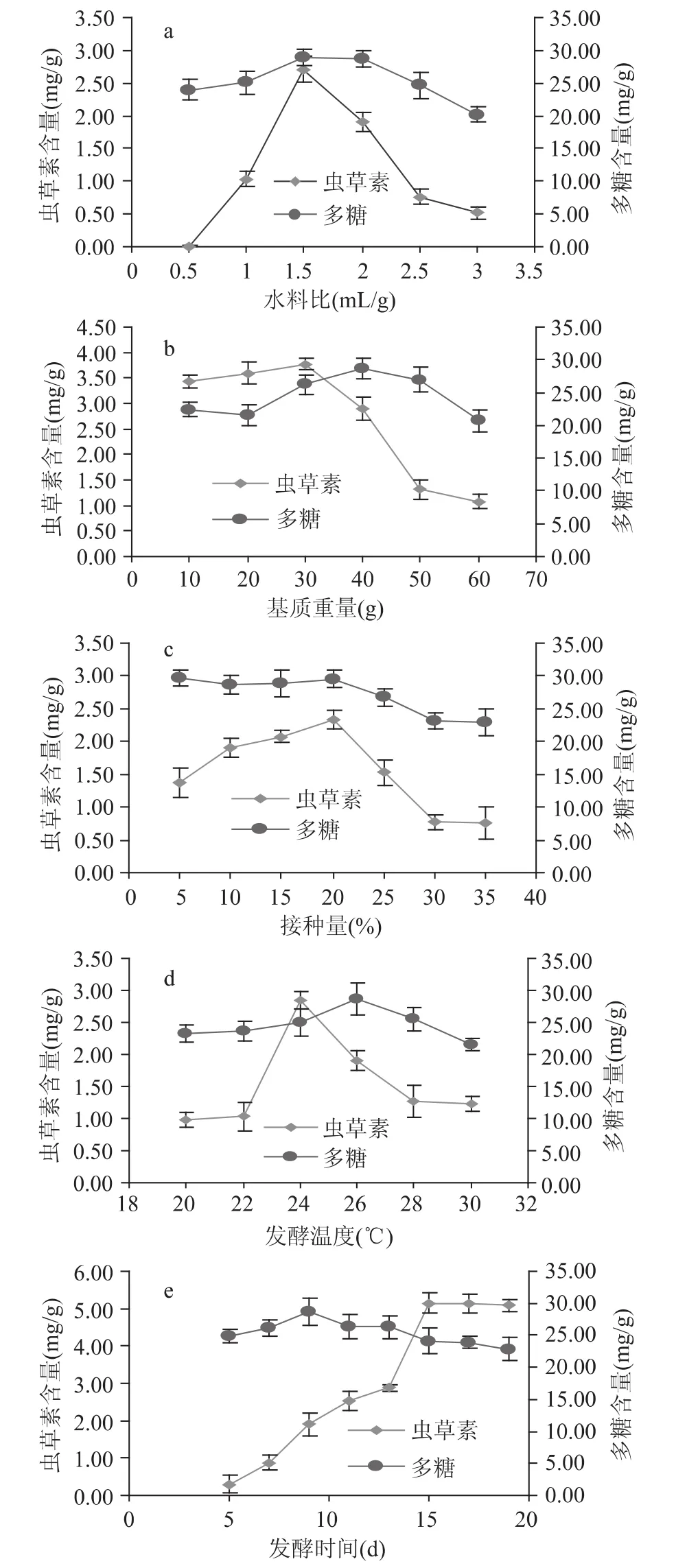
图1 各因素对发酵产物中虫草素及多糖含量的影响Fig.1 Effects of various factors on the production of cordycepin and polysaccharide
由图1b可知,当基质重量为30g时,发酵产物中虫草素含量最高。当基质重量低于30g时,虫草素含量降低,原因在于培养基中营养物质较少,不能满足蛹虫草菌的生长需要;当基质重量高于30g时,虫草素含量显著降低,究其原因可能是培养基厚度增加,导致培养基底层缺氧,蛹虫草菌不能渗入培养基底部生长。
由图1c可知,当接种量为20%时,发酵产物中虫草素含量最高。接种量在5%~20%范围内,虫草素含量随着接种量的增加而增多,上升趋势明显。当接种量超过20%时,虫草素含量明显下降,原因在于菌量较多时,对营养物质的需求也多,而培养基中的营养物质有限,当生长到一定程度后就不能继续满足微生物的正常生长了,同时由于接种量增多,过早进入衰亡期,出现自溶现象,使菌株的正常生长繁殖受到抑制。
由图1d可知,当培养温度为24℃时,发酵产物中虫草素含量最高。温度影响酶的活性,从而影响蛹虫草菌对培养基中营养物质的分解利用。温度太高或者太低,都不利于蛹虫草菌生长繁殖。
由图1e可知,当发酵时间为15d时,发酵产物中虫草素含量最高。之后,虫草素含量几乎不变,原因在于随着发酵时间的延续,培养基质中营养物质越来越少,以致不能维持蛹虫草菌生长,因此发酵时间定为15d。
2.2 响应面法确定最佳发酵条件
2.2.1 响应面实验设计及结果 根据Box-Benhnken实验设计原理,结合上述单因素实验结果,将发酵时间固定为15d,选取水料比(A)、基质重量(B)、接种量(C)、培养温度(D)四个显著因素为考察变量,以发酵产物中虫草素含量(Y)为响应值,进行四因素三水平实验设计,实验设计方案及结果见表2。
2.2.2 模型的建立及其显著性检验 利用 Design Expert V8.0.5b软件对表2实验数据进行回归分析,得到回归方程为Y=4.76+0.89A+0.32B+0.31C+0.13D+0.23AB-0.09AC+0.42AD+0.26BC+0.24BD +0.091CD-1.05A2-0.70B2-0.37C2-0.43D2(R2= 0.9799,Ad j-R2=0.9598)。回归方程的方差分析结果见表3。由表3可知,模型(p<0.0001)极显著,相关系数R2=0.9799,说明该模型拟合度好,实验误差小;失拟项(p=0.372>0.05)不显著,表明未知因素对实验结果干扰小。因此,可用此模型来分析和预测蛹虫草菌发酵五味子药渣的发酵条件。
2.2.3 蛹虫草菌发酵五味子药渣最佳发酵条件的预测及验证实验 通过回归模型预测分析,在实验的因素水平范围内,最佳发酵条件:水料比为2m L/g、基质重量为36.68g、接种量为23.15%、发酵温度为25.78℃,模型预测发酵产物中虫草素含量为5.0962mg/g。考虑到实验操作的可行性,将此最佳发酵条件稍作修改:水料比为2m L/g、基质重量为37g、接种量为23%、培养温度为26℃。在此条件下进行重复验证实验,10个重复验证实验所得发酵产物中虫草素含量平均值为5.1202mg/g,与模型预测值相差0.47%。可见,模型预测值和实测值之间具有良好的拟合性,从而响应面法优化的发酵条件可为今后蛹虫草菌发酵五味子药渣生产和开发利用提供必要的理论依据。
3 结论与讨论
3.1 由于实验条件限制,本实验仅考察了水料比、基质重量、接种量、发酵温度四个主要因素对蛹虫草菌固体发酵五味子药渣的影响。各因素对发酵产物中虫草素含量的影响均较大,响应面法优化得出最佳发酵条件为:水料比2m L/g,基质重量37g,接种量23%,发酵温度26℃。在最佳发酵条件下发酵所得产物中虫草素含量为5.1202mg/g。这是因为蛹虫草菌在生长代谢过程中产生多种酶,如纤维素酶、半纤维素酶、蛋白酶等,可分解利用五味子药渣中大分子营养物质[23]生长繁殖,进而产生虫草素。经测定,发酵前五味子药渣中多糖含量为22.95mg/g,而发酵产物中多糖含量为28.68mg/g,比发酵前的五味子药渣高24.97%,这可能是蛹虫草菌产生了虫草多糖,或是五味子药渣经蛹虫草菌产生的各种分解酶作用后,残留其中的多糖溶出,亦或是二者相加的结果。
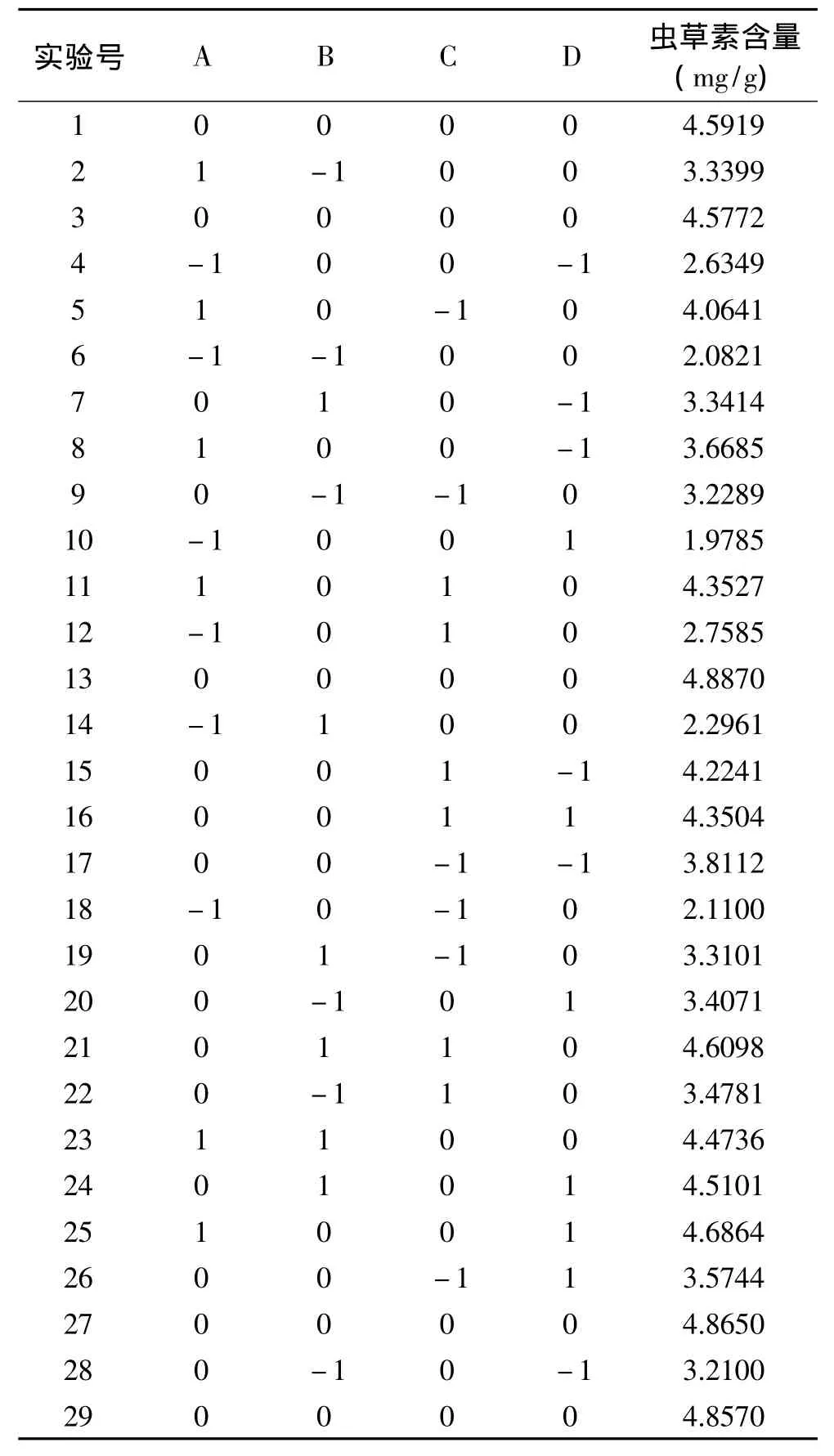
表2 Box-Benhnken实验设计方案及结果Table2 Results of four factors,Box-Benhnken experimental design
3.2 五味子中含有木脂素、多糖、挥发油等多种活性成分,但目前对五味子的利用主要集中在木脂素,其他药用活性成分仍部分残留在药渣中。蛹虫草菌产生的纤维素酶、半纤维素酶、蛋白酶等,可使五味子药材细胞破裂,促使活性成分更多的溶出,而大部分这类物质是不被蛹虫草菌生长所利用的,如五味子木脂素等,这些物质便在发酵基质中富集[24]。本实验仅研究了发酵前后培养基质中虫草素和多糖的含量变化,五味子有效活性成分,如木脂素等的含量变化有待进一步研究。

表3 回归模型的方差分析Table3 Analysis of variance(ANOVA) for the quadratic polynomialmodel
3.3 虫草素具有抗菌、抗病毒、抗炎、抗肿瘤等广泛的生物学活性[25],而多糖亦是一种作用广泛的免疫促进物质。因此,发酵产物有望用于动物保健药或治疗药物的开发、提取分离虫草素等,具有广阔的应用前景。将五味子药渣用作蛹虫草菌固体发酵培养基,提高了五味子药渣的利用价值,为中药渣的回收再利用提供了参考。
[1]谭显东,王向东,黄健盛,等.中药渣资源化技术研究进展[J].中成药,2010,32(5):847-849.
[2]陈缤,贾天柱.中药渣的综合利用[J].中成药,2005,27 (10):1203-1205.
[3]马逊风,马宏军,唐占辉,等.中药渣剩余成分分析及利用途径研究[J].东北师大学报:自然科学版,2006,36(2): 108-111.
[4]周萍,王成军,邓励.黄芪药渣中黄芪甲苷含量的测定[J].安徽农业科学,2011,39(13):7773-7774.
[5]王建芳,徐春,徐萌萌,等.利用香菇发酵中药废渣提高利用价值的研究[J].四川大学学报:自然科学版,2007,44(2): 451-454.
[6]吴焱鑫,冀彦锡,任昂.中药渣栽培食(药)用真菌研究的概述[J].中国食用菌,2011,30(4):3-6.
[7]唐懋华,成维东.中药渣基质对蔬菜育苗及产量的影响[J].江苏农业科学,2005,4:81-82.
[8]罗鸿.中药渣絮凝剂处理造纸废水的研究[J].四川环境,1998,17(3):24-26.
[9]李肖梁,余东游,钱娅,等.“十全大补”药渣对肥育猪生长、胴体特性和肉质的影响[J].浙江大学学报:农业与生命科学版,2006,32(4):433-437.
[10]陈晓明,李肖梁,汤丽萍,等.中草药渣对断奶仔猪生长、肠道菌群和免疫的影响[J].浙江农业学报,2007,19(1): 50-54.
[11]李艳军,苏双良,倪俊,等.藿香正气药渣对泌乳獭兔生产性能的影响[J].中国饲料,2011,11:38-39,42.
[12]张英,吴献跃,李馨,等.中药药渣同步糖化发酵生产乙醇的工艺研究[J].中成药,2013,35(9):2053-2056.
[13]庄毅,洪净.药用真菌双向性固体发酵工程与中成药药渣再开发[J].中国中药杂志,2006,31(22):1918-1919.
[14]王英臣.关于蛹虫草菌多糖发酵及其培养基的研究[J].中国酿造,2005,10:29-31.
[15]徐方旭,刘诗扬,王升厚.蛹虫草液体菌种培养基的优化[J].中草药,2011(4):199-201.
[16]Mina M,Shonkor K D,Shinya F,et al.Production of cordycepin by a repeated batch culture of a Cordyceps militaris mutant obtained by proton beam irradiation[J].Journal of Bioscience and Bioengineering,2011,111(1):55-60.
[17]康超,文庭池,康冀川,等.不同培养条件和前体对蛹虫草液体发酵产虫草素的影响[J].菌物学报,2012,31(3): 389-397.
[18]朴美子,巴媛媛,王永显,等.北冬虫夏草米固态发酵最佳工艺[J].食品与生物技术学报,2011,30(2):302-305.
[19]陈小丽,巫光宏,古青霞,等.正交法优化蛹虫草子实体多糖的提取工艺[J].安徽农业科学,2010,38(28):15583-15585.
[20]来永斌,王琦,孙月.蛹虫草多糖含量的测定与分析[J].中成药,2001,23(7):517-518.
[21]Fan D D,Wang W,Zhong J J.Enhancement of cordycepin production in submerged cultures of Cordyceps militaris by addition of ferrous sulfate[J].Biochemical Engineering Journal,2012,60:30-35.
[22]Shonkor K D,Mina M,Masanori H,et al.Optimization of culture medium for cordycepin production using Cordyceps militaris mutant obtained by ion beam irradiation[J].Process Biochemistry,2010,45:129-132.
[23]陈荣华,吴向阳,仰榴青,等.五味子醇提残渣中粗多糖的体外抗氧化活性研究[J].时珍国医国药,2009,20(6):1512-1513.
[24]焦巧芳.中药渣微生物转化利用菌种筛选研究[D].杭州:浙江师范大学,2010.
[25]康冀川,康超,文庭池,等.虫草素药理学研究进展[J].菌物学报,2011,30(2):192-197.
