不同饵料模式与投喂方式对中间球海胆性腺营养成分的影响
2014-02-17丁玉龙丁君丁文君常亚青
丁玉龙,丁君,丁文君,常亚青
(大连海洋大学农业部北方海水增养殖重点实验室,辽宁大连116023)
中间球海胆Strongylocentrotus intermedius又称虾夷马粪海胆,1989年由大连海洋大学从日本引入中国,因其性腺饱满、品质上佳,深受消费者喜爱。中间球海胆作为中国主要的水产养殖品种之一,其性腺中富含氨基酸、β-胡萝卜素和ω-3族、ω-6族多不饱和脂肪酸,是一种营养价值和药用价值较高的海洋经济生物。氨基酸作为维持生命活动的重要物质,不仅具有重要的生理功能,而且在食物呈味上发挥重要作用[1]。海胆性腺中的β-胡萝卜素含量与性腺的色泽直接相关,不仅能改善海胆性腺的颜色和品质[2-3],还可以提高动物非特异免疫机能[4],在动物营养和生理功能方面发挥重要作用。脂肪酸作为海胆性腺中主要的营养成分,不仅可以促进海胆的胚胎发育及幼体早期发育[5],而且对人类心血管疾病等有较好的防治效果[6-7]。饵料是影响海胆性腺发育的重要因素[8-9],研究不同饵料模式和投喂方式对海胆性腺中氨基酸、β-胡萝卜素和脂肪酸积累规律的影响对指导中间球海胆健康养殖及利用具有一定意义。
目前,有关海胆性腺的研究主要集中在海胆性腺营养成分及营养代谢等方面。Liyana-Pathirana等[10]、Kaneko 等[11]研究了季节变化和人工饲料对海胆性腺中氨基酸组成及口味的影响。Osako等[12]研究了紫海胆Anthocidaris crassispina性腺发育过程中游离氨基酸组成的差异。王丽梅等[13]研究了中间球海胆性腺氨基酸的组成。McBride等[3]研究了β-胡萝卜素在巨紫球海胆S.franciscanus体内的吸收和积累以及食物中β-胡萝卜素含量对性腺颜色的影响。Suckling等[14]研究了人工饲料对海胆性腺颜色及生物量的影响。González-Durán等[15]研究了饵料中脂质含量对绿海胆S.droebachiensis性腺中脂肪酸组成及脂类代谢的影响。Castell等[16]研究了饵料中脂质对绿海胆稚胆脂肪酸组成及脂类代谢的影响。Cook 等[17]、Barberá 等[18]对海胆性腺中脂肪酸组成进行了研究分析。
海带作为海胆的主要饵料,受其分布和生长周期的限制,饵料成本较高,在很大程度上制约了海胆养殖业的发展。南瓜、胡萝卜富含类胡萝卜素,价格低廉且易于获得,以南瓜、胡萝卜为饵料,进行海胆营养成分的研究目前尚未见报道。本研究在前期预试验的基础上,以南瓜、胡萝卜替代海带作为海胆饵料,研究了不同饵料及投喂方式对中间球海胆氨基酸、β-胡萝卜素和脂肪酸含量的影响,以期找到提高海胆性腺中氨基酸、β-胡萝卜素和脂肪酸含量的饵料模式和投喂方式,为海胆的健康养殖提供一定的参考。
1 材料与方法
1.1 材料
试验用海胆为农业部北方海水增养殖重点实验室培育的2龄健康中间球海胆,壳径为 (46.57±1.87)mm,体质量为 (44.27 ±4.91)g。
1.2 方法
1.2.1 试验设计
(1)饵料模式试验。试验设4种模式:M1(对照)组投喂海带,M2组投喂海带+贻贝 (比例约2∶1),M3组投喂南瓜,M4组投喂胡萝卜。试验周期为150 d。
(2)投喂方式试验。试验设3种模式:对照组投喂海带150 d,RM1组投喂南瓜75 d后投喂海带75 d;RM2组投喂胡萝卜75 d后投喂海带75 d。
每组试验均设3个重复,每个重复10枚海胆,共计180枚。
试验开始前将试验海胆于实验室暂养一周。整个试验过程中保持各组环境条件与养殖密度相同,试验期间,水温为12.47~19.01℃,pH 为8.06±0.10,过量投喂。试验时间为2012年12月16日—2013年5月15日。
1.2.2 取样与测量 试验结束时,解剖各试验组海胆并测量其性腺营养成分指标。
氨基酸含量委托谱尼测试科技股份有限公司进行测定,在每种饵料模式和投喂方式下分别测定雌、雄海胆性腺混合样品中氨基酸的含量;采用分光光度法测定 β-胡萝卜素含量[19];参照GB5413.27—2010中的方法测定脂肪酸含量;参照沈妍等[20]的方法测定一般营养成分含量。
个体平均β-胡萝卜素含量的计算公式为
个体平均β-胡萝卜素含量 (mg)=β-胡萝卜素含量 (mg/100g)×个体平均性腺湿质量 (g)。
1.3 数据处理
利用SPSS 19.0软件,分别以不同饵料模式和投喂方式为影响因素,对各测量数据作单因素方差分析,并对不同饵料模式及投喂方式间的差异作Duncan多重比较,显著性水平设为0.05。
2 结果与分析
2.1 不同饵料模式对中间球海胆性腺营养成分及氨基酸、β-胡萝卜素、脂肪酸含量的影响
2.1.1 一般营养成分 从表1可见:M3、M4组海胆性腺的总糖含量显著高于 M1、M2组 (P<0.05);M1、M2组的水分含量显著高于M3、M4组(P<0.05);性腺中粗蛋白质、粗脂肪和灰分含量在4种饵料模式间均有显著性差异 (P<0.05),M2组的粗蛋白质粗脂肪和灰分含量均最高。
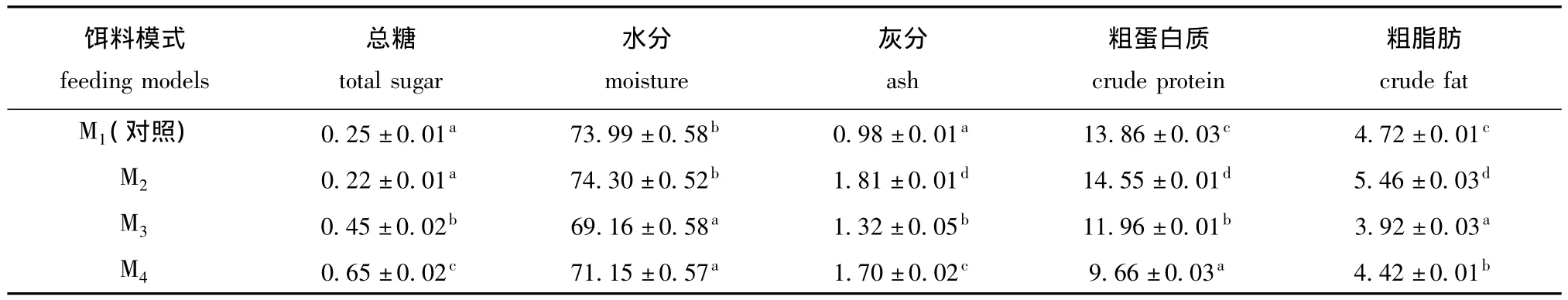
表1 不同饵料对中间球海胆性腺一般营养成分含量的影响 (以鲜基计)Tab.1 Effects of different diets on the approximate composition in gonad of sea urchin Strongylocentrotus intermedius w/%
2.1.2 氨基酸含量 本研究中,以测定的16种氨基酸总量作为蛋白质氨基酸的相对总量。
从表2可见:雌、雄海胆性腺中氨基酸总量(TAA)和必需氨基酸总量 (EAA)均为M2组最高,M4组最低;雌、雄海胆性腺中EAA占16种TAA的百分比 (EAA/TAA)均为M2组最高,M4组最低,且雌性高于雄性;雌、雄海胆性腺中鲜味氨基酸 (FAA)含量均为M1组最高,M4组最低,且雄性高于雌性;雌、雄海胆性腺中FAA/TAA均为M4组最高,M2组最低;4种饵料模式下海胆性腺中氨基酸含量均为甘氨酸最高。
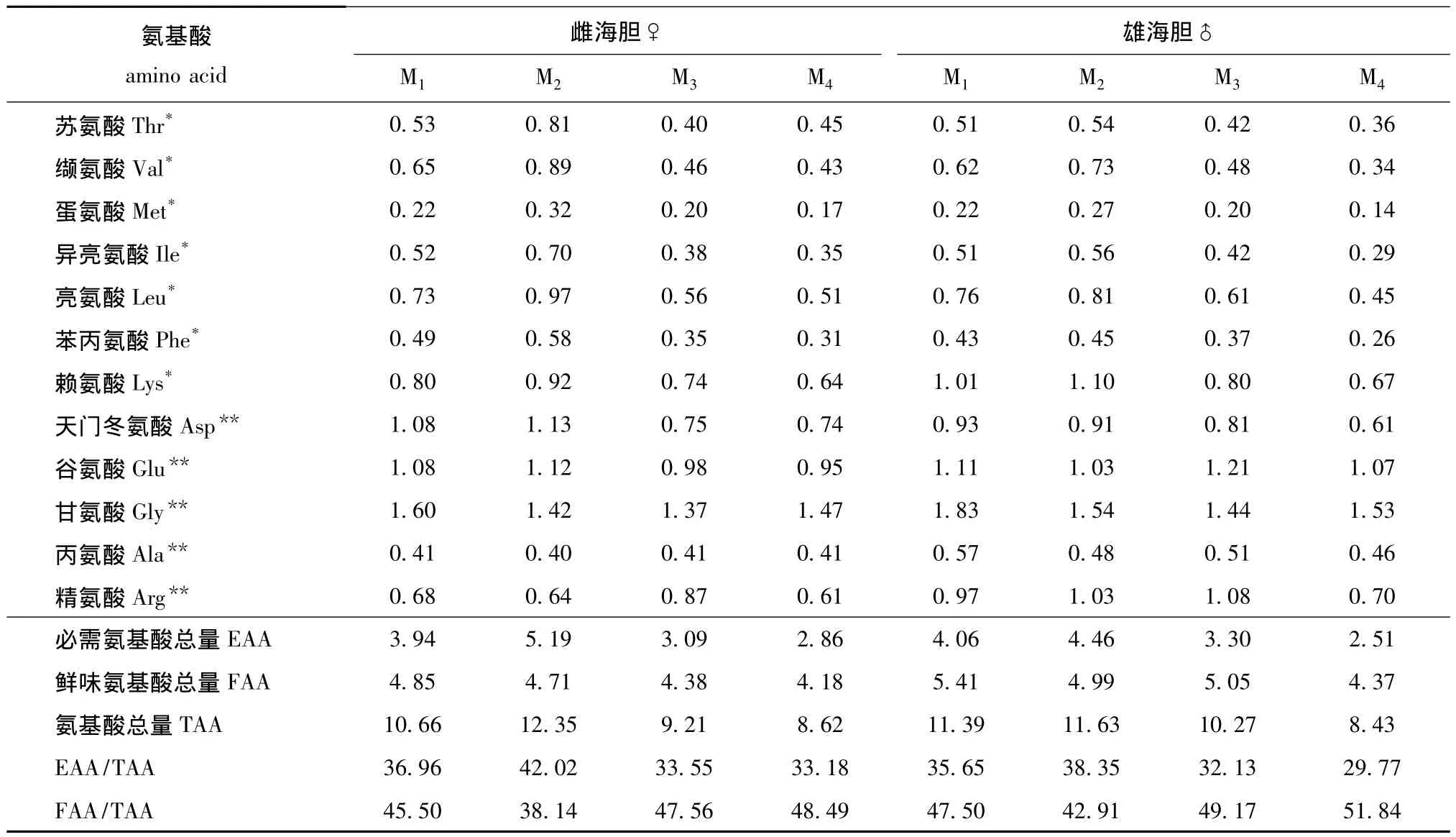
表2 不同饵料对中间球海胆性腺中氨基酸含量的影响Tab.2 Effects of different diets on the contents of amino acid in gonad of sea urchin Strongylocentrotus intermedius %
2.1.3 β-胡萝卜素含量及个体平均β-胡萝卜素含量 从图1可见,雌海胆性腺中M2组的β-胡萝卜素含量最高,为 (0.022 01±0.001 41)%,与M1组无显著性差异 (P>0.05),二者均显著高于其他两组 (P<0.05);雄海胆性腺中M1组β-胡萝卜素含量最高,为 (0.025 94±0.007 39)%,与M2组无显著性差异 (P>0.05),二者均显著高于其他2组 (P<0.05)。
从图1还可见:雌海胆中M2组个体平均β-胡萝卜素含量最高,为 (4.66±0.38)mg,与M1组无显著性差异 (P>0.05),二者均显著高于其他2组 (P<0.05);雄海胆中M2组个体平均β-胡萝卜素含量最高,为 (5.03±0.64)mg,与M1组无显著性差异 (P>0.05),二者均显著高于其他2组 (P <0.05)。
2.1.4 多不饱和脂肪酸含量 从表3可见:雌海胆性腺中M3组多不饱和脂肪酸 (PUFA)含量显著高于其他3组 (P<0.05),雄海胆性腺中PUFA含量在4组间均无显著性差异 (P>0.05);雌海胆性腺中M3组DHA+EPA含量显著高于其他3组(P<0.05),雄海胆中 M1组 DHA+EPA含量最高,显著高于 M3、M4组 (P<0.05);雌、雄海胆性腺中M3组EPA含量均显著高于M1、M2组(P<0.05);雌海胆性腺中M3组DHA含量最高,M4组最低,二者有显著性差异 (P<0.05),雄海胆中M1组DHA含量最高,且4组间均有显著性差异 (P <0.05)。
2.2 不同投喂方式对中间球海胆性腺营养成分及氨基酸、β-胡萝卜素、脂肪酸含量的影响
2.2.1 一般营养成分 从表4可见:对照组总糖含量显著低于RM1和RM2组 (P<0.05);水分含量3组间无显著性差异 (P>0.05);粗蛋白质及灰分含量3组间有显著性差异 (P<0.05),且RM1组蛋白质含量最高;对照组粗脂肪含量与RM1组无显著性差异 (P>0.05),二者均显著高于RM2组 (P <0.05)。
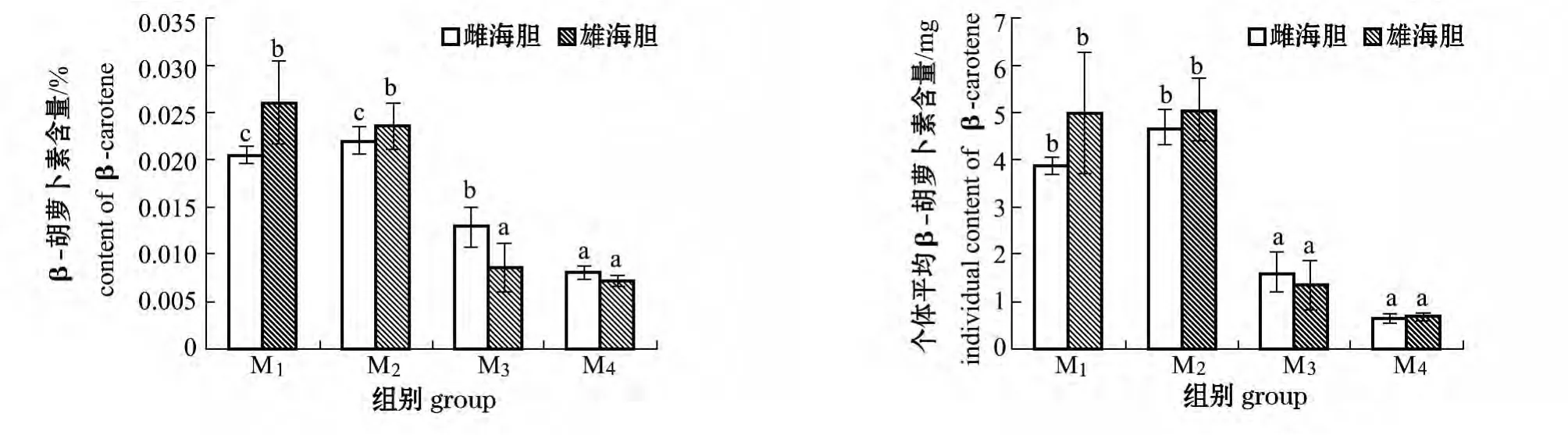
图1 不同饵料模式对海胆性腺中β-胡萝卜素和海胆个体平均β-胡萝卜素含量的影响Fig.1 Effects of different diets on the contents of β - carotene and the individual content of β - carotene in gonad of sea urchin Strongylocentrotus intermedius
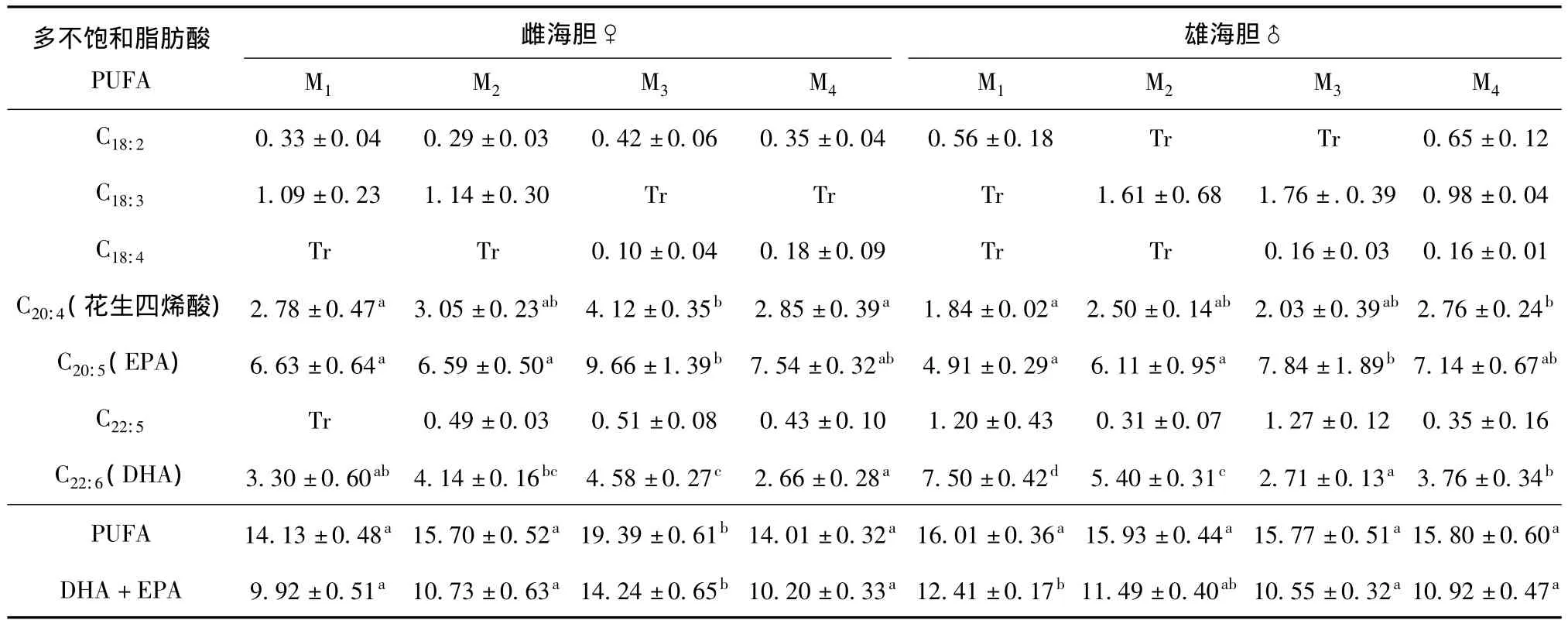
表3 不同饵料对中间球海胆性腺中多不饱和脂肪酸含量的影响Tab.3 Effects of different diets on the content of PUFA in gonad of sea urchin Strongylocentrotus intermedius %
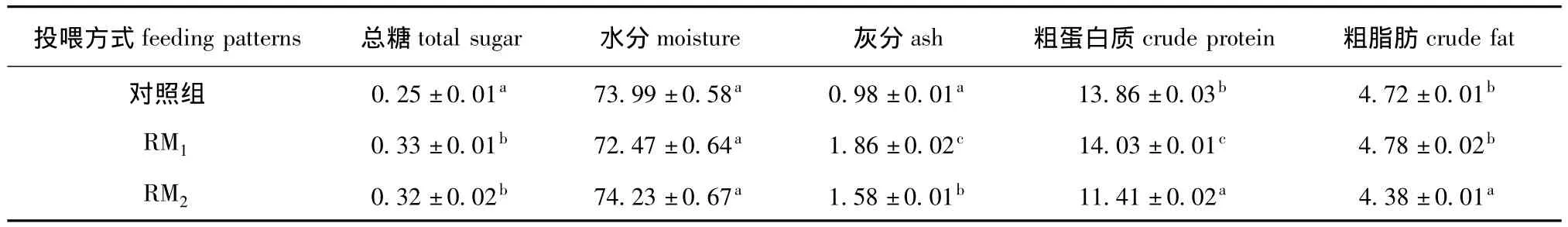
表4 不同投喂方式对中间球海胆性腺一般营养成分含量的影响 (以鲜基计)Tab.4 Effects of different feeding patterns on the approximate composition in gonad of sea urchin Strongylocentrotus intermedius w/%
2.2.2 氨基酸含量 从表5可见:雌、雄海胆性腺中EAA和TAA均为RM2组最高;雌、雄海胆性腺中EAA/TAA均为RM2组最高;雌海胆性腺中RM2组FAA最高,雄海胆性腺中对照组FAA最高,且雄性高于雌性;雌海胆性腺中对照组FAA/TAA最高,雄海胆性腺中RM1组FAA/TAA最高,且雄性高于雌性;3种投喂方式下海胆性腺中氨基酸含量均为甘氨酸最高。
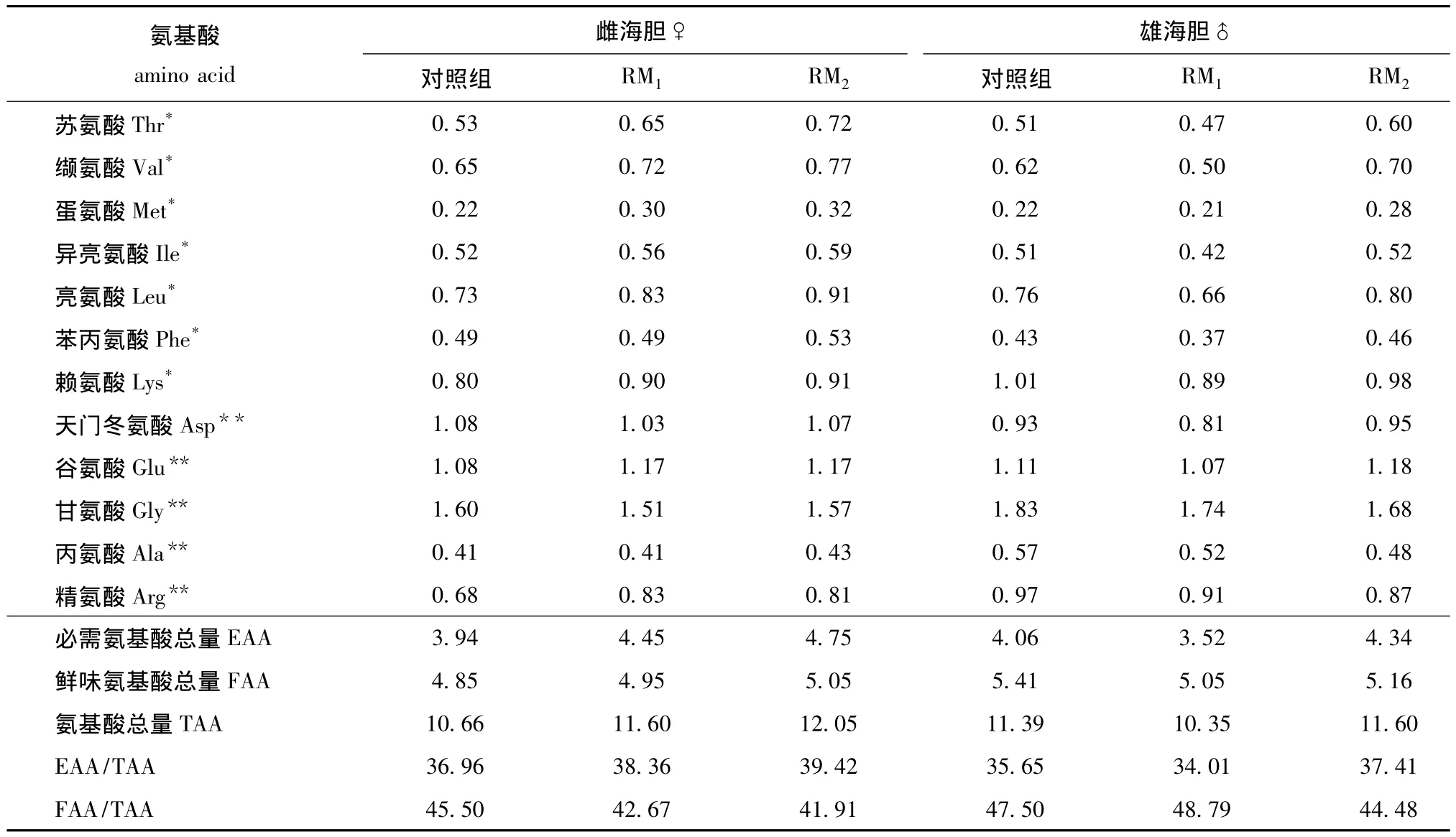
表5 不同投喂方式对中间球海胆性腺中氨基酸含量的影响Tab.5 Effects of different feeding patterns on the content of amino acids in gonad of sea urchin Strongylocentrotus intermedius %
2.2.3 β-胡萝卜素含量及个体平均β-胡萝卜素含量 从图2可见:雌海胆性腺中对照组β-胡萝卜素含量最高,为 (0.020 48±0.000 88)%,与RM1组无显著性差异 (P>0.05),与RM2组有显著性差异 (P<0.05)。雄海胆中对照组β-胡萝卜素含量最高,为 (0.025 94±0.007 39)%,RM2组最低,为 (0.010 69±0.000 92)%,且3组间有显著性差异 (P<0.05)。
从图2还可见:雌海胆中对照组个体平均β-胡萝卜素含量最高,为 (3.87±0.16)mg,与RM1组无显著性差异 (P>0.05),二者均显著高于RM2组(P<0.05);雄海胆中对照组个体平均β-胡萝卜素含量最高,为 (4.96±1.32)mg,RM2组最低,为 (1.60±0.12)mg,且3组间有显著性差异 (P<0.05)。
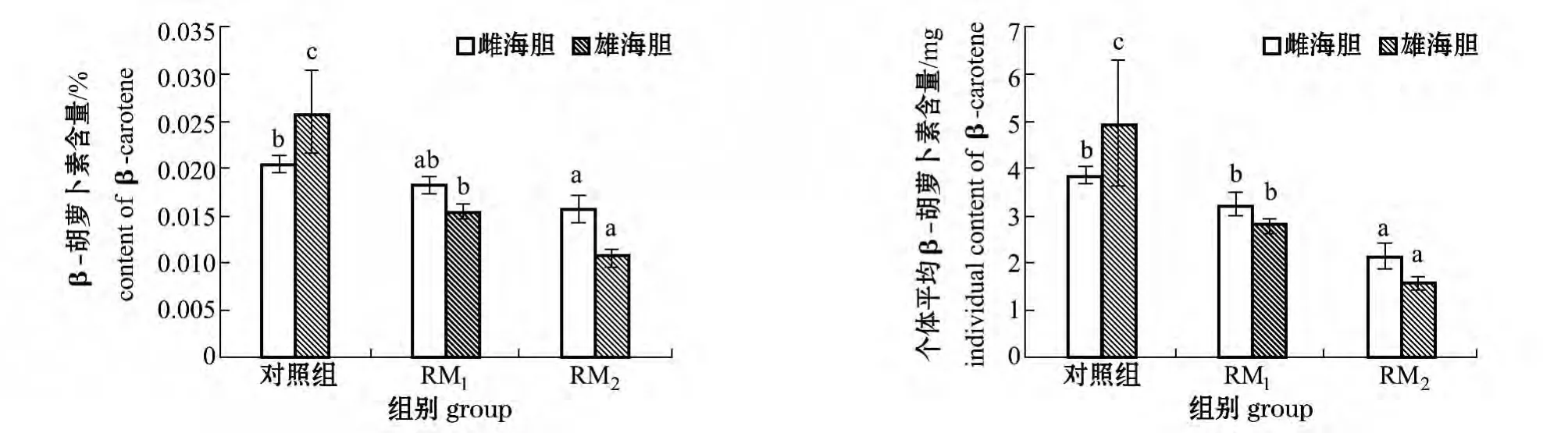
图2 不同投喂方式对海胆性腺中β-胡萝卜素和个体平均β-胡萝卜素含量的影响Fig.2 Effects of different feeding patterns on the content of β - carotene and the individual content of β - carotene in gonad of sea urchin Strongylocentrotus intermedius
2.2.4 多不饱和脂肪酸含量 从表6可见:雌海胆性腺中,RM1组PUFA含量和DHA+EPA含量均最高,与对照组有显著性差异 (P<0.05);雄海胆性腺中,RM1组PUFA含量最高,3组间无显著性差异 (P>0.05),对照组DHA+EPA含量最高,显著高于RM1和RM2组 (P<0.05);雌海胆性腺中,RM1组EPA含量最高,3组间无显著性差异 (P>0.05),雄海胆中RM2组EPA含量显著高于RM1和对照组 (P<0.05);雌海胆中RM1组DHA含量最高,与对照组有显著性差异 (P<0.05),雄海胆中对照组DHA含量最高,与RM1组无显著性差异 (P>0.05),二者均显著高于RM2组 (P<0.05)。
3 讨论
3.1 不同饵料模式与投喂方式对海胆性腺中氨基酸组成及含量的影响
氨基酸作为维持生命活动的重要物质,不仅具有重要的生理功能,而且在食物呈味方面发挥重要作用。Glu、Asp、Arg、Ala、Gly为呈鲜味的特征性氨基酸,中间球海胆性腺的鲜美程度与其性腺中鲜味氨基酸的含量有关[13]。不同饵料模式对海胆性腺中氨基酸含量的影响结果表明,海胆性腺中氨基酸含量丰富,性腺中EAA/TAA达到WHO/FAO提出的EAA/TAA约为40%的参考蛋白质模式标准[21],鲜味氨基酸含量占氨基酸总量的百分比高于淡水鱼乌鳢鱼、鲶和黄颡鱼[22],与花鳗鲡[1]、石斑鱼[23]等相近。研究还显示,饲喂海带、贻贝可促进中间球海胆氨基酸的合成,提高海胆性腺中氨基酸含量,南瓜、胡萝卜等植物性饵料较紫贻贝等动物性饵料更能提高海胆性腺的鲜美度。
不同投喂方式对中间球海胆性腺中氨基酸组成含量的影响结果表明,前期投喂南瓜、胡萝卜的方式基本不会影响性腺中总氨基酸含量及鲜味氨基酸含量,南瓜和胡萝卜可以作为海胆生长过程中某一阶段的替代饵料以缓解海带季节性匮乏及价格高等问题。此外,各试验组海胆性腺中鲜味氨基酸含量占氨基酸总量的百分比均为雄性高于雌性,且各组海胆性腺中甘氨酸含量均最高,这与Kaneko等[11]、Osako 等[12]的研究结果一致。
3.2 不同饵料模式与投喂方式对性腺中β-胡萝卜素含量及个体平均β-胡萝卜素含量的影响
β-胡萝卜素作为类胡萝卜素的一种,不仅能改善海胆性腺的色泽和口感,还是动物体内一种重要的生理性抗氧化剂,可有效清除活性氧成分和自由基,保护机体免受氧化损害,从而提高动物非特异免疫机能,促进水产动物生长及提高繁殖力[4]。Suckling等[14]研究发现,饵料中β-胡萝卜素能转化成海胆性腺中主要类胡萝卜素海胆酮储存,海胆性腺中总海胆酮水平与性腺颜色相关。Symonds等[24]对可食用海胆性腺和肠道中类胡萝卜素的研究也发现,食物中的β-胡萝卜素可以异构化成海胆酮积累在性腺中。本研究结果表明,饲喂海带的对照组海胆性腺中β-胡萝卜素含量与饲喂+海带贻贝组差异不显著,表明添加动物性蛋白对提高海胆性腺中β-胡萝卜素含量的效果不明显,但由于饲喂海带+贻贝组海胆的性腺指数明显高于对照组,性腺产量高,饲喂海带+贻贝组海胆的β-胡萝卜素个体含量高于对照组。
投喂方式研究结果显示,雌、雄海胆中,投喂海带的对照组均较前期投喂南瓜、胡萝卜方式组β-胡萝卜素含量高,推测原因,可能与中间球海胆长期摄食海带,体内存在与其适应的相关消化吸收转化酶有关,如何提高南瓜、胡萝卜中β-胡萝卜素的利用效率,以及β-胡萝卜素如何在海胆体内转化需要进一步研究探讨。
3.3 不同饵料模式与投喂方式对性腺中多不饱和脂肪酸含量的影响
中间球海胆性腺中脂肪酸含量丰富,尤其是高不饱和脂肪酸含量较高,对人类心血管疾病有较好的防治效果。海胆性腺发育过程中,脂肪酸有助于卵巢脂类的积累以保证卵黄的营养蓄积和维持正常胚胎及幼体早期发育[5]。本研究结果表明,以南瓜作为海胆生长发育过程中某一阶段的替代饵料,可提高雌海胆性腺中多不饱和脂肪酸含量及DHA+EPA含量,另外还发现,不同性别海胆性腺中脂肪酸的积累效果存在差异,在不同饵料模式与投喂方式条件下中间球海胆性腺中的多不饱和脂肪酸含量基本上均为雄性高于雌性。Martínez-Pita等[25]研究也发现,同期雌、雄海胆性腺中脂肪酸的含量差异较大,与本研究结果类似。推测原因,可能是不同性别海胆在性腺发育不同时期对脂肪酸的需求、利用不同,导致其性腺中脂肪酸积累的种类和含量不同。脂肪酸在海胆体内的代谢是一个复杂的过程,还有待于进一步的研究。
[1]林香信,颜孙安,钱爱萍,等.花鳗鲡鱼体肌肉的氨基酸分析研究[J].中国农学通报,2012,28(29):131-136.
[2]Robinson S M C,Castell J S,Kennedy E J.Developing suitable color in the gonads of cultured green sea urchins(Strongylocentrotus droebachiensis)[J].Aquaculture,2002,206(3):289-303.
[3]McBride S C,Pinnix W D,Lawrence J M,et al.The effect of temperature on production of gonads by the sea urchin(Strongylocentrotus franciscanus)fed natural and prepared diets[J].Journal of the World Aquaculture Society,1997,28(4):357-365.
[4]Sophie B G,John M L,Addison L L,et al.Carotenoids in the adult diet enhance egg and juvenile production in the sea urchin(Lytechinus variegatus)[J].Aquaculture,2001,199(3):353-369.
[5]Kennedy E J,Robinson S M C,Parsons G J,et al.Importance of dietary minerals and pigments in enhancing somatic growth of juvenile green sea urchins(Strongylocentrotus droebachiensis)[J].Aquaculture Association of Canada Special Publication,2001,5:31-34.
[6]Kang J X,Leaf A.The cardiac antiarrhythmic effects of polyunsaturated fatty acid[J].Lipids,1996,31(1):S41-S44.
[7]Tavazzi L,Maggioni A P,Marchioli R,et al.Effect of n-3 polyunsaturated fatty acids in patients with chronic heart failure(the GISSI-HF trial):a randomised,double-blind,placebo-controlled trial[J].Lancet,2008,372:1223-1230.
[8]Phillips K,Hamid N,Silcock P,et al.Effect of manufactured diets on the yield,biochemical composition and sensory quality of Evechinus chloroticus sea urchin gonads[J].Aquaculture,2010,308:49-59.
[9]Chang Y Q,Lawrence J M,Cao X B,et a1.Food consumption,absorption,assimilation and growth of the sea urchin Strongylocentrotus intermedius fed a prepared feed and the alga Laminaria japonica[J].Journal of the World Aquaculture Society,2005,36(1):68-75.
[10]Liyana-Pathirana C,Shahidi F,Whittick A,et al.Effect of season and artificial diet on amino acids and nucleic acids in gonads of green sea urchin(Strongylocentrotus droebachiensis)[J].Comparative Biochemistry and Physiology,2002,133A(2):389-398.
[11]Kaneko K,Matsumoto H,Shirai T,et al.Seasonal variations in free amino acid composition and taste aspects of black sea urchin(Diadema setosum)gonad[J].Food Science and Technology Research,2012,18(6):835-842.
[12]Osako K,Fujii A,Ruttanapornvareesakul Y,et al.Differences in free amino acid composition between testis and ovary of sea urchin Anthocidaris crassispina during gonadal development[J].Fisheries Science,2007,73(3):660-667.
[13]王丽梅,王吉桥,许伟定,等.中间球海胆性腺氨基酸组成研究[J].水产科学,2008,27(12):619-621.
[14]Suckling C C,Symonds R C,Kelly M S,et al.The effect of artificial diets on gonad color and biomass in the edible sea urchin(Psammechinus miliaris)[J].Aquaculture,2011,318(3):335-342.
[15]González-Durán E,Castell J D,Robinson S,et al.Effects of dietary lipids on the fatty acid composition and lipid metabolism of the green sea urchin(Strongylocentrotus droebachiensis)[J].Aquaculture,2008,276(1):120-129.
[16]Castell J D,Kennedy E J,Robinson S,et al.Effect of dietary lipids on fatty acid composition and metabolism in juvenile green sea urchin(Strongylocentrotus droebachiensis)[J].Aquaculture,2004,242(1):417-435.
[17]Cook E J,Bell M V,Black K D,et al.Fatty acid compositions of gonadal material and diets of the sea urchin Psammechinus miliaris:trophic and nutritional implications[J].Journal of Experimental Marine Biology and Ecology,2000,255(2):261-274.
[18]Barberá C,Fernández-Jover D,López Jiménez J A,et al.Trophic ecology of the sea urchin(Spatangus purpureus)elucidated from gonad fatty acids composition analysis[J].Marine Environmental Research,2011,71(4):235-246.
[19]张建华,张忠兵.胡萝卜中β-胡萝卜素测定的方法[J].内蒙古农业大学学报:自然科学版,2000,21(1):121-124.
[20]沈妍,常亚青,刘平晋,等.虾夷马粪海胆F2代群体体尺、性腺性状及营养成分的分析[J].农学学报,2012,2(8):60-67.
[21]FAO/WHO Ad Hoc Expert Committee.Energy and protein requirements[J].FAO Nutrition Meeting Report Series,1973,52:40-73.
[22]温小波,库夭梅,李伟国.4种优质底栖淡水鱼类肌肉营养成分的比较[J].大连水产学院学报,2003,18(2):99-103.
[23]张本,陈国华.四种石斑鱼氨基酸组成的研究[J].水产学报,1996,20(2):111-119.
[24]Symonds R C,Kelly M S,Suckling C C,et al.Carotenoids in the gonad and gut of the edible sea urchin(Psammechinus miliaris)[J].Aquaculture,2009,288(1):120-125.
[25]Martínez-Pita I,García F J,Pita M L.Males and females gonad fatty acids of the sea urchins Paracentrotus lividus and Arbacia lixula(Echinodermata)[J].Helgoland Marine Research,2010,64(2):135-142.
