影响钒电解液电化学性能的因素
2014-02-15张玉贤扈显琦房少华
张玉贤,扈显琦,2,房少华
(1 承德万利通实业集团有限公司,河北 承德067002;2 承德石油高等专科学校,河北 承德067002)
全钒氧化还原液流电池是一种新兴的适合大规模储能的二次电池,其结构不同于其它电池,主要由隔膜、极板、电极、正负极电解液储液罐和循环泵等几部分构成。全钒氧化还原液流电池的荷电介质为分别存储于正负极电解液罐中的含不同价态钒离子的电解液,其中正极为V5+/V4+电对,负极为V3+/V2+电对[1]。全钒氧化还原液流电池具有充放电可逆性高、循环寿命长、能量转换效率高、正负极电解质无交叉污染和容易规模化等优点。钒电池系统可以广泛用于太阳能和风能发电的储能设备、大型应急电源系统、电站储能和电力系统的削峰填谷、负载调平等方面。近年来,对于全钒氧化还原液流电池使用的隔膜、极板、电极等部件和钒电解液稳定性的研究比较多[2-9],温度对钒电池性能的影响也有研究[10],但是有关温度和硫酸浓度对钒电解液的电化学行为的研究报道还很少见。本工作对不同浓度的钒电解液在不同温度和硫酸浓度下的电化学循环伏安行为进行了研究,总结了温度对钒电解液电化学性能的影响规律和适宜的硫酸浓度,以供全钒氧化还原液流电池研究和生产参考。
1 实验材料和方法
1.1 实验仪器及试剂
实验试剂使用由99.5%V2O5制备的V3+和V4+质量比为1∶1 的不同浓度的钒电解液,其中游离H2SO4浓度分别为2.0 mol/L 和3.0 mol/L。实验仪器使用CS350 型电化学工作站,HH-4 型恒温水浴锅,FYL-YS-150L 型制冷加热两用恒温箱。
1.2 实验方法
采用三电极体系,测量不同温度下不同浓度的钒电解液的循环伏安曲线,扫描速率为50 mV/s。Pt 为辅助电极,碳电极为工作电极,饱和甘汞电极(SCE)为参比电极。
2 结果与讨论
2.1 浓度对钒电解液性能的影响
在10 ℃和30 ℃条件下测得的不同浓度钒电解液的循环伏安曲线分别示于图1 和图2。图1 和图2 中数据显示,在不同的测量温度下,电化学循环伏安曲线变化具有相似的规律。在测量温度范围内的同一温度下,随着钒离子浓度的增大,氧化反应和还原反应的峰值电流增大。图1 为温度10 ℃时测得的循环伏安曲线。10 ℃时,1.0 mol/L 的钒电解液V5+/V4+电对的还原峰电流为0.11 A,氧化峰电流为0.18 A;而2.0 mol/L 的电解液中此电对的还原峰电流为0.13 A,氧化峰电流增大至0.22 A。图2 为温度为30 ℃时的循环伏安曲线。30 ℃时,1.0 mol/L 的钒电解液中V5+/V4+电对的还原峰电流为0.14 A,氧化峰电流为0.23 A;而2.0 mol/L 的电解液中此电对的还原峰电流为0.16 A,氧化峰电流增大为0.31 A。这说明钒离子浓度增加,参加电化学反应的离子数量增多,电化学反应产生的电流增大。

图1 在10 ℃不同浓度下钒电解液的循环伏安曲线Fig.1 The cyclic voltammetry curves of various concentrations of vanadium electrolyte at 10 ℃

图2 在30 ℃不同浓度下钒电解液的循环伏安曲线Fig.2 The cyclic voltammetry curves of various concentrations of vanadium electrolyte at 30 ℃
由图1 和图2 还可以发现,随着钒离子浓度的增加,氧化峰向右移动,而还原峰向左移动,导致两峰之间的电势差增大。温度为10 ℃时,1.0 mol/L的钒电解液V5+/V4+电对的还原峰与氧化峰之间的电势差为0.464 V,而2.0 mol/L 的钒电解液中此电势差则增大到0.948 V。温度为30 ℃时,1.0 mol/L的钒电解液V5+/V4+电对的还原峰与氧化峰之间的电势差为0.452 V,而2.0 mol/L 的钒电解液中此电势差则增大到0.879 V。这一结果反映出随着钒电解液浓度的升高,电化学反应的可逆性变差。钒原子有空的d 轨道,钒离子之间极易缔合,浓度越高,缔合程度也越大,复杂离子参加电化学反应相应的反应能垒增加,导致极化增大;另一方面,浓度增大导致溶液黏度增大,使传质过程受到一定的阻碍[11]。因此,随着钒电解液浓度的增大,电化学反应发生需要克服更大的阻力,导致反应可逆性变差。
2.2 温度对钒电解液性能的影响
浓度为1.6 mol/L 钒电解液在10 ℃、20 ℃和30 ℃条件下测得的循环伏安曲线示于图3。
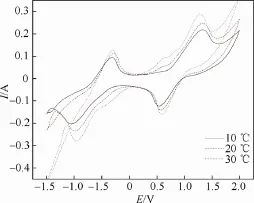
图3 浓度为1.6 mol/L 的钒电解液在不同温度下的循环伏安曲线Fig.3 The cyclic voltammetry curves of 1.6 mol/L vanadium electrolyte at various temperatures
图3中数据表明,对于不同浓度的钒电解液,温度对电化学循环伏安行为的影响规律也是相同的,即对于同一浓度下的钒电解液,氧化反应和还原反应的峰值电流值随着温度的升高而增大,而氧化峰和还原峰的峰值电势基本没变。在1.6 mol/L的钒电解液中,V5+/V4+电对的还原峰电流10 ℃时为0.12 A,30 ℃时增大到0.15 A;氧化峰电流10 ℃时为0.22 A,30 ℃时增大到0.29 A。而对于V4+/V3+电对,在10 ℃时的循环伏安曲线上的氧化峰和还原峰几乎看不到,而在20 ℃和30 ℃的曲线上均可看到在0.625 V 附近的氧化峰和-0.35 V 附近的还原峰,且30 ℃时的峰值电流明显比20 ℃时要大。这一现象可由阿累尼乌斯方程解释。阿累尼乌斯方程为[12]
式中,k 为反应速率常数,min;k0为频率因子常数,min;Ea为反应活化能,J/mol;R为气体常数,8.314 J/(mol·K);T 为绝对温度,K。
由式(1)可知,温度升高,反应速率常数增大,反应产生的电流增大,这与实验现象一致。因而,为了提高钒电解液在电化学反应中产生的电流的大小,可适当提高钒电解液温度。
温度对峰值电势的影响可用电极电势能斯特方程解释[12]
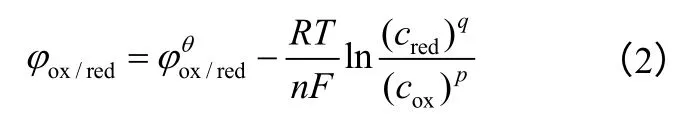
式中,n为得失电子数;F为法拉第常数,96485 C/mol;cred为还原性离子物质的量浓度;cox为氧化性离子物质的量浓度;p,q 为氧化性和还原性离子反应方程式配平系数。
对于电解液浓度不变仅温度变化时,引起的电极电势变化量为

因溶液中离子浓度不变,而法拉第常数F>>ΔT,因而温度变化引起的电极电势的变化量非常小,在循环伏安曲线上看不出明显变化。
2.3 硫酸浓度对电解液性能的影响

图4 10 ℃时硫酸浓度对钒电解液性能的影响Fig.4 The cyclic voltammetry curves of vanadium electrolyte with different concentrations of sulfuric acid at 10 ℃

图5 30 ℃时硫酸浓度对钒电解液性能的影响Fig.5 The cyclic voltammetry curves of vanadium electrolyte with different concentrations of sulfuric acid at 30 ℃
硫酸浓度分别为2.0 mol/L 和3.0 mol/L 的1.6 mol/L 钒电解液分别在10 ℃和30 ℃测得的循环伏安曲线如图4 和图5所示。由图中数据可见,钒电解液中硫酸浓度增大,V5+/V4+和V3+/V2+氧化还原电对的氧化峰电流和还原峰电流均有所增大,而且温度较低时的影响更为显著。这是由于钒电解液的状态介于真溶液和胶体之间,硫酸浓度增大,使稳定存在于络合物中的钒离子浓度增大[13-15],因而使能够参加电化学反应的钒离子数量增加,电化学反应产生更大的电流密度。因此,硫酸浓度为3.0 mol/L 的钒电解液的电化学性能更好。
3 结 论
(1)在同一温度下,随着钒离子浓度的增大,参加电化学反应的离子数量增多,电化学反应可以产生更大的反应电流。但同时随着钒离子浓度的增加,电化学反应的可逆性变差。
(2)对于同一浓度下的钒电解液,氧化反应和还原反应的峰值电流值随着温度的升高而增大。因而,适当提高钒电解液温度,可提高电化学反应的反应电流值。
(3)钒电解液中的硫酸浓度对其电化学性能有影响。钒电解液中含硫酸浓度为3.0 mol/L 时的电化学性能优于2.0 mol/L 时。
[1] Zhang Huamin(张华民). Development and application status of energy storage technologies[J]. Energy Storage Science and Technology(储能科学与技术),2012,1(1):58-63.
[2] Li Rong(李荣),Yu Zuxiao(余祖孝).Study of cyclic voltammetry behavior of electrolyte in vanadium redox flow battery[J]. Journal of Chongqing Normal University:Natural Science(重庆师范大学学报:自然科学版),2008,25(3):73-76.
[3] Liu Suqin(刘素琴),Zhang Wenxi(张文昔),Huang Kelong(黄可龙) . Study on the electrochemical properties of carbon felt modified by PB and oxalic acid VRB application[J]. Chinese Journal of Power Sources(电源技术),2006,30(5):395-397.
[4] Jia Zhijun(贾志军),Song Shiqiang(宋士强),Wang Baoguo(王保国). A critical review on redox flow batteries for electrical energy storage applications[J]. Energy Storage Science and Technology(储能科学与技术),2012,1(1):50-57.
[5] Guan Tao(管涛),Lin Maocai(林茂财),Yu Qingchun(余晴春). Effects of additives on electrolytes and the performance of vanadium battery[J]. Battery Bimonthly(电池),2011,41(6):325-327.
[6] Liang Yan(梁艳),He Ping(何平),Yu Tingting(于婷婷),et al. Influence of additives on all vanadium redox flow battery electrolyte[J]. Journal of Southwest University of Science and Technology(西南科技大学学报),2008,23(2):11-14.
[7] Li Bingyang(李冰洋),Wu Xuran(吴旭冉),Guo Weinan(郭伟男),Fan Yongsheng(范永生),Wang Baoguo(王保国).PVDF proton conductive membranes for vanadium redox flow batteries[J].Energy Storage Science and Technology(储能科学与技术),2014,3(1):66-70.
[8] Qian P,Zhang H M,Chen J,et al.A novel electrode bipolar plate assembly for vanadium redox flow battery applications[J]. Journal of Power Sources,2008,175(1):613-6201.
[9] Huang Kelong(黄可龙),Tan Ning(谭宁), Liu Suqin(刘素琴),Li Xiaogang(李晓刚),Chang Zhifeng(常志峰). Reaction mechanism of V(Ⅳ)/V(Ⅴ)redox couple at graphite felt electrode[J].The Chinese Journal of Nonferrous Metals(中国有色金属学报),2006, 16(4):734-738.
[10] Teng Xiangguo(滕祥国),Zhao Yongtao(赵永涛),Wu Zenghua(武增华), Xi Jingyu(席靖宇),Qiu Xinping(邱新平),Chen Liquan(陈立泉). Effects of temperature on the performance of vanadium redox flow battery[J]. Chinese Journal of Power Sources(电源技术),2009,33(7):587-589.
[11] Luo Dongmei(罗冬梅).Study on vanadium redox flow battery[D].Shenyang:Northeastern University,2005.
[12] Fu Xiancai(傅献彩),Shen Wenxia(沈文霞),Yao Tianyang(姚天扬),et al. Physical Chemistry(物理化学)[M]. Beijing:Higher Education Press,2005.
[13] Skyllas-Kazacos M,Heights S,Rychick M,et al.All vanadium reodx battery:US,4786567[P]. 1998.
[14] Gaku O,Yasushi K,Takashi M. Investigation on V(Ⅳ)/V(Ⅴ)species in a vanadium redox flow battery[J]. Electrochimica Acta,2004,49:3091-3095.
[15] Xu Qian(许茜),Lai Chunyan(赖春艳),Yin Yuanhong(尹远洪),Sui Zhitong(隋智通).Improving the stability of electrolyte for vanadium redox cell[J].Chinese Journal of Power Sources(电源技术),2002,26(1):29-31.
