骨髓间充质干细胞移植治疗兔深静脉血栓的实验研究
2014-02-14孔祥骞董典宁吴学君
孔祥骞,孙 岩,金 星,董典宁,袁 海,周 华,吴学君
骨髓间充质干细胞(bone marrow stromal cells,BMSCs)是一种多能干细胞,具有干细胞的共性即自我更新及多向分化的能力,可分化成骨、软骨、脂肪、肌肉、真皮及骨髓基质等中胚层组织[1-10]。自1968年Friedenstein等[11]发现BMSCs具有多向分化潜能以来,其便成为血管新生研究的热点。下肢深静脉血栓形成(deep vein thrombosis,DVT)是一种临床常见病、多发病,发病率达100/10万,尽管采用抗凝、溶栓以及经导管溶栓或手术取栓等多种方法治疗,疗效仍不理想,后期许多患者出现肢体疼痛肿胀、小腿溃疡、行走困难等症状,患者承受巨大痛苦,给其家庭和社会造成沉重负担[12-13]。研究表明,血栓后遗症的发生与血液回流是否通畅,即与血栓再通程度密切相关[14]。故而如何采用更为有效的治疗方法促进血栓的再通成为当前研究的热点。鉴于干细胞的多能性,笔者所在科室设想通过将BMSCs移植到兔下腔静脉血栓模型中,观察其是否加速血栓的机化与再通,为DVT的治疗提供新的策略。
1 材料与方法
1.1 实验动物 新西兰大白兔40只,体重约2.5 kg,购自山东省农业科学院实验兔场[许可证:SCXK(鲁)2009-0001]。
1.2 主要试剂 胎牛血清、无血清培养液购自GIBCO公司;淋巴细胞分离液购自济南科瑞公司;凝血酶购自苏州新宝制药有限公司;羊抗兔血管内皮细胞生长因子(VEGF)-C单克隆抗体、鼠来源血管性血友病因子(vWF)多克隆抗体、鼠抗兔碱性成纤维细胞生长因子(bFGF)多克隆抗体购自武汉博士德公司;青霉素购自山东鲁抗医药股份有限公司;山羊IgG二抗、驴IgG二抗购自广州中杉公司;戊巴比妥钠购自深圳市腾龙源实业有限公司。
1.3 实验方法
1.3.1 实验动物分组:40只新西兰大白兔中8只作为干细胞供体,余32只建立血栓模型,成功后随机分为4组,每组8只。A组:建模3 d后,将含有107个BMSCs的DMEM悬液1 ml移植于股静脉中;B组:建模3 d后,将1 ml 0.9%氯化钠注射液注入股静脉内;C组:建立血栓模型10 d后,将含有107个BMSCs的DMEM悬液1 ml移植于股静脉中;D组:建立血栓模型10 d后,将1 ml 0.9%氯化钠注射液注入股静脉内。
1.3.2 BMSCs的分离、体外培养及鉴定:8只干细胞供体大白兔采用2.5%戊巴比妥钠以1 ml/kg剂量于兔耳缘静脉麻醉后,用聚维酮碘消毒术区3遍,于兔股骨下端行骨髓穿刺,用10 ml注射器(预置25 U/ml肝素盐水1 ml)抽取骨髓3~10 ml,可根据情况调整骨髓穿刺针的进针深度和方向。将其加入肝素预凝的无菌离心管中,再加入等量无血清培养液悬浮细胞。将上述悬液小心加在等量1.073 g/ml的淋巴细胞分离液上,室温下1000 r/min离心20 min,悬液分为4层,吸取中间的白膜层,用含血清的培养液进行悬浮,室温下1000 r/min离心5 min,去上清,重复清洗2次,获得较纯净的BMSCs。培养扩增并进行干细胞鉴定,首先镜下观察细胞形态及细胞贴壁生长的特性,当细胞生长至80%~90%后,制成单细胞悬液,1000 r/min离心5 min。收集细胞沉淀,洗涤后分别加入荧光标记的抗体。40℃孵育30 min,PBS洗涤,多聚甲醛固定后用流式细胞仪检测细胞表面抗原 CD11b、CD29、CD44、CD45 的表达[15]。
1.3.3 血栓模型的建立:4组大白兔麻醉成功后,将其仰卧固定于手术台上,严格无菌操作,于腹正中线做一长约6 cm的纵向切口,保护肠管,游离显露肾静脉水平以下的下腔静脉约1.5 cm,上下端以7#丝线结扎。将凝血酶配制成100 U/ml溶液,用1 ml注射器向结扎静脉段内注入10 U(0.1 ml),观察20~30 min,确认血栓形成(血管由红色变为暗红色)后,远端拆除结扎线,近端将结扎线松开后再轻轻结扎,使近端下腔静脉狭窄,防止血栓脱落,并作为取材标记。检查无异常后,缝合腹部切口。
1.3.4 BMSCs移植方法:麻醉成功后,于兔股部做一长约1 cm的纵向切口,游离显露股静脉,穿刺静脉注入1 ml BMSCs悬液,移植后按压止血,依次缝合各层组织。
1.4 观察项目
1.4.1 新生毛细血管形态观察及计数:移植后第14、28天,每组随机取4只兔,过量麻醉处死,取病变段下腔静脉,甲醛固定后做石蜡切片,行HE染色、vWF免疫组化检查。镜下计数每5个高倍视野新生毛细血管数,相同高倍视野下分别由3位检验医师计数,取平均值。
1.4.2 血栓中VEGF、bFGF蛋白表达的检测:移植后第14天,每组随机取4只兔,过量麻醉处死,取下腔静脉段血栓,应用Western blot法检测血栓中VEGF、bFGF蛋白的表达,以 β-肌动蛋白(β-actin)为参照物。
1.5 统计学方法 应用SPSS 13.0软件进行统计学分析,计量资料以均数±标准差(±s)表示,采用方差分析、q检验,α=0.05为检验水准。
2 结果
2.1 新生毛细血管形态观察及计数比较 移植后对兔石蜡切片行HE染色可见新生毛细血管内红细胞被染成红色,vWF免疫组化染色可见新生毛细血管壁呈棕褐色,据此可以观察新生毛细血管。A、C组移植后14 d可见有新生毛细血管形成,以C组更明显;移植后28 d,4组均见有新生毛细血管生成,A、C组新生血管腔隙较B、D组明显增大。A组镜下可见较多棕褐色新生毛细血管,但管腔较小,血栓机化再通较明显;C组可见大量新生毛细血管,且管腔大,血栓机化再通明显;B、D组镜下可见少量新生毛细血管,管腔变化不明显,且新生血管多集中在血栓周边,靠近管壁。A、B、C、D组移植后14 d每5个高倍视野新生毛细管数分别为(78.57±10.64)、(43.57 ± 5.38)、(94.00 ± 7.67)、(58.53 ± 6.87)条,移植后28 d 分别为(118.00 ±12.53)、(66.32 ±4.65)、(138.00 ± 12.69)、(74.23 ± 8.38)条,A、C组多于B、D组(P<0.05),C组多于 A组(P<0.05),B组与D组比较差异无统计学意义(P>0.05)。
2.2 VEGF、bFGF蛋白的表达 Western blot检测结果显示,各组 VEGF、bFGF蛋白均有表达,A组VEGF、bFGF蛋白水平高于 B 组(P<0.05),C 组VEGF、bFGF蛋白水平高于 D 组(P <0.05),B、D 两组比较差异无统计学意义(P>0.05),见图1、2和表1。
3 讨论
DVT是一种常见静脉疾病,不仅可引发肺栓塞,而且疾病后期可并发下肢慢性静脉功能不全(CVI),表现为肢体肿胀、疼痛、溃疡形成等症状。30% ~67%髂、股静脉内存在大量血栓的患者,病后3~8年内会出现严重的CVI症状,而且未彻底治愈的DVT并发CVI患者的临床症状要比单纯静脉瓣膜功能不全患者表现出的倒流性疾病症状更加严重[16]。
血栓后遗症的发生与血液回流是否通畅即血栓再通程度有密切关系。血栓的机化和再通是由多种细胞和细胞因子参与的动态过程。尽管目前已经进行了长期大量的基础及临床研究[17-20],血栓机化和再通的具体机制仍未完全阐明。近年研究发现BMSCs在血栓机化再通过程中发挥着重要的作用。Mizuno等[21]用一个不透膜把栓子和血管壁隔开,一定时间后血栓内的裂隙仍可见内皮细胞覆盖,机化同样会发生。Feigl等[22]用可渗透膜包裹血栓后放入血管中,防止其与血管壁接触,血栓内部同样会发生内皮化和再通。以上实验从侧面说明血栓中再通管道的内皮细胞不只来自血管壁,还可能来自循环血液中的内皮祖细胞(EPCs)。Moldovan[23]对间充质干细胞(MSCs)在静脉血栓再通中的作用进行综述,发现增加单核细胞或EPCs能够加速血栓再通。

图1 兔骨髓间充质干细胞移植后第14天各组血管内皮细胞生长因子的表达

图2 兔骨髓间充质干细胞移植后第14天碱性成纤维细胞生长因子蛋白的表达
表1 兔骨髓间充质干细胞移植后第14天各组VEGF、bFGF光密度相对于β-actin的比值(±s)
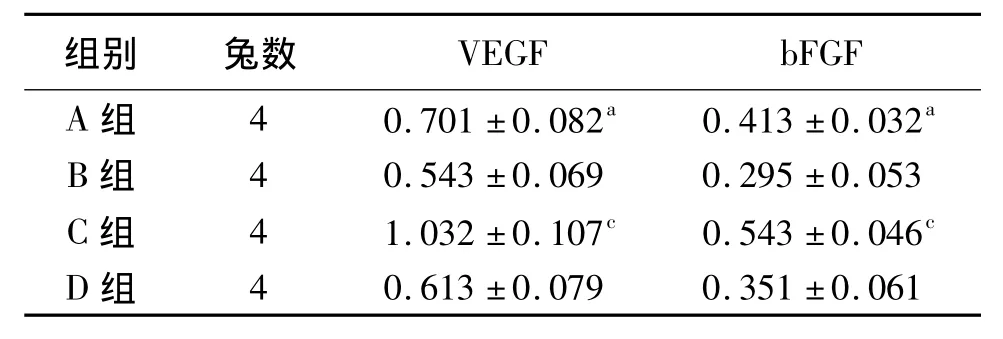
表1 兔骨髓间充质干细胞移植后第14天各组VEGF、bFGF光密度相对于β-actin的比值(±s)
注:VEGF:血管内皮细胞生长因子,bFGF:碱性成纤维细胞生长因子,β-actin:β-肌动蛋白;A、C组:分别于建模3、10 d后移植骨髓间充质干细胞;B、D组:分别于建模3、10 d后注射0.9%氯化钠注射液;与B组比较,a P<0.05;与D组比较,c P <0.05
组别 兔数VEGF bFGF A 组 4 0.701 ±0.082a 0.413 ±0.032 a 4 0.613 ±0.079 0.351 ±0.061 B 组 4 0.543 ±0.069 0.295 ±0.053 C 组 4 1.032 ±0.107c 0.543 ±0.046c D组
BMSCs具有强大的自我复制能力,可分化为神经细胞、血管内皮细胞、平滑肌细胞、血细胞等多种细胞,并且能够分泌多种细胞因子,促进血管新生[24]。鉴于BMSCs的多分化潜能,本研究将经体外培养并鉴定成功的BMSCs移植到下腔静脉血栓模型中,观察血栓内新生血管生成情况,探讨其可能机制。发现BMSCs移植组(A、C组)新生毛细血管数明显多于0.9%氯化钠注射液对照组(B、D组),移植后28 d效果更明显;而在移植时间的选择上,建模后10 d(C组)移植效果比建模后3 d(A组)好,其原因可能是在建模早期局部炎性反应较重,炎性因子较多,引起BMSCs凋亡,使新生血管不如后期明显。进一步观察发现BMSCs组血栓内VEGF、bFGF蛋白表达均明显上调,高于0.9%氯化钠注射液组。表明BMSCs移植可以改变血栓的微环境,在促进新生血管形成的同时,还可增加VEGF、bFGF的表达。
分析以上结果,笔者推测BMSCs促进血栓再通可能与以下机制有关:①BMSCs分化为血管内皮细胞,促进血管新生。如前所述,BMSCs具有分化成早期中胚层和外胚层各种细胞的潜能[25]。已有研究者在体外成功将BMSCs诱导分化为血管内皮细胞[26],亦有研究发现BMSCs移植可以治疗缺血性心脏病,其机制是缺血心肌组织刺激BMSCs分化为血管内皮细胞,单个或多个内皮细胞形成管样结构,形成新生血管[24]。②BMSCs分泌多种血管生长因子改善血栓微环境,促进血管新生。已有研究证实,BMSCs可以分泌 VEGF、bFGF、胎盘生长因子(PIGF)、促血管生成素-1(Ang-1)等多种血管生长因子[27]。同时有研究表明,在血管新生的早期,bFGF对微血管新生有促进作用,而VEGF主要在促血管新生后期发挥持续作用[28]。另外,BMSCs还可以通过释放VEGF、单核细胞趋化蛋白-1(MCP-1)等引起循环中的干细胞归巢,促进血管新生和组织修复[27]。本研究发现,BMSCs移植组较0.9%氯化钠注射液对照组血栓组织中VEGF、bFGF表达明显增强,说明BMSCs分泌的VEGF、bFGF在促血管新生中起重要作用。③BMSCs促进侧支血管的形成。BMSCs可以分化为血管内皮细胞和平滑肌细胞,直接参与侧支血管结构的构建,同时还可以通过分泌多种细胞因子、生长因子、化学递质等促进骨髓源性的EPCs聚集和活化,通过抑制内皮细胞和平滑肌细胞凋亡等方式促进侧支血管的形成和塑形[29]。侧支血管数量的增加和管径的增粗对于建立有功能的侧支循环网络、促进血液回流具有重要意义。
目前BMSCs被广泛应用于各系统疾病的治疗,而用于DVT少有报道。本研究在动物模型中发现,BMSCs能够改变血栓的微环境,促进血栓的机化和再通,为下一步临床应用BMSCs移植治疗人下肢DVT打下了坚实的基础。
[1] Piersma A H,Brockbank K G,Ploemacher R E,et al.Characterization of fibroblastic stromal cells from murine bone marrow[J].Exp Hematol,1985,13(4):237-243.
[2] Piersma A H,Ploemacher R E,Brockbank K G.Transplantation of bone marrow fibroblastoid stromal cells in mice via the intravenousroute[J].Br J Haematol,1983,54(2):285-290.
[3] 赵延峰,李国忠,孙琳.骨髓间充质干细胞在周围神经系统的应用[J].中华神经医学杂志,2007,6(5):534-535.
[4] 郭晓华,颉玉欣,张牧霞,等.骨髓间充质干细胞来源的成骨细胞与血管内皮生长因子基因整合的研究[J].临床荟萃,2010,25(24):2129-2131,封 3.
[5] 孙振强,纪卫政,李涛,等.供体骨髓间充质干细胞抑制肝移植大鼠免疫排斥的研究[J].中华消化外科杂志,2009,8(6):449-452.
[6] 李明辉,田丁,刘聪燕,等.人骨髓间充质干细胞的培养及研究[J].首都医科大学学报,2005,26(2):183-186.
[7] 朱淑霞,宋治远.骨髓间充质干细胞和心肌组织工程[J].武警医学院学报,2009,18(4):366-370.
[8] 徐金霞,李家锋,韩建国,等.大鼠骨髓间充质干细胞生物学特性的研究[J].中国医药科学,2012,2(9):37-39.
[9] Beresford J N,Bennett J H,Devlin C,et al.Evidence for an inverse relationship between the differentiation of adipocytic andosteogenic cells in rat marrow stromal cell cultures[J].JCell Sci,1992,102(Pt 2):341-351.
[10]栗扬阳,赵庆华.不同因子影响骨髓间充质干细胞的多向分化[J].中国组织工程研究,2013(23):4299-4305.
[11] Friedenstein A J,Petrakova K V,Kurolesova A I,et al.Heterotopic of bone marrow.Analysis of precursor cells for osteogenic and hematopoietictissues[J].Transplantation,1968,6(2):230-247.
[12]邱天,郭曙光,方伟,等.下肢深静脉血栓发病的高危因素[J].中华医学杂志,2013,93(29):2279-2282.
[13]陈跃鑫,刘昌伟,倪冷,等.深静脉血栓后综合征——困惑与探索[J].中华外科杂志,2012,50(8):684-687.
[14]倪冷,叶炜,刘昌伟,等.深静脉血栓后综合征的诊治策略[J].临床外科杂志,2012,20(5):365-367.
[15]刘伟,陈剑,宋佳,等.兔骨髓间充质干细胞的分离、培养及鉴定[J].中国实验诊断学,2013,17(8):1366-1369.
[16]殷敏毅,黄新天,蒋米尔,等.髂股静脉血栓形成后综合征的早期手术治疗及相关实验研究[J].中华外科杂志,2010,48(13):972-976.
[17]陈魁,史吏,高涌,等.下肢深静脉血栓后综合征的研究及诊疗进展[J].中华全科医学,2012,10(2):284-285,323.
[18]吴梦涛,郑振华,姬伟凤,等.下肢静脉血栓后综合征并溃疡46例诊治分析[J].中华实用诊断与治疗杂志,2012,26(1):91-92.
[19]李炯,杨檬,罗文军,等.重组血小板衍生生长因子CC促静脉血栓溶解、机化、再通的实验研究[J].重庆医学,2013(24):2877-2880,2883.
[20]赵文军,张锐利,王青,等.髂股静脉血栓形成后综合征的腔内介入治疗[J].中国中西医结合外科杂志,2011,17(3):264-266.
[21]Mizuno T,Sugimoto M,Matsui H,et al.Visual evaluation of blood coagulation during mural thrombogenesis under high shearblood flo[J].Thromb Res,2008,121(6):855-864.
[22]Feigl W,Sinzinger H,Kern H G.Thrombus organization and atherosclerosis[J].Med Welt,1978,29(27-28):1132-1134.
[23] Moldovan N I.Tissular insemination of progenitor endothelial cells:the problem,and a suggestedsolution[J].Adv Exp Med Biol,2003,522:99-113.
[24] Tang J,Xie Q,Pan G,et al.Mesenchymal stem cells participate in angiogenesis and improve heart function in rat model of myocardial ischemia with reperfusion[J].Eur JCardiothorac Surg,2006,30(2):353-361.
[25] Tremain N,Korkko J,Ibberson D,et al.MicroSAGE analysis of 2,353 expressed genes in a single cell-derived colony of undifferentiated human mesenchymal stem cells reveals mRNAs of multiple cell lineages[J].Stem Cells,2001,19(5):408-418.
[26]张鹏飞,张亚卓,李庆国,等.bFGF、EGF诱导成人骨髓基质细胞向血管内皮细胞分化的实验研究[J].中华神经外科杂志,2005,21(8):497-499.
[27] Kinnaird T,Stabile E,Burnett M S,et al.Local delivery of marrow-derived stromal cells augments collateral perfusion throughparacrine mechanisms[J].Circulation,2004,109(12):1543-1549.
[28] Oyama K,Ohnuki T,Ohnuki N,et al.The effect of basic fibroblast growth factor(bFGF)on early bronchial revascularization[J].Nihon Kyobu Geka Gakkai Zasshi,1996,44(11):2032-2039.
[29] Thurston G,Rudge J S,Ioffe E,et al.Angiopoietin-1 protects the adult vasculature against plasma leakage[J].Nat Med,2000,6(4):460-463.
