药桑葚总黄酮的提取工艺及其抗氧化活性分析
2014-02-13蒲俊松向仲怀何宁佳
陈 虎,蒲俊松,向仲怀,何宁佳
(家蚕基因组生物学国家重点实验室,重庆 400715)
药桑(Morus nigraLinn.),属桑科桑属黑桑种,起源于伊朗,16世纪在我国新疆等地开始栽培,是我国唯一的黑桑种,目前也主要分布于新疆阿克苏、和田、吐鲁番和喀什等地区[1-4]。药桑葚为其成熟果实,含多种营养和药用成分,为维吾尔族历代的民间药材,具有消炎镇痛等药效,现代药理学研究证实药桑葚还具有降三高(血糖、血脂、血压)、抗氧化、抗肿瘤等药理作用,植物化学研究表明药桑葚含有黄酮、多糖、生物碱、二苯乙烯类等多种活性成分[5-9]。黄酮类化合物有很强的抗氧化和自由基清除能力,药理活性则表现在抗衰老、防癌变、降低胆固醇、提高免疫力等方面[10-14]。
响应面分析法(response surface methodology,RSM)是利用合理的试验设计,采用多元二次回归方程拟合因素与响应值之间的函数关系,通过对回归方程的分析来寻求最佳工艺参数,解决多变量问题的一种统计方法[15],与传统的正交试验设计法相比,具有高效、全面和回归方程精度更高等优势,目前已在生物学、食品学、工程学、化学工业等多个领域得到广泛应用[16-19]。
本研究通过正交试验和响应面法优化药桑葚总黄酮的提取工艺,在此基础上研究其还原力及抗氧化活性,以期为药桑葚总黄酮的提取以及开发利用提供一定的参考依据。
1 材料与方法
1.1 材料、试剂与仪器
药桑葚采自新疆和田蚕研所桑树种质资源圃,60 ℃烘干至恒质量,粉碎机粉碎,过60 目筛,置干燥器中备用。
芦丁(纯度≥92.5%) 中国食品药品检定研究院;VC(纯度≥98%) 美国Sigma公司;其他试剂皆为分析纯。
DHG-9140A电热恒温鼓风干燥箱 上海齐欣科学仪器有限公司;FA2004B电子天平 上海精天电子仪器有限公司;KQ-500DV数控超声波清洗器 昆山市超声仪器有限公司;CT15RE冷冻离心机 日本Hitachi公司;UV1000紫外-可见分光光度计 上海天美科学仪器有限公司。
1.2 方法
1.2.1 标准溶液的配制和标准曲线的制作[20]
精密称取干燥恒质量的芦丁标准品10 mg,用体积分数60%的乙醇溶液溶解并定容于100 mL容量瓶中(超声波助溶),摇匀制备质量浓度为0.1 mg/mL的标准品溶液。
精确吸取芦丁标准品溶液0.0、0.5、1.0、2.0、3.0、4.0、5.0 mL于10 mL容量瓶中,加入体积分数60%的乙醇溶液稀释至5.0 mL,加质量分数5%的NaNO2溶液0.3 mL,摇匀,静置6 min,加质量分数10%的Al(NO3)3溶液0.3 mL,摇匀,静置6 min,加质量分数4%的NaOH溶液4.0 mL,使用体积分数60%的乙醇溶液定容,摇匀。以空白试剂为参比液,波长510 nm处测其吸光度。以吸光度为纵坐标,芦丁标准液质量浓度为横坐标,绘制标准曲线,得曲线方程为:y=13.116x-0.004 3,R2=0.999 5。
1.2.2 药桑葚总黄酮提取及含量的测定方法
准确称取桑葚干粉2 g于50 mL离心管中,按一定料液比的乙醇溶液,一定功率超声和一定时间提取总黄酮。提取液在20 ℃条件下8 000 ×g转速离心5 min,滤渣以同样条件提取、离心、合并上清液,然后用乙醇溶液定容为80 mL溶液。取定容后样品各0.6 mL检测,用制作标准曲线同样方法测定药桑葚总黄酮的含量,即为得率。

1.2.3 筛选影响药桑葚总黄酮提取主要因素

表1 超声提取药桑葚总黄酮二位级正交试验因素表Table 1 Factors and levels for orthogonal array design
利用二位级正交试验,以乙醇体积分数、料液比、超声功率、提取温度、提取时间、提取次数作为6 个考察因素,选取两个位级进行试验,对结果进行极差分析,筛选出影响药桑葚总黄酮提取主要因素,因素位级设计见表1。
1.2.4 还原力测定[21-22]
普鲁士兰法测定样品的还原力:取一定体积(0.05、0.1、0.2、0.3、0.4 mL)的样品液于10 mL棕色容量瓶中,加入质量浓度10 mg/mL的铁氰化钾和PBS(pH 6.5)溶液各1.0 mL,摇匀,混合液于50 ℃水浴20 min,加入1.0 mL质量浓度100 mg/mL的三氯乙酸溶液,摇匀,静置10 min后,再加入质量浓度1 mg/mL的三氯化铁与蒸馏水各1.0 mL,无水乙醇定容,静置10 min,分光光度计于700 nm波长处测定吸光度。重复3 次,取平均值。
1.2.5 羟自由基清除率测定[23-24]
取6 支10 mL离心管依次向其中各加入2.0 mmol/L FeSO4溶液2.0 mL、1.0 mmol/L H2O2溶液2.0 mL,摇匀,再加入6.0 mmol/L水杨酸3.0 mL,摇匀,于37 ℃水浴加热15 min。水浴完毕取一支离心管于510 nm波长处测定吸光度。之后向余下5支试管中分别加入待试样品0.2、0.4、0.6、0.8、1.0 mL,接着分别添加超纯水0.8、0.6、0.4、0.2、0.0 mL,摇匀,继续水浴加热15 min,待加热完毕后再次分别测定吸光度。对照实验:用2.0 mL蒸馏水取代H2O2溶液,严格重复上述过程,测吸光度。重复3次,取平均值。羟自由基清除率计算见式(2)。
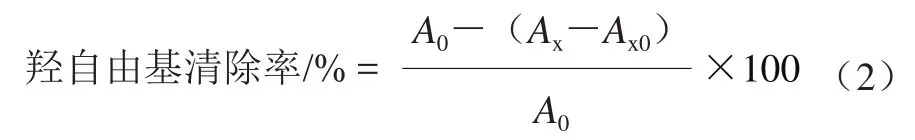
式中:A0为空白对照溶液吸光度;Ax为样品液吸光度;Ax0为不加H2O2样品液的本底吸光度。
1.2.6 超氧阴离子自由基清除率测定[23,25]
取6 支10 mL离心管各加入pH 8.2的50 mmol/L Tris-HC1缓冲液4.5 mL,再分别加入待测样0.0、0.2、0.4、0.6、0.8、1.0 mL,然后依次加蒸馏水1.0、0.8、0.6、0.4、0.2、0.0 mL,混匀后在25 ℃恒温水浴中保温20 min,取出后立即加入在25 ℃预热过的3 mmol/L邻苯三酚溶液0.3 mL(10 mmol/L HCl溶液配制)启动反应。5 min后加10 mol/L盐酸溶液0.2 mL终止反应。同时另取6支离心管,按上述步骤依次加入Tris-HCl缓冲液、总黄酮提取液和蒸馏水,然后分别加10 mmol/L盐酸溶液0.3 mL,5 min后加10 mol/L盐酸溶液0.2 mL终止反应,摇匀。在325 nm波长处检测吸光度。按照式(3)计算药桑葚总黄酮提取液对超氧阴离子自由基的清除率。
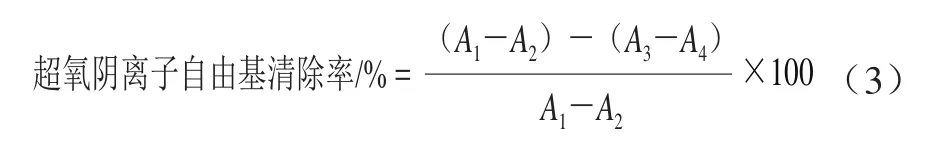
2 结果与分析
2.1 影响药桑葚总黄酮提取主要因素
按表1的正交因素水平设计L8(27)正交试验,结果见表2。
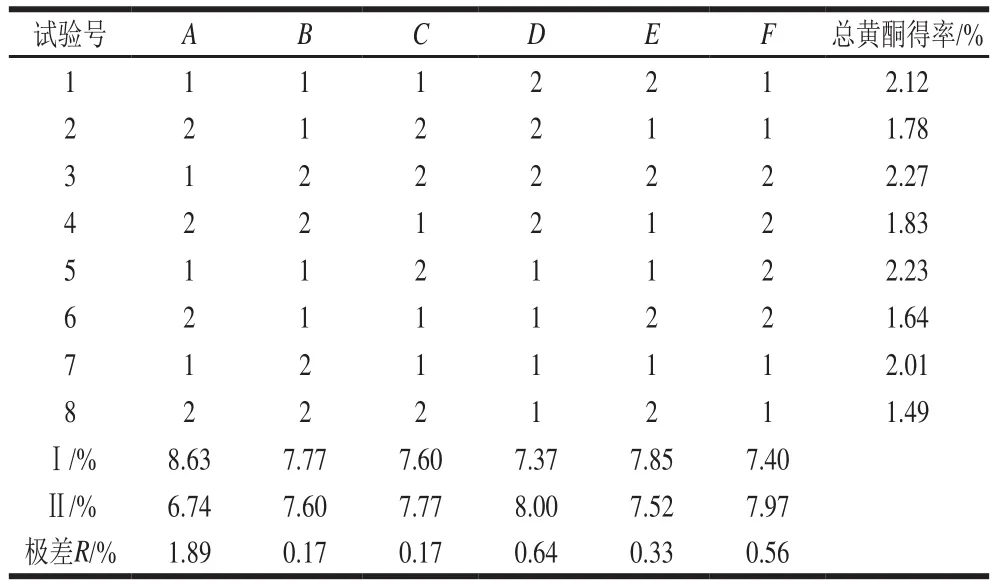
表2 超声提取药桑葚总黄酮工艺L8(27)正交试验设计及结果Table 2 Design and results of L8(27) orthogonal array
由表2的极差分析结果可得,RA>RD>RF>RE>RC=RB,因此,药桑葚总黄酮提取因素的影响力大小为乙醇体积分数(A)>提取温度(D)>提取次数(F)>提取时间(E)>超声功率(C)=料液比(B)。对提取率影响最显著的是乙醇体积分数、提取温度和提取次数3 个因素。
2.2 单因素试验
根据正交试验结果(表2),设计乙醇体积分数、提取温度和提取次数3 个影响药桑葚总黄酮提取的主要因素的单因素试验,次要因素选取提取时间15 min、超声功率500 W、料液比1∶10。
2.2.1 乙醇体积分数对药桑葚总黄酮得率的影响
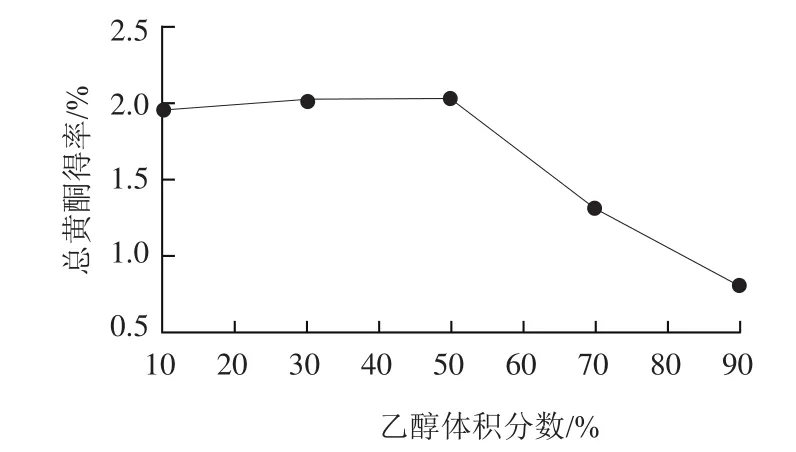
图1 乙醇体积分数对总黄酮得率的影响Fig.1 Effect of ethanol concentration on the extraction yield of total flavonoids
由图1可知,随着乙醇体积分数的增加,药桑葚总黄酮得率也随之增加,当体积分数为50%时总黄酮得率最大,随后得率随着乙醇体积分数的增加而降低。这可能是因为50%乙醇的极性与药桑葚黄酮类化合物极性最相近,当乙醇体积分数低于或高于50%时,药桑葚黄酮类成分未充分溶出,或者乙醇低体积分数时水溶性成分溶出,乙醇高体积分数时脂溶性成分溶出,影响了黄酮类化合物的溶出。
2.2.2 提取温度对药桑葚总黄酮得率的影响
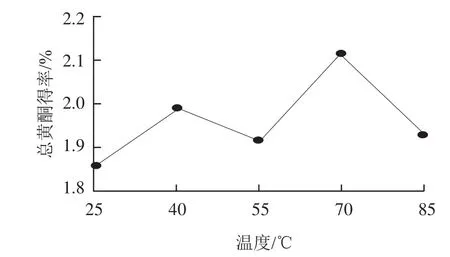
图2 提取温度对总黄酮得率的影响Fig.2 Effect of extraction temperature on the extraction yield of total flavonoids
由图2可知,随着温度的升高,药桑葚总黄酮得率在70 ℃达到最高,出现的波动可能因为温度的变化,一方面造成黄酮类物质的渗透、扩散和溶解速度等变化,另一方面也造成已经提取出来的黄酮类成分分解。
2.2.3 提取次数对药桑葚总黄酮得率的影响
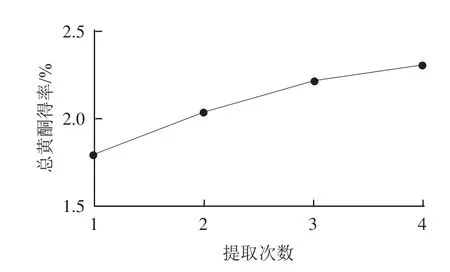
图3 提取次数对总黄酮得率的影响Fig.3 Effect of number of repeated extractions on the extraction yield of total flavonoids
由图3可知,随着提取次数的增加,药桑葚黄酮得率逐渐增加,提取3次后变化缓慢,得率较高。
2.3 响应面分析法优化工艺
2.3.1 响应面分析因素水平的选取
根据正交试验因素筛选结果和单因素试验结果,选取乙醇体积分数、提取温度和提取次数对药桑葚总黄酮提取影响最大的3 个因素,采用三因素三水平的响应面分析方法,因素与水平见表3。
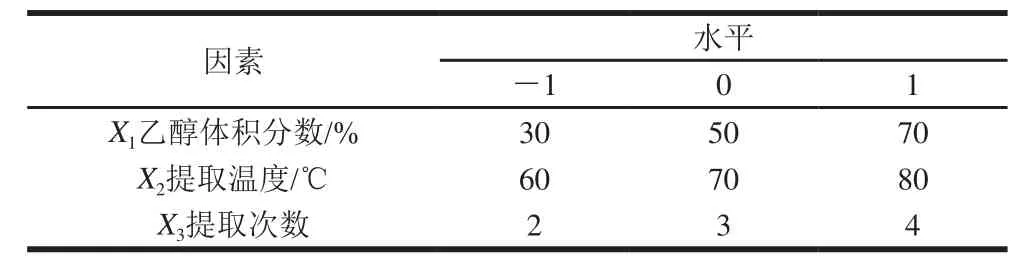
表3 响应面分析因素水平及编码Table 3 Coded values and corresponding actual values for independent variables in response surface design
2.3.2 响应面试验设计及结果
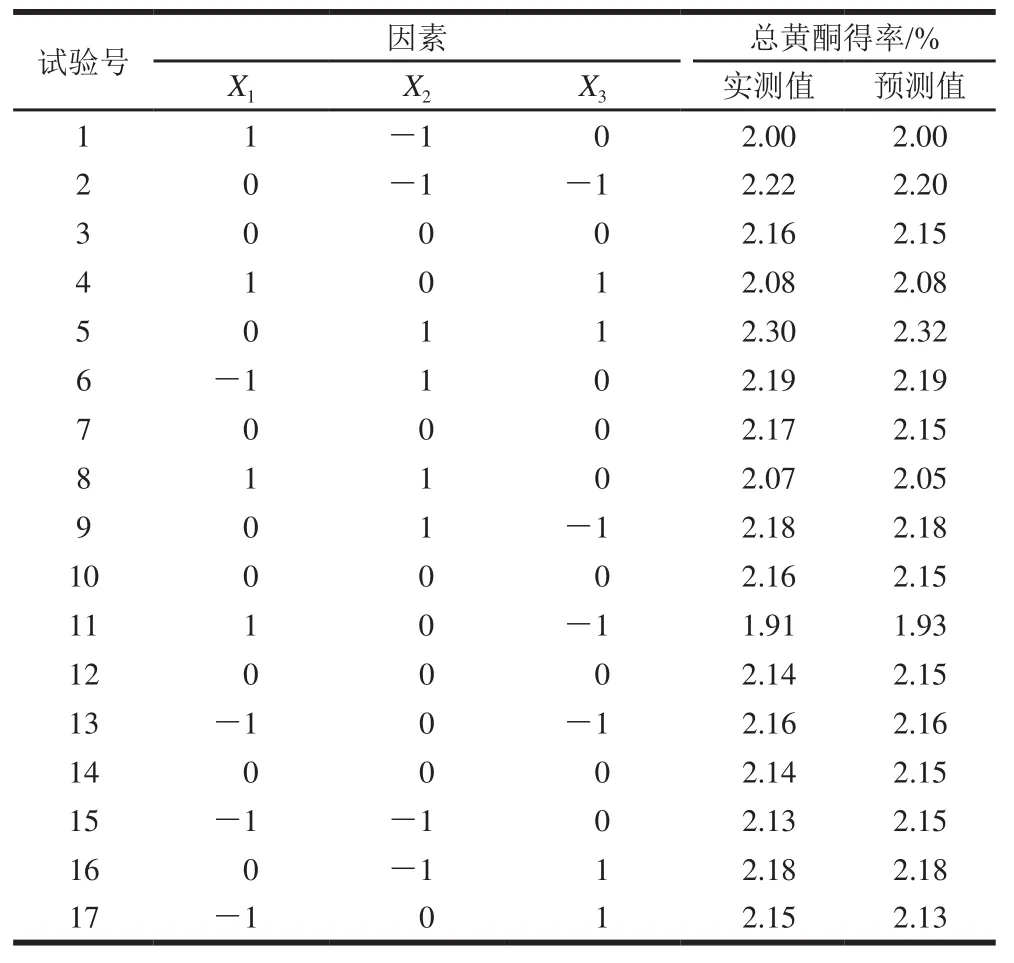
表4 响应面法试验设计与结果Table 4 Experimental design with predicted and experimental extraction yield of total flavonoids for response surface analysis
采用Design-Expert软件经回归拟合后,得到以总黄酮得率为响应值的二次回归方程:
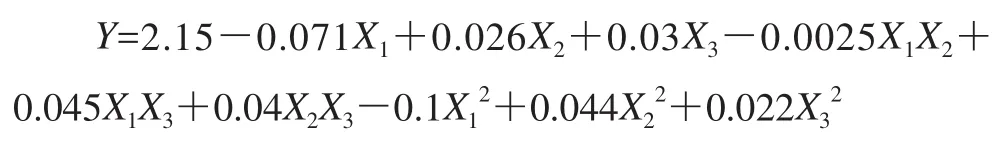
回归模型方差分析见表5。由表5可知,整体模型的F值为37.68,P值小于0.01,表明二次方程模型极显著;的P值均小于0.05,表明乙醇体积分数、提取温度、提取次数、乙醇体积分数与提取次数之积、提取温度与次数之积、乙醇体积分数、提取温度和提取次数二次项对药桑葚总黄酮的得率有显著影响;失拟项(P=0.145 6)不显著,方程模拟较好;决定系数R2=0.979 8,说明模型能够解释97.98%响应值的变化;预测拟合度与校正拟合度较接近;变异系数(CV=0.87%)低,模型置信度高;信噪比为27.034(远大于最低要求4),即该模型可用于预测。
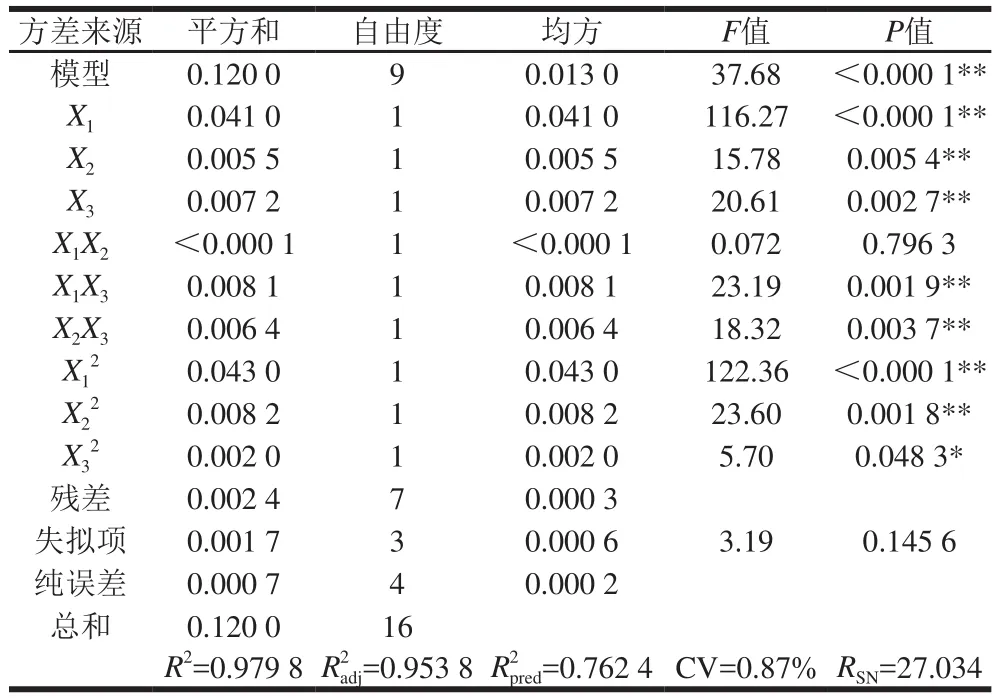
表5 回归模型方差分析Table 5 Variance analysis of the regression equation
2.3.3 响应面分析
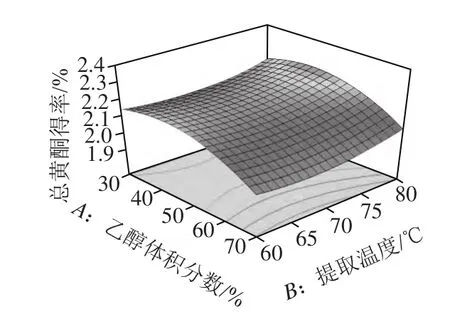
图4 乙醇体积分数和提取温度对总黄酮得率的影响Fig.4 Response surface plot for the effects of ethanol concentration and extraction temperature on the yield of total flavonoids
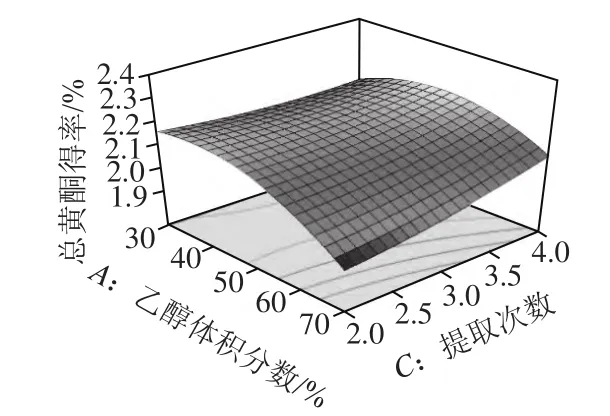
图5 乙醇体积分数和提取次数对总黄酮得率的影响Fig.5 Response surface plot for the effects of ethanol concentration and number of reapted extractions on the yield of total flavonoids
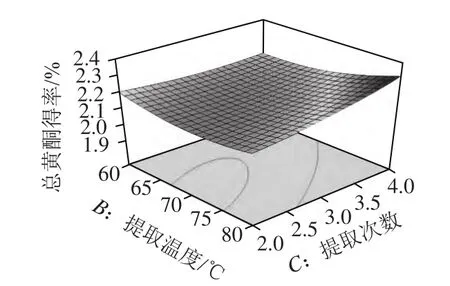
图6 提取温度和提取次数对总黄酮得率的影响Fig.6 Response surface plot for the effects of extraction temperature and number of repeated extractions on the yield of total flavonoids
由图4~6可知,对总黄酮得率的影响最显著的是乙醇体积分数,然后依次为提取次数、提取温度。通过回归模型预测药桑葚总黄酮提取的最优条件为乙醇体积分数47.64%、温度80 ℃、提取4次。在此条件下总黄酮得率理论上可达2.32%。根据实际操作的情况,将提取条件修正为乙醇体积分数48%、温度80 ℃、提取4 次,在此条件下进行3 次验证实验,总黄酮得率平均为2.31%,与预测值较为接近,证明响应面法分析得到的药桑葚总黄酮提取条件是真实可靠的。同时,考虑到高温对化合物稳定的影响及多次提取的繁琐,也可采用以下优化条件对药桑葚总黄酮进行提取:乙醇体积分数38%、温度60 ℃、提取2 次、料液比1:10、超声时间15 min/次、超声功率500 W,预测总黄酮得率2.24%,实测总黄酮得率2.22%。
2.4 还原力及抗氧化测定结果与分析
提取液1为使用最优方法(乙醇体积分数48%,温度80 ℃,提取4 次),稀释12 倍,获得质量浓度为0.048 mg/mL的药桑葚总黄酮提取液;提取液2为使用方法(乙醇体积分数38%、温度60 ℃、提取2 次),稀释24 倍,获得质量浓度为0.046 mg/mL的药桑葚总黄酮提取液;VC为质量浓度0.048 mg/mL的乙醇溶液。
2.4.1 还原力
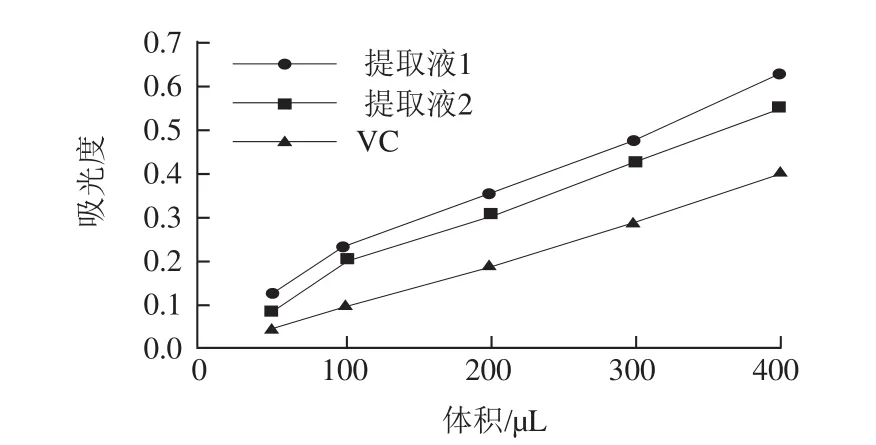
图7 VC和药桑总黄酮还原力Fig.7 Reducing power of Vc and total flavonoids from black mulberries
由图7可知,通过吸光度比较还原力的大小,随着总黄酮和VC量的增加还原力逐渐增强,与VC相比,药桑葚总黄酮还原力更强,还原力:提取液1>提取液2>VC。
2.4.2 羟自由基清除率
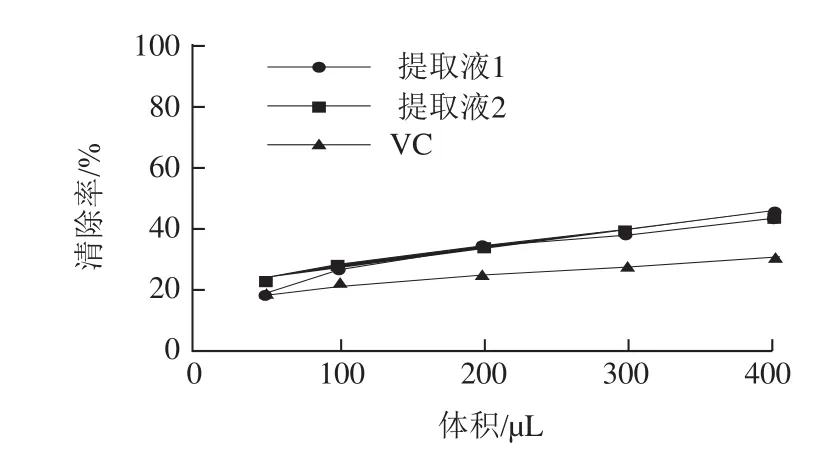
图8 VC和药桑总黄酮羟自由基清除力Fig.8 Hydroxyl radical scavenging activity of VC and total flavonoids from black mulberries
由图8可知,提取液1和提取液2对羟自由基清除力随加样体积增加而增强,且清除能力极为相近,并强于VC,羟自由基清除力:提取液1≈提取液2>VC。
2.4.3 超氧阴离子自由基清除率
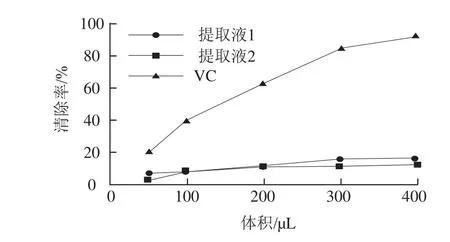
图9 VC和药桑总黄酮超氧阴离子自由基清除力Fig.9 Superoxide anion radical scavenging activity of VC and total flavonoids from black mulberries
由图9可知,随着加样体积增加,提取液1和提取液2对超氧阴离子自由基清除力逐渐增强,当达到0.3 mL时清除力增强变平缓,两种方法得到的总黄酮对超氧阴离子自由基清除力极为相近,超氧阴离子自由基清除力:VC>提取液1≈提取液2。
3 结 论
3.1 采用超声波辅助提取技术对药桑葚总黄酮进行提取,通过正交试验,得到影响药桑葚总黄酮得率的提取因素的影响力大小:乙醇体积分数>提取温度>提取次数>提取时间>超声功率=料液比。
3.2 通过单因素试验和响应面设计对药桑葚总黄酮超声波提取工艺进行优化,得到优化工艺条件:乙醇体积分数48%、提取温度80 ℃、提取4 次、料液比1∶10、提取时间15 min/次、超声功率500 W。
3.3 通过还原力及自由基清除实验,表明药桑总黄酮具有较强还原力及自由基清除能力,且对羟自由基清除力强于超氧阴离子自由基;相对于最优方法,方法2(乙醇体积分数38%、提取温度60 ℃、提取2次、料液比1∶10、提取时间15 min/次、超声功率500 W)温度相对温和,流程简易,总黄酮得率较高,还原力及抗氧化力较强,提取药桑葚总黄酮时可考虑采用。
[1]买买提依明.新疆药桑的研究[J].北方蚕业, 2007, 28(1): 1-3.
[2]张帆, 张刚, 陆承志.维药药桑的研究与应用[J].传统医药, 2007,16(20): 61.
[3]江岩.新疆黑桑椹多糖超声提取工艺优选[J].中国酿造, 2009(3):138-140.
[4]江岩, 李斌, 郭晓军.新疆黑桑椹多糖的提取和测定[J].食品科学,2008, 29(8): 224-226.
[5]杨小兰, 毛立新, 张晓云.黑桑椹的营养成分和抗氧化作用的研究[J].食品科学, 2006, 27(2): 248-250.
[6]杨小兰, 杜青平, 高应.黑桑椹对大鼠红细胞膜脂质过氧化作用的影响[J].营养学报, 2002, 24(4): 428-430.
[7]杨小兰, 毛立新, 张晓云.黑桑椹对高脂血症大鼠的降脂作用研究[J].食品科学, 2005, 26(9): 509-510.
[8]马延萍.药桑椹治疗咽炎疗效观察[J].新疆中医药, 2002, 20(6): 83-84.
[9]王磊, 王洪庆, 陈若芸.黑桑茎皮化学成分研究[J].中国中药杂志,2007, 32(23): 2497-2499.
[10]SUNGJ J, DONG-HYUN K, YOON-HEE H, et al.Flavonoids from the flower ofRhododendron yedoensevar.poukhanenseand their antioxidant activities[J].Archives Pharmacal Research, 2007, 30(2):146-150.
[11]GACCHE R N, SHEGOKAR H D, GOND D S, et al.Evaluation of selected flavonoids as antiangiogenic, anticancer, and radical scavenging agents: an experimental and in silico analysis[J].Cell Biochemistry and Biophysics, 2011, 61(3): 651-663.
[12]UDDIN N, SIDDIQUI B S, BEGUM S, et al.Bioactive flavonoids from the leaves ofLawsonia alba(Henna)[J].Phytochemistry Letters,2011, 4(4): 454-458.
[13]MARANHAO C, PINHEIRO I, SANTANA A, et al.Antitermitic and antioxidant activities of heartwood extracts and main flavonoids ofHymenaea stigonocarpaMart.[J].International Biodeterioration &Biodegradation, 2013, 79: 9-13.
[14]HUANG X Q, TU Z C, XIAO H, et al.Dynamic high pressure micro fl uidization-assisted extraction and antioxidant activities of sweet potato (Ipomoea batatasL.) leaves flavonoid[J].Food and Bioproducts Processing, 2013, 91(1): 1-6.
[15]陈键, 孙爱东, 高雪娟, 等.响应面分析法优化超声波提取槟榔原花青素工艺[J].食品科学, 2011, 32(4): 82-86.
[16]王永菲, 王成国.响应面法的理论与应用[J].中央民族大学学报,2005, 14(3): 236-240.
[17]SAHIN S, AYBASTIER O, ISIK E.Optimisation of ultrasonicassisted extraction of antioxidant compounds fromArtemisia absinthiumusing response surface methodology[J].Food Chemistry,2007, 141(2): 1361-1368.
[18]KHAYET M, COJOCARU C, ESSALHI M.Artificial neural network modeling and response surface methodology of desalination by reverse osmosis[J].Journal of Membrane Science, 2011, 368(1): 202-214.
[19]AHMADI S, MANTEGHIAN M, KAZEMIAN H, et al.Synthesis of silver nano catalyst by gel-casting using response surface methodology[J].Powder Technology, 2012, 228: 163-170.
[20]吴小兰.青刺果总黄酮的提取工艺及其对糖尿病小鼠降血糖效应的研究[D].雅安: 四川农业大学, 2008.
[21]王元成, 伍春, 陈虎, 等.桑白皮中白藜芦醇、氧化白藜芦醇和桑皮苷的抗氧化活性[J].食品科学, 2011, 32(15): 135-138.
[22]师成斌, 张晓云, 田艳花, 等.黑麦芽类黑精体外抗氧化活性的研究[J].食品工程, 2007(1): 56-59.
[23]杨润亚, 明永飞, 王慧.无花果叶中总黄酮的提取及其抗氧化活性测定[J].食品科学, 2010, 31(16): 78-82.
[24]曹晓霞, 李翠芹, 王喆之.翅茎香青中黄酮类物质的提取及其抗氧化性研究[J].现代生物医学进展, 2008, 8(4): 692-694.
[25]秦小明, 林华娟, 宁恩创, 等.金花茶叶水提物的抗氧化活性研究[J].食品科技, 2008, 33(2): 189-191.
