怎样认识氧化性?
2014-02-13李淑妮刘萍翟高红崔斌
李淑妮刘萍翟高红崔斌
(1陕西师范大学化学化工学院 陕西西安710062;2西北大学化学与材料科学学院 陕西西安710069)
一些学生容易将氧化性和氧化数联系,错误地认为氧化数越高,氧化性越强,这可能是因为二词中都有“氧化”二字。
其实,某元素原子的氧化数是人为指定的该原子的荷电数的形式规定,而氧化性是指一特定物种得电子的能力,二者并没有必然的联系。
如果“特定物种”就是该原子,而且是气态,当然是氧化数越高,得电子的能力越强。
如果“特定物种”虽然就是该原子,但处于其他聚集态,或是由该原子与其他原子共同组成的新“特定物种”,这时,该原子的氧化能力则由多方面的因素所决定,仅认为“氧化数越高,氧化性越强”是欠妥的。
在下面硫的电势图(图1)中,看不到物种的氧化性与氧化数有直接的关系;却可以看到,介质不同,同一物种的氧化性不一样。

图1 硫的元素电势图
再以简单离子Cun+为例,从图2可看出,某特定氧化态的原子所组成的“特定物种”的氧化性受介质酸碱性、溶解性、生成配合物离子所影响,即与其存在状态有关[1-3]。
此外,氧化性还受溶剂所影响,例见图3。
在水溶液中,Cu2+没有Cu+的氧化性强。其根源为:Cu2+比Cu+的电荷多、离子半径小,所以Cu2+与水分子的静电作用比Cu+大;Cu2+为d9构型,在水分子配体场作用下,发生d轨道能级分裂,得到配体场稳定化能和姜-泰勒(Jahn-Teller)效应畸变稳定化能。
上述因素使得在极性溶剂水中,Cu2+的水合能远比Cu+大,更易与水结合,使稳定性增加,氧化性变弱。
在乙腈中,Cu2+比Cu+的氧化性强。其原因是,乙腈溶剂的极性较小,离子与溶剂间的静电作用比在水中明显减弱,因而Cu2+溶剂化所放出的能量不足以使Cu2+稳定,所以其氧化性强。
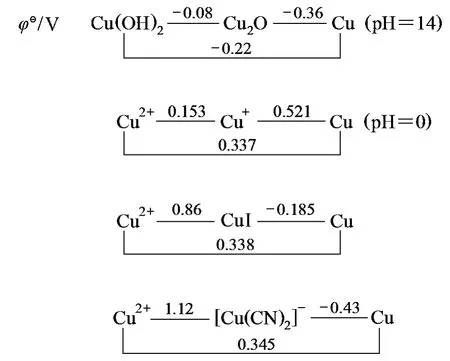
图2 铜的元素电势图

图3 不同溶剂中铜的元素电势图
如果配体与Cun+之间所形成的键的共价成分大,则Cu+就比Cu2+稳定,如[Cu(CN)2]-、CuCl、CuI等(图2);相反,如果配体与Cun+之间的静电作用大,则Cu2+就可以稳定存在,如CuF2就是如此。
在氯的电势图(图4)中,同样可看到介质的酸碱性和存在状态对复杂离子(含氧酸(根))氧化性的影响:
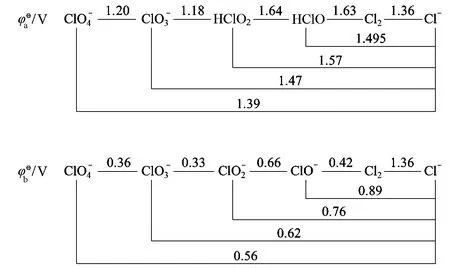
图4 氯的元素电势图
无机含氧酸的氧化性是指含氧酸获得电子被还原的能力,更确切地说是指含氧酸的中心原子获得电子变成某一稳定还原态的能力。这一还原态往往是指氧化数为0的单质,但对氯来说,因氯单质为气态且氧化能力很强,所以人为选取了一个处于溶液的更稳定的Cl-作为还原态基准。
各含氧酸(根)在酸性介质中的氧化性比在碱性介质中的强。这是因为含氧酸在酸性溶液中还原时的产物之一为水,而在碱性溶液中还原时需消耗水[1]。

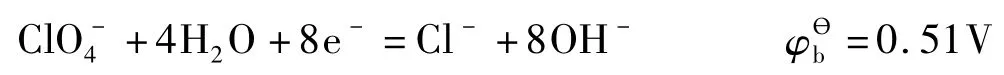
生成水时有能量放出,消耗水时需要能量。因此,这种能量效应必然对含氧酸的氧化性产生影响。
在酸性介质中,HClO和HClO2等弱电解质因羟基H+产生的强的反极化作用,使Cl—O之间的电子向H+转移,导致中心原子Cl的正电性增强,接受电子的趋势增大,氧化能力增强。
在碱性介质中,氯的含氧酸(根)的氧化性按ClO->>>的顺序变化。其变化规律可用以下两方面原因进行解释。
(1)结构因素。
含氧酸根离子结构的对称性越高,稳定性越高,表现为含氧酸根离子的氧化性越低,原因是外来电子选择最佳位置进攻这一离子并进入中心原子价层轨道的难度越大。
表1示出氯的各含氧酸根的结构和一些参数。

表1 氯的含氧酸根的结构及一些参数
在氯的含氧酸根中,中心原子氯均以sp3杂化(不等性和等性)轨道与氧原子形成σ键。
在含有孤电子对的不等性杂化轨道中,由孤电子对占据的杂化轨道的s成分较多,能量较低,而成键电子占据的杂化轨道的s成分少,能量较高。
这样,ClO-中成键电子的s成分最少,能量最高,Cl—O键强度最小;而中的成键电子的s成分最多,能量最低,Cl—O键强度最大。
使用结构对称性的影响因素可以完满解释酸性介质中HClO2的氧化性最强(设还原产物均为Cl-)的现象。关于HClO2的氧化性最强的问题,一般的教科书或者回避,或者以其热力学数据不全和不准为理由而不予讨论。本文使用CCSD(T)/aug-cc-pVTZ方法对HClO2的结构进行了计算,根据优化的结果,发现其4个原子不在一个平面,HOCl和OClO两个平面间的夹角为80.4°。所以亚氯酸没有对称元素,属C1点群。而HClO的3个原子处于一个平面,该平面就是分子的对称面,属Cs点群。HClO2的对称性比HClO低。根据此结果,HClO2的强氧化性就不难理解了。
(2)能量因素。
从能量的角度说,氧化反应放出的能量越多,氧化性越强。设氯的含氧酸根的被还原产物均为Cl-,其氧化性的相对强弱主要取决于拆开Cl—O键的难易程度。
显然,Cl—O键的键能越大,氧化性越弱。
根据鲍林的电中性原理,每个原子上的形式电荷应等于0或近似等于0。
由于从ClⅠ到ClⅦ,半径变小,杂化轨道和d轨道都随之变小,σ键和(p-d)π键的强度都增大,所以Cl—O键的断裂变难,对应的含氧酸根的氧化性变弱。
从表1列出的氯各含氧酸根Cl—O键的强度可以看出,从ClO-、到,Cl—O键的键能增大,因此,ClO-、和的氧化性依次减弱。
除此之外,随着含氧酸根的含氧数增加,在被还原过程中,需被断裂的Cl—O键的数目增多,因而也更稳定。
综上,元素原子的氧化数是人为指定的形式电荷,而由具有某特定氧化数的原子所组成的物种的氧化性是由多方面因素决定的,物种的氧化性与某原子的氧化数无必然的联系。那种认为某原子的氧化数越高,由该特定氧化数的原子所组成的物种的氧化性越强的认识显然是不对的。
建议在叙述氧化性的变化趋势时最好不要涉及名词“氧化数”,以避免将氧化性同氧化数关联。一旦发生了关联,就容易造成氧化数高则氧化性强、氧化数低则还原性强的错误印象。
有人根据下面的两个电对的电极电势
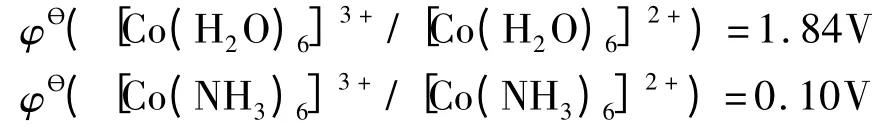
给出了一个结论:“强电子对给予体具有稳定高氧化态的能力”。
但事实上,强电子对给予体也具有稳定低氧化态的能力。下面的电极电势表明,随着配体场强的增加,Fe3+的配离子的氧化性增强,Fe2+的配离子的还原性减弱[2]。
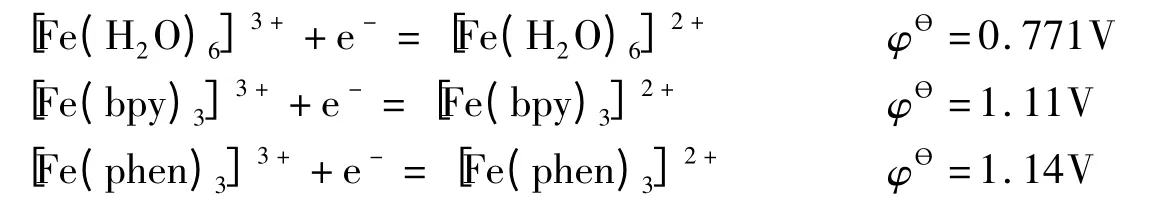
这是因为,由于d6组态的成对能小,d5、d7成对能大,因此,Fe3+(d5)还原到Fe2+(d6)可能伴随自旋的降低,而Co3+(d6)还原到Co2+(d7)可能伴随自旋的升高。前者使配体场稳定化能增加,而后者使配体场稳定化能减少。配体场越强,这些效应就越大。这就是强电子对给予体能使Fe2+、Co3+稳定的原因。
实际上,Fe3+也可以使用强场配位体去稳定:
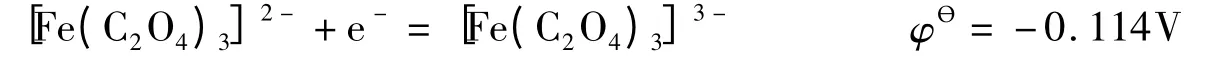
这似乎同前面讨论所作出的结论相矛盾。事实上,使用热力学分析可以找到答案。
与此相反,中性配位体配合物[Fe(H2O)6]3+还原为[Fe(H2O)6]2+是电荷数由+3→+2。配位阳离子正电荷减少,对水分子的牵制作用减弱,混乱度增大,系统的熵值增大。
因此,配体场的存在怎么影响电极电势?什么情况使电极电势增加?什么情况使电极电势减小?应该根据具体情况进行分析,不能一概而论。
[1]唐宗薰.中级无机化学.第2版.北京:高等教育出版社,2009
[2]唐宗薰.中级无机化学教学指导.北京:高等教育出版社,2010
[3]唐宗薰.无机化学热力学.北京:科学出版社,2010
