NO氧化反应速率常数与温度负相关原因的讨论
2014-02-13王家成张树永
王家成 张树永
(山东大学化学与化工学院 山东济南250100)
从19世纪中叶开始,人们对于温度对反应速率的影响进行了比较系统的研究,发现速率常数(k)与温度(T)的关系主要有五种类型,见图1[1]。
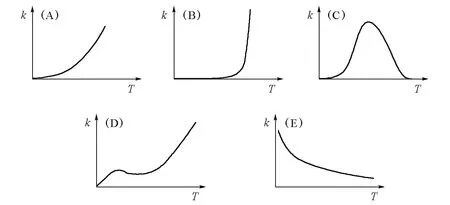
图1 反应速率常数(k)与温度(T)关系的5种主要类型
图1中的(A)型也称阿累尼乌斯(Arrhenius)型,其k~T关系符合阿累尼乌斯经验公式:

即:

图1中的(B)、(C)、(D)3种类型均不符合阿累尼乌斯公式;图1(E)型反应比较特殊,实例非常少见,最典型的例子是NO的氧化[2]:

1 基于简单反应的讨论
基于简单反应的讨论也可以称作基于NO2二聚体过渡态的讨论。
文献[3]将式(3)视为基元反应,并分别给出了其在600K和645K时k+1和k-1的数值,据此可以计算其正逆反应的活化能分别为Ea,+1=-1.196kJ·mol-1和Ea,-1=112.9kJ·mol-1。
上述数值与文献[4]报导的活化能-4.6kJ·mol-1并不相同,但活化能均为负值。负活化能与阿累尼乌斯定义的活化能矛盾,让人难以接受,这也是式(3)引发人们强烈好奇心的重要原因之一[5]。
研究表明[5-6],在273~600K之间,式(3)的活化能为负值,其速率常数与温度的关系可表示为:
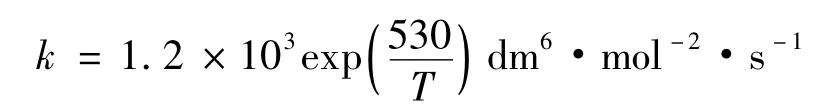
反应为三级反应,其活化能为-4.41kJ·mol-1。当温度超过650K时,活化能变为正值。
如果假设式(3)为三分子基元反应(termolecular reaction)[5-6],经过过渡态[ONOONO,则反应过程可表示为:

理论计算表明,该反应的活化能为负值[5]。因式(4)所示机理无法解决负活化能这一令人费解的现象,因此,人们更倾向于采用两步反应来解释[6]。
2 基于NO二聚体中间体的讨论
有实验证明反应过程中存在(ON┈NO)中间体。已知NO分子的电子排布为(σ1s)2(σ1s*)2(σ2s)2(σ2s*)2(σ2p)2(π2p)4(π2p*)1[7],其π2p*轨道上有一成单电子,故NO的性质类似自由基[8],容易相互结合形成二聚体(ON┈NO)。该二聚体有顺式(cis-)和反式(trans-)两种构型[9]。故有人提出式(3)实际上是一个复杂的连串反应,目前被广泛接受的机理是[1-2,5-6]:

采用速率控制步骤近似和平衡近似原理[1-2],可以导出其速率方程:

式(6)表明式(3)为三级反应,与实验事实一致[5]。由式(6)可得出反应的表观活化能(Ea,app)为:

根据反应活化能估算的经验规则[4,10],机理(式(5))中第一步反应的正反应属于自由基结合,其Ea,1的数值很小甚至为0,而其逆反应活化能Ea,-1等于破坏(ON┈NO)二聚体中相互作用所需的能量,应该具有比较大的数值。这似乎表明该平衡应该偏向右侧,但有文献报导[6],在298K时,第一步平衡只有0.0065%的NO以二聚体形式存在,说明二聚体的浓度很低。测量和理论计算均表明,二聚体的结合能并不高[9,11-15],大约在8.37[9]~11.95kJ·mol-1[11]之间,也有报导为6.47kJ·mol-1[15]。因此,第一步反应中的正反应和逆反应均应属于快反应;而由式(7)可知Ea,2<Ea,-1,故第二步反应的活化能也非常小,也应为快反应。
要使式(3)的Ea,app<0,只需满足Ea,-1>Ea,2+Ea,1即可。式(3)的表观活化能与式(5)对应的各基元反应活化能之间的关系示于图2。
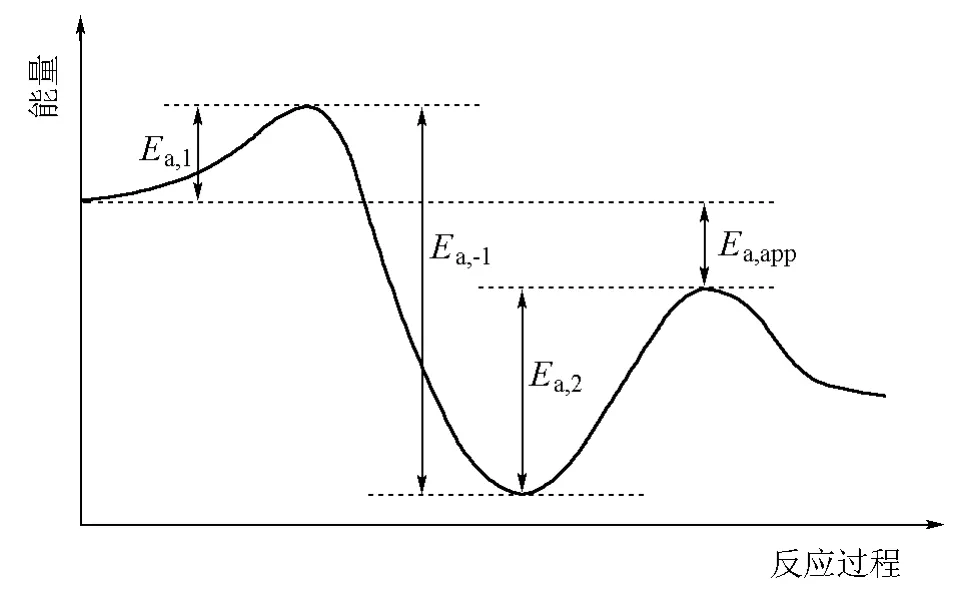
图2 NO氧化反应表观活化能与各基元反应活化能的关系
图2 显示,机理(式(5))中第一步是放热的可逆反应,但放热不大。当温度升高时,该平衡左移致[(NO)2]减小。由式(6)可知,[(NO)2]的减小会导致降低,从而出现式(3)的速率常数随温度升高而降低的现象[2]。
以上讨论表明,采用式(5)所示机理,通过速率控制步骤近似和平衡近似并结合平衡移动原理,可以比较圆满地解释NO氧化反应的速率常数随温度升高而降低这一“反常”现象。同时也说明,式(3)的活化能只是表观活化能,没有确切的物理意义,其大小取决于3个相关基元反应活化能的相对大小,而所有基元反应的活化能均为正值,不存在活化能为负的“反常”现象,故式(5)更易为人接受[1-2]。
虽然上述讨论对式(3)负活化能现象给出了合理解释,但该讨论在推导过程中却忽视了一些前提假设的正确性。例如,如果Ea,app<0,必然有Ea,-1>Ea,2和k-1<k2[O2],这不符合平衡近似处理的条件(表1)[1],故采用平衡近似求解[(NO)2]并不可靠。

表1 对式(5)进行近似处理的条件分析
如果采用稳态近似方法处理式(5),可以得到如下速率方程[6]:

式(8)表明该反应没有确定级数,表观活化能与各基元反应活化能之间也不存在对应关系。当k-1≫k2[O2](即满足平衡近似条件)时,式(8)可化简为式(6)。但由图2可知,此处Ea,1<Ea,2,即NO二聚体的消耗速率小于其生成速率,故对NO二聚体进行稳态近似处理的条件也不存在了(表1)。
另外,作为速率控制步骤近似的条件,第二步反应的活化能应较第一步高10kJ·mol-1以上,对于式(5)也很难满足这一要求。因此,采用常用的速率控制步骤近似、稳态近似和平衡近似来处理式(5)所示机理并不合理。而不经近似处理直接求解式(5)的难度很大,且无法得出令人满意的结论[16]。
3 基于NO3中间体的讨论
为解释式(3),人们还提出了其他机理[5-6],如:

在该机理中,NO可以看作自由基,而NO3也具有自由基的性质[14]。第一步反应的正反应活化能(Ea,+)较小,其逆反应涉及作用的破坏,应具有较高的活化能(Ea,-1)。第二步反应涉及N┈O和O—O键的断裂,所以活化能(Ea,2)较大,可以作为速率控制步骤。有关活化能的讨论可以仿照第2部分的讨论;对NO3进行速率控制步骤近似和平衡近似处理可以直接得出式(6),如果采用稳态近似处理可以先得到式(8),再在k-1≫k2[O2]的条件下转化成式(6)[6]。
因此,式(9)所示机理同样可以说明式(3)为三级反应,表观活化能为负值,速率常数随温度升高而下降等实验事实。而且从活化能和速率的角度分析,式(9)所示机理比式(5)更具合理性[6]。
这里必须说明,无论式(4)、式(5)还是式(9)都有其合理性[6],但也都有其不合理的地方,因此有关式(3)的研究还远称不上完善[4]。
[1]印永嘉,奚正楷,张树永.物理化学简明教程.第4版.北京:高等教育出版社,2007
[2]Chang R.Physical Chemistry for the Chemical and Biological Science.California:University Science Books,2000
[3]杨永华.物理化学.北京:高等教育出版社,2012
[4]傅献彩,沈文霞,姚天扬,等.物理化学.第5版.北京:高等教育出版社,2006
[5]Gadzhiev O B,Ignatov S K,Razuvaev A G,et al.J Phys Chem A,2009,113(32):9092
[6]Tsukahara H,Ishida T,Mayumi M.Nitric Oxide,1999,3(3):191
[7]朱万强,罗宿星,李华刚,等.大学化学,2013,28(1):23
[8]Lund A,Shimada S,Shiotani M.Principles and Applications of ESR Spectroscopy.New York:Springer,2011
[9]Marouani S,Bahri M,Batis H,et al.J Phys Chem,2010,114(9):3025
[10]Hu Y.Physical Chemistry.Beijing:Higher Education Press,2013
[11]Pedro P S,Jesus R S,Ramon H L.J Phys Chem A,2011,115:2892
[12]Tobita M,Perera S A,Musial M,et al.J Chem Phys,2003,119:10713
[13]Wade E A,Cline J I,Lorenz K T,et al.J Chem Phys,2002,116:4755
[14]Morris V R,Bhatia S C,Hall J H Jr.J Phys Chem,1990,94(19):7414
[15]Gadzhiev O B,Ignatov S K,Gangopadhyay S,et al.J Chem Theor Comput,2011,7:2021
[16]Wesley W B.J Math Chem,2011,49(2):328
