Livin与Caspase-3在口腔鳞状细胞癌中的表达及相关性研究
2014-02-13解传斌颜雨春
解传斌,颜雨春
Livin与Caspase-3在口腔鳞状细胞癌中的表达及相关性研究
解传斌,颜雨春
目的探讨凋亡抑制蛋白(IAP)Livin和半胱氨酸天冬氨酸蛋白酶-3(Caspase-3)在口腔鳞状细胞癌(OSCC)中的表达及其相关性,为对患者诊断及监测、评估术后复发、转移的风险程度提供参考。方法采用RT-PCR法对45例OSCC组织及11例正常口腔组织(NOT)中的Livin mRNA与Caspase-3 mRNA的表达进行检测。结果Livin mRNA与Caspase-3 mRNA在45例OSCC组织及11例NOT组织均有不同程度的表达;Livin mRNA在OSCC组织中的表达高于NOT组织(P<0.05),在有淋巴结转移组的表达高于无淋巴结转移组,差异有统计学意义(P<0.05)。两者在OSCC组织中的相对含量均与患者的性别和年龄无关,但与肿瘤的病理分期、分化程度有关,相关分析显示Livin mRNA与Caspase-3 mRNA在OSCC组织中的表达呈相关关系,差异有统计学意义(P<0.01)。结论Livin与Caspase-3基因的异常表达与OSCC的病理生物学行为密切相关,联合检测Livin与Caspase-3可为评价OSCC的浸润、转移及患者预后提供临床参考,为研究OSCC发病机制提供新的思路。
口腔鳞状细胞癌;凋亡抑制蛋白Livin;半胱氨酸天冬氨酸蛋白酶-3;RT-PCR
在头颈部恶性肿瘤中,口腔鳞状细胞癌(oral squamous cell carcinoma,OSCC)较常见,因其恶性程度较高,且具有较强的浸润性,易发生淋巴结及远处脏器转移,严重危害患者的生命安全。我国口腔颌面部的恶性肿瘤80%以上为鳞状细胞癌,5年生存率约为60%,且发病率呈逐渐上升趋势[1]。目前针对OSCC 的研究较多集中于细胞凋亡和增殖的平衡机制方面,已证实凋亡抑制蛋白(inhibitor of apoptosis protein,IAP)Livin及半胱氨酸天冬氨酸蛋白酶-3(Caspase-3)在上述过程中发挥重要作用。在乳腺癌、膀胱癌、肾细胞癌、脑星形细胞瘤等多种恶性肿瘤组织中均发现Livin的表达[2-5];Caspase-3作为半胱氨酸蛋白酶家族中的一员,在细胞凋亡过程中发挥重要作用,而拮抗或抑制Caspase-3的活性可抑制细胞凋亡发生[6]。但二者在OSCC及正常口腔组织(NOT)中表达情况则少有报道,该实验采用RTPCR技术检测分析OSCC及NOT中Livin mRNA与Caspase-3 mRNA的表达程度,探讨两者在OSCC发生、发展中的作用及相互关系。
1 材料与方法
1.1 标本来源选取2011年10月~2013年2月在安徽医科大学第一附属医院口腔颌面外科就诊,并均经组织病理检查确诊为OSCC患者新鲜组织标本45例,另选11例患者为阴性对照组(NOT组)。所有OSCC组患者均为首次确诊,术前均未行放、化疗或其他抗肿瘤治疗,均无远端脏器的转移,无其他恶性肿瘤史,无家族肿瘤史。所有切取的45例OSCC组织中男28例,女17例;年龄43~79(43.21± 16.73)岁;依国际抗癌联盟(Union for International Cancer Control,UICC)(2002)口腔癌TNM分类分期:Ⅰ~Ⅱ期30例,Ⅲ~Ⅳ期15例;参照1997年世界卫生组织(World Health Organization,WHO)病理学标准分级:高分化29例,中低分化16例;伴有颈部淋巴结转移18例,无淋巴结转移者27例。另11例NOT组织标本中7例取自阻生齿拔除患者,4例取自牙槽嵴修整患者。所有标本均于术中取材后立即置于液氮中,然后移至-80℃超低温冰箱中贮存备用。
1.2 主要试剂及仪器PCR试剂、逆转录试剂盒、TRIzol试剂、DNA Marker、Taq DNA聚合酶(Fermentas公司,美国);TGL-16H冷冻离心机(黑马仪器公司,中国);琼脂糖凝胶(OXOID公司,英国);TGL-18R冷冻离心机、DYY-6B型稳压稳流电泳仪(北京六一仪器厂);溴化已锭(10 mg/ml)(Sigma公司,美国);2720PCR仪器(ABI公司,美国);GSM凝胶图像分析管理系统(3.0)(美国SIM公司)。
1.3 实验方法Livin与Caspase-3及内参β-action引物均由上海生工生物工程技术服务有限公司运用Primer Premier 5.0软件设计并合成引物,见表1。取备用组织100 mg按TRIzol法提取总RNA,用MMLV第1链cDNA合成试剂盒逆转录。RT-PCR:以逆转录产物2 L作为模板,选用PCR扩增试剂在PCR仪上进行PCR扩增,以β-actin为内参。在PCR仪中,Livin的扩增条件为:94℃45 s,退火53℃45 s,延伸72℃45 s,冰上冷却,扩增35个循环;Caspase-3的扩增条件:94℃45 s,退火55℃45 s,延伸72℃45 s,冰上冷却,扩增35个循环;内参β-actin的PCR扩增条件为:94℃30 s,退火55℃30 s,延伸72℃30 s,冰上冷却,扩增30个循环。反应结束后,取适量PCR反应产物于2%琼脂糖凝胶上电泳,EB染色。用数字化凝胶成像系统采集图像,半定量分析电泳条带的灰度值。结果以目的条带与内参条带的灰度值的比值表示。每个样本重复3次。

表1 Livin、Caspase-3及内参β-actin引物序列和片段长度
1.4 统计学处理应用SPSS 17.0统计软件对数据进行分析,采用χ2检验分析Livin mRNA与Caspase-3 mRNA在OSCC组织中的表达差异,两种指标之间的表达相关性采用Pearson列联系数相关分析。
2 结果
2.1 Livin mRNA与Caspase-3 mRNA的在OSCC和NOT组织中的表达Livin mRNA与Caspase-3 mRNA RT-PCR产物电泳结果提示Livin mRNA与Caspase-3 mRNA在NOT组织中均少量表达,但在OSCC中,Livin mRNA的表达量高于Caspase-3 mRNA,见图1。Caspase-3 mRNA在OSCC与NOT组织中的表达量差异无统计学意义(P>0.05),Livin mRNA在OSCC中的表达量(0.542± 0.074)高于NOT组织(0.181±0.026),差异有统计学意义(P<0.01),见表2。Livin mRNA与Caspase-3 mRNA在OSCC及NOT组织中的表达率,见表3。
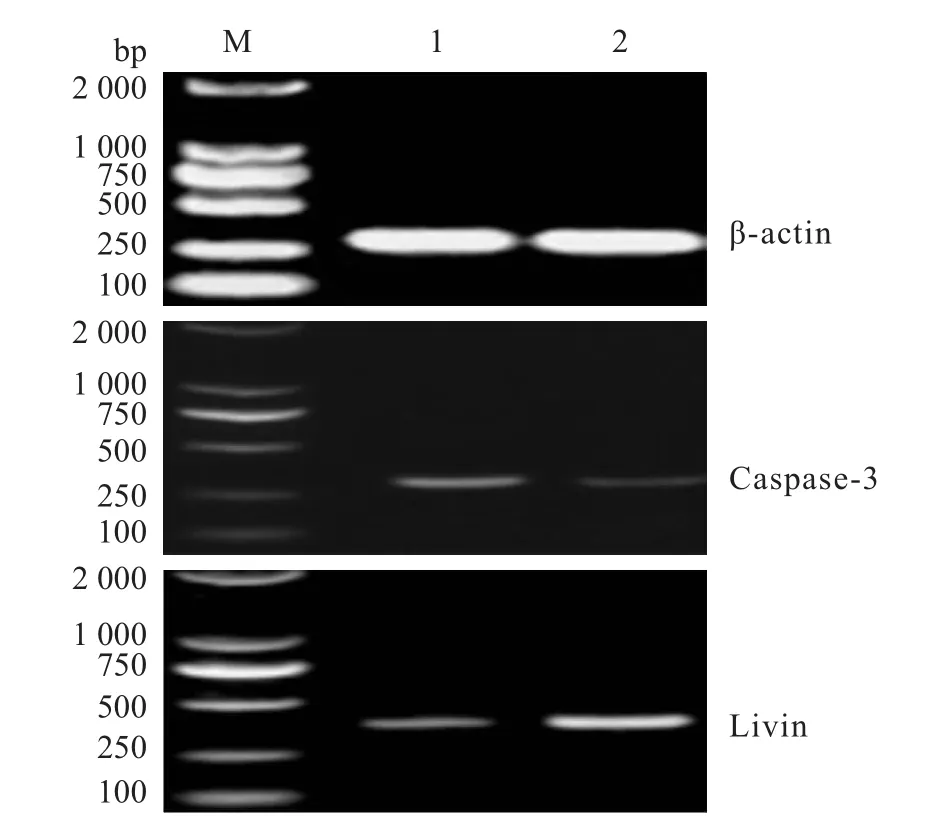
图1 RT-PCR检测Livin mRNA与Caspase-3 mRNA的表达
表2 Livin mRNA与Caspase-3 mRNA在OSCC和NOT组织中的相对含量(±s)
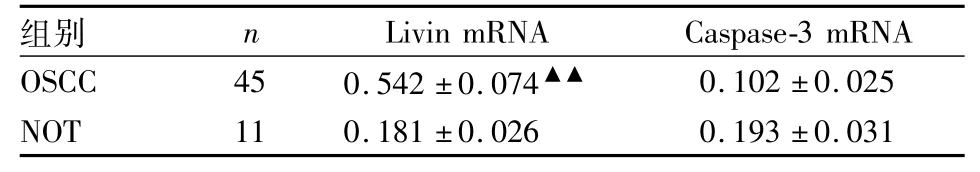
表2 Livin mRNA与Caspase-3 mRNA在OSCC和NOT组织中的相对含量(±s)
与NOT组比较:▲▲P<0.01
组别n Livin mRNACaspase-3 mRNA OSCC450.542±0.074▲▲0.102±0.025 NOT110.181±0.0260.193±0.031

表3 Livin mRNA与Caspase-3 mRNA在OSCC及NOT组织中的表达率[n(%)]
2.2 Livin mRNA、Caspase-3 mRNA表达与OSCC患者临床病理参数的关系Livin mRNA在伴有淋巴结转移、中低分化、Ⅲ~Ⅳ期的OSCC组织中的表达高于无淋巴转移、高分化、Ⅰ~Ⅱ期的OSCC组织(P<0.01)。Caspase-3 mRNA在伴有淋巴结转移、中低分化、Ⅲ~Ⅳ期的OSCC组织中的表达低于无淋巴转移、高分化、Ⅰ~Ⅱ期的OSCC组织(P<0.05)。Livin mRNA与Caspase-3 mRNA的表达在OSCC患者年龄、性别参数方面的差异无统计学意义(P>0.05)。说明Livin mRNA在OSCC组织中的相对含量,随着OSCC组织分化的增高而增高,亦随着组织学分级的增高而增高,且与淋巴结转移有关,见表4。
表4 Livin mRNA与Caspase-3 mRNA在OSCC组织中的表达与临床病理的关系(±s)

表4 Livin mRNA与Caspase-3 mRNA在OSCC组织中的表达与临床病理的关系(±s)
项目nLivin mRNAt值P值Caspase-3 mRNAt值P值性别0.8720.388-0.1620.872男280.533±0.0800.101±0.023女170.555±0.0710.103±0.030年龄(岁)0.6820.278-0.1540.864<54160.539±0.0610.099±0.019≥54290.543±0.0820.104±0.026分期-11.843<0.0012.8390.007Ⅰ~Ⅱ300.395±0.0510.113±0.024Ⅲ~Ⅳ150.836±0.0820.081±0.028淋巴结转移-10.209<0.0013.2340.004无270.412±0.0650.115±0.025有180.737±0.0690.084±0.027分化程度-12.014<0.0013.0050.001高分化290.399±0.0710.116±0.021中低分化160.801±0.0640.076±0.030

表5 Livin mRNA与Caspase-3 mRNA在OSCC中表达的相关性
2.3 Livin mRNA、Caspase-3 mRNA在OSCC组织中表达的相关性在45例OSCC组织中,仅测得2例Livin mRNA与Caspase-3 mRNA同时表达,未测得两基因同时不表达的组织。仅Caspase-3 mRNA表达者12例,仅Livin mRNA表达者31例。根据Pearson列联系数相关分析,Livin mRNA与Caspase-3 mRNA在OSCC组织中的表达呈相关关系,差异有统计学意义(P<0.01),见表5。
3 讨论
细胞凋亡是细胞的生理性死亡过程,它是受基因控制的,不但需要许多与免疫相关的凋亡信号介导,还需要凋亡诱导剂和抑制剂的参与来共同完成细胞凋亡。Caspase-3是Caspase家族中最重要的凋亡执行者之一,Caspase-3被激活后能水解大量蛋白底物,激活其他种类的Caspase,最终导致细胞凋亡[7],说明Caspases-3对细胞凋亡是必需的。Caspase-3在OSCC组织中明显降低,提示Caspase-3活化减少,不能引起足够的细胞凋亡,使细胞异常增殖,引发癌变[8]。
Livin作为凋亡抑制基因,是近年来发现的凋亡抑制蛋白家族(IAPs)中的新成员。目前发现的人类IAP家族成员共有8个,其共同结构特点是N端有一个或多个(目前最多为3个)串联的杆状病毒IAP重复序列,C端含有或不含有一个环指结构[9]。Livin抑制细胞凋亡作用主要是通过其BIR区与Caspases家族结合,抑制其活性,尤其是抑制Caspases-3/-7和Caspases-9的活性,阻止Caspase蛋白在细胞凋亡时的正常功能[10]。因此,细胞凋亡途径失去重要的酶,使凋亡酶依赖的细胞凋亡无法正常进行。
本研究结果提示,在OSCC组织中,Caspase-3 mRNA的阳性表达率明显低于NOT组织,其相对含量也低于NOT组织,且随着临床分期的增加、肿瘤分化程度的降低,其相对含量也相应降低,而与年龄、性别因素无关。在NOT组织中,Caspase-3 mRNA的相对含量和表达率都比较高;而在OSCC组织中,Caspase-3 mRNA的表达较低。这与毛丽梅等[11]报道相似。提示Caspase-3可能在OSCC的发生、发展、侵袭和转移机制中起抑制作用。
Schmollinger et al[12]研究发现Livin的表达缺失可使肿瘤实现免疫逃避,提示Livin或可作为肿瘤免疫治疗的一个有效靶点。陶菲克等[13]研究发现皮肤鳞癌组织中Livin蛋白的阳性表达率为72.2%,提示Livin基因在皮肤鳞癌发生、发展中起作用。本实验结果显示,Livin在OSCC组织中阳性表达率高于NOT组织,并且其表达与OSCC的病理分期、分化程度及淋巴结转移有关,提示Livin可能在OSCC的发展、浸润、转移中起重要作用,这与吴文新等[14]在大肠管状腺瘤癌变中的研究一致,刘俊华等[15]在非小细胞肺癌中的研究也得出了类似的结论。
本研究表明,Livin mRNA在NOT中低表达或表达缺失,而在OSCC组织中的阳性表达率和相对含量明显升高,差异有统计学意义;同时显示Livin mRNA在伴有淋巴结转移组的OSCC组织中,Livin mRNA的相对含量也高于无淋巴结转移组,并且在OSCC组织中的相对含量与病理分化程度、临床分期呈正相关,而与年龄、性别因素无关。提示Livin可能参与促进了OSCC的发生、发展,其或可作为评价OSCC临床分期,评估其恶性程度及预后的一个有用指标,说明Livin在OSCC的发生、发展过程中起重要作用。Livin mRNA与Caspase-3 mRNA在OSCC组织中的表达呈相关关系,差异有统计学意义,提示Livin与Caspase-3在OSCC的发生、发展中可能存在相互抑制的作用。Caspase-3编码的蛋白表达降低,从而减弱了其对Livin的抑制作用,而Livin表达增加,促进细胞增殖活性,过多的细胞凋亡抑制,引起细胞周期调控异常,使口腔黏膜上皮过度增生,在各种理化因素作用下最终发生癌变。本研究提示联合检测Livin与Caspase-3可以为OSCC临床分级、分期、评估预后提供数据支持,但仍需大量的临床数据进一步研究。
[1] 张志愿.口腔颌面外科学[M].7版.北京:人民卫生出版社,2012:324-9.
[2] Yagihashi A,Ohmura T,Asanuma K,et al.Detection of autoantibodies to survivin and livin in sera from patients with breast cancer[J].Clin Chim Acta,2005,362(1-2):125-30.
[3] 宋希双,张志伟,车翔宇,等.凋亡抑制基因Livin在膀胱癌中的表达及意义[J].中华泌尿外科杂志,2006,27(supp1):37-9.
[4] Wagener N,Cmkovic-Mertens I,Vetter C,et al.Expression of inhibitor of apoptosis protein Livin in renal cell carcinoma and nontumorous adult kidney[J].Br J Cancer,2007,97(7):1271-6.
[5] 向 欣,黄正松,石忠松,等.脑星形细胞瘤Livin基因表达与细胞增殖的关系[J].中华实验外科杂志,2005,22(9):1141.
[6] 龚非力.医学免疫学[M].北京:科学出版社,2005:251-2.
[7] Madeo F,Carmona-Gutierrez D,Ring J,et al.Caspase-dependent and caspase-inde endent cell death pathways in yeast[J].Biochem Biophys Res Commun,2009,382(2):227-31.
[8] 张志伟,张月兰.口腔鳞癌组织中Survivin、Caspase-3的表达变化及意义[J].山东医药,2009,49(34):89-90.
[9] Salvesen G S,Duekett C S.IAP proteins:Blocking the road to death’s door[J].Nat Rev Mol Cell Biol,2002,3(6):401-10.
[10]刘 芳,周克元.新的凋亡抑制因子Livin[J].生命的化学,2004,24(1):19-21.
[11]毛丽梅,王向红,李丽华,等.Livin和Caspase-3在宫颈鳞状细胞癌癌变中的表达及意义[J].河北医药,2010,32(23):3288-90.
[12]Schmollinger J C,Vonderheide R H,Hoar K M,et al.Melanoma inhibitor of apoptosis protein(ML-IAP)is a target for immune-mediated tumor destruction[J].Proc Natl Acad Sci USA,2003,100(6):3398-403.
[13]陶菲克,涂亚庭.凋亡抑制蛋白livin在人皮肤鳞状细胞癌中表达的初步研究[J].临床皮肤科杂志,2009,38(1):15-7.
[14]吴文新,刘惠民,崔爱荣,等.Livin和Caspase-3在散发性大肠管状腺瘤癌变过程中的表达及相关性研究[J].中国全科医学,2012,15(60):2049-51.
[15]刘俊华,吴纪祥,刘益飞,等.Livin在非小细胞肺癌中的表达及临床意义[J].现代肿瘤医学,2010,18(2):247-9.
Expression and relativity of Livin and Caspase-3 inhuman oral squamous cell carcinoma
Xie Chuanbin,Yan Yuchun
(Dept of Stomatology,The First Affiliated Hospital of Anhui Medical University,Hefei 230022)
ObjectiveTo investigate the expression and relativity of Livin and Caspase-3 in oral squamous cell carcinoma(OSCC).MethodsThe expression of Livin mRNA and Caspase-3 mRNA in 45 cases of OSCC and 11 cases of normal oral tissue were detected by reverse RT-PCR.ResultsThe positive expression rates of Livin mRNA in OSCC were significantlyhigher than those in normal oral tissue(P<0.05).Compared with those without lymph node metastasis in OSCC,the positive ratios of Livin mRNA with lymph node metastasis were significantlyhigher(P<0.05).The expressions of Livin were significantly related with pathological stage and the lymph node metastasis,but neither of them was correlated with sex and age.Correlation analysis showed that Livin expression level was related to Caspase-3 level(P<0.01).ConclusionThe abnormal expressions of Livin and Caspase-3 are closely related to the occurrence,progress and metastasis of OSCC,which can evaluate the degree of malignancy and prognosis of patients with OSCC reference.
oral squamous cell carinoma;inhibitor of apoptosis protein Livin;Caspase-3;RT-PCR
R 739.8
A
1000-1492(2014)04-0498-04
2013-12-05接收
安徽省卫生厅科研项目(编号:2010-B-15)
安徽医科大学第一附属医院口腔科,合肥 230022
解传斌,男,硕士研究生;颜雨春,男,教授,主任医师,硕士生导师,责任作者,E-mail:99yyc@sina.cn
