CXCL16及CXCL10在狼疮性肾炎患者中的表达及与疾病活动的相关性
2014-02-13徐星铭
夏 琼,徐星铭
CXCL16及CXCL10在狼疮性肾炎患者中的表达及与疾病活动的相关性
夏 琼,徐星铭
目的探讨趋化因子配体16(CXCL16)及趋化因子配体10(CXCL10)在狼疮性肾炎(LN)患者血清、尿液以及肾脏内的表达以及与疾病活动的关系。方法ELISA法检测LN患者及正常对照者血清、尿液中CXCL16、CXCL10的表达水平,免疫组化法检测经肾脏活检确诊为LN的患者以及正常对照者肾脏组织中的CXCL16的表达水平。结果
狼疮性肾炎;CXCL16;CXCL10
系统性红斑狼疮(systemic lupus erythematosus,SLE)是一种累及多系统,以T、B淋巴细胞功能异常为主要特征的自身免疫性疾病,有着复杂的细胞及细胞因子的相互作用。趋化因子作为重要的细胞因子之一,在介导细胞间相互作用以及调节体内免疫平衡起着至关重要的作用。研究[1]表明,趋化因子配体10(CXCL10)可能参与SLE的发病过程,并与SLE活动度有关,通过与受体CXCR3结合诱导炎性细胞聚集到炎症部位并释放细胞因子。趋化因子配体16(CXCL16)作为CXC家族的新成员[2],通过特异性与CXCR6结合从而募集T细胞、NKT细胞到达不同组织启动多种急慢性炎症。在狼疮小鼠中可见血液以及尿液的CXCL16的表达有所增加,且与系统性红斑狼疮疾病活动指数(SLEDAI)评分有关[3],但关于CXCL16在狼疮性肾炎(LN)患者肾内的表达尚未见报道。该研究通过检测CXCL10、CXCL16体内水平,揭示二者可能参与疾病发病机制,并为临床评估提供新的线索。
1 材料与方法
1.1 病例资料收集2012年3月~2013年3月安徽医科大学第一附属医院肾脏内科76例住院患者血清(其中43例患者同时留取尿液),其中男7例,女69例,年龄14~59(33.34±11.7)岁。所有患者均符合美国风湿病协会(ARA)修订的SLE标准。收集14例门诊健康体检者(各项生化指标正常、自身抗体阴性、无糖尿病、高血压等基础疾病)的血清和尿液作为正常对照组,其中男2例,女12例,年龄18~35(26.35±5.24)岁。76例患者中有41例经肾脏活检确诊为LN(Ⅲ型7例,Ⅳ型26例,Ⅴ型8例)。选取10例泌尿外科肾肿瘤切除患者远离肿瘤部位至少2 cm的肾脏组织作为正常肾脏组织对照。本实验符合院伦理委员会要求,入选患者均知情并签署同意书。
1.2 主要试剂CXCL16、CXCL10的ELISA试剂盒购自上海源叶生物科技公司;兔抗人CXCL16单克隆抗体购自美国Abcam公司(ab101404);正常山羊血清封闭液、PBS缓冲液、柠檬酸盐缓冲液、二抗试剂盒(试剂B、C分别为生物素化通用二抗工作液,辣根酶标记链霉卵白素工作液)、DAB显色试剂盒均购自北京中杉金桥公司。
1.3 方法
1.3.1 临床资料及相关指标的收集 记录患者入院后所检测的临床指标,包括血尿常规、肝肾功能、免疫球蛋白+补体、24h尿蛋白定量、肾脏活检病理类型等,并计算患者的SLEDAI评分。LN患者及正常对照者清晨空腹常规肘静脉采血3 ml置于含有枸橼酸钠抗凝剂的试管中,LN患者的尿液一般收集于首次入院后,正常对照者收集于门诊的随机尿,后均以2 500 r/min离心10 min,分离上清液置于-80℃冰箱留待测定。
1.3.2 ELISA法测定CXCL16、CXCL10水平 按照试剂盒说明书操作,分别测定血清及尿液中CXCL16、CXCL10水平。
1.3.3 免疫组化 石蜡切片(2 μm)脱蜡,水化,微波修复,H2O2孵育,封闭后加入一抗(1∶100),4℃冰箱内过夜,后B、C试剂孵育,DAB显色,苏木精复染,PBS返蓝,脱水,封片。免疫组化图片使用Image Pro-Plus 16.0图像分析软件处理,以高倍镜下累计光密度(IOD)平均值代表该患者肾内CXCL16表达水平。
1.4 统计学处理采用SPSS 20.0统计软件分析,数据以±s表示。多组间比较采用单因素方差分析,两组间比较用t检验,指标相关性用Pearson相关分析。
2 结果
2.1 血清中CXCL16、CXCL10的表达ELISA法检测LN组血清CXCL16水平高于正常对照组(P<0.05,F=0.56,t=2.44),CXCL10同样升高(P<0.05,F=2.94,t=3.97),见表1。Pearson线性相关分析提示二者血清中的表达水平呈正相关(r=0.68,P<0.01)。方差分析显示Ⅲ型、Ⅳ型、Ⅴ型LN之间的血清CXCL16、CXCL10表达水平差异无统计学意义(P>0.05)。
表1 LN患者与正常对照者血清CXCL16、CXCL10表达水平(μg/L,±s)

表1 LN患者与正常对照者血清CXCL16、CXCL10表达水平(μg/L,±s)
与正常对照组比较:*P<0.05
组别n CXCL10CXCL16正常对照146.48±2.212.31±0.73 LN7610.59±3.72*2.99±0.98*Ⅲ型78.24±2.432.68±0.54Ⅳ型2611.17±3.26*3.12±1.01*Ⅴ型89.46±1.93*2.84±0.91*
2.2 尿液中CXCL16、CXCL10的表达ELISA法检测LN组尿液中的CXCL16、CXCL10表达均高于正常对照组(P<0.01,F=1.26、2.43,t=3.72、2.82),见表2。Pearson相关分析提示LN组CXCL10的尿液表达水平与其血清中的表达呈正相关(r=0.40,P<0.05),LN组尿液CXCL16表达水平与SLEDAI评分呈正相关(r=0.34,P<0.05),见图1。Ⅲ型、Ⅳ型、Ⅴ型之间的尿液CXCL16、CXCL10表达水平差异无统计学意义(P>0.05)。
表2 LN患者与正常对照者尿液CXCL16、CXCL10表达水平(μg/L,±s)
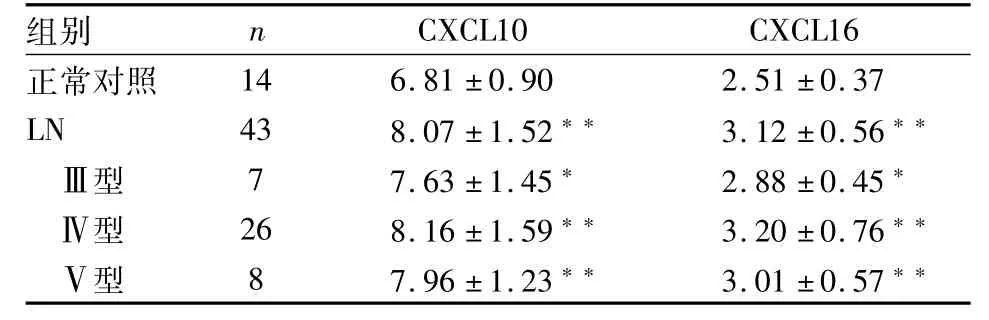
表2 LN患者与正常对照者尿液CXCL16、CXCL10表达水平(μg/L,±s)
与正常对照组比较:**P<0.01,*P<0.05
组别n CXCL10CXCL16正常对照146.81±0.902.51±0.37 LN438.07±1.52**3.12±0.56**Ⅲ型77.63±1.45*2.88±0.45*Ⅳ型268.16±1.59**3.20±0.76**Ⅴ型87.96±1.23**3.01±0.57**
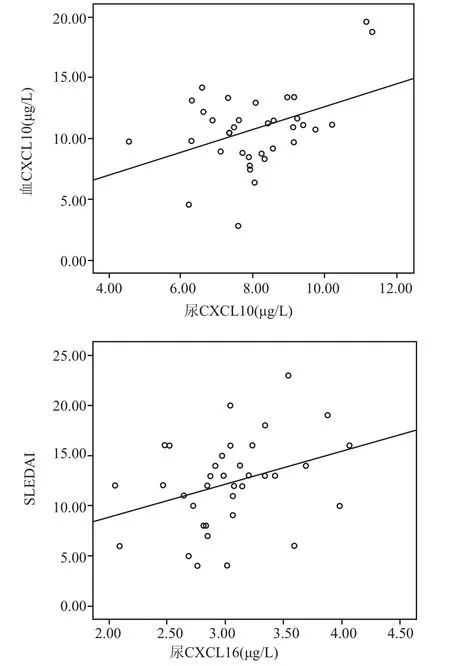
图1 尿液中CXCL10与血清CXCL10、尿液CXCL16水平与SLEDAI评分的散点图
2.3 肾脏中CXCL16的表达在正常对照者的肾脏组织中可见CXCL16在肾小管上皮细胞有较强的表达,但在肾小球未见表达,LN组的肾脏组织可见肾小管上皮细胞CXCL16的表达增加,小球中亦可见到表达,见图2。LN组IOD值较正常对照组表达增加(P<0.05),方差分析提示Ⅳ型的IOD值较Ⅲ型、Ⅴ型LN患者差异有统计学意义(P<0.05),但Ⅲ型、Ⅴ型之间差异无统计学意义,见表3。
2.4 CXCL16、CXCL10在血清中的表达与临床指标相关性分析CXCL10的血清水平与SLEDAI评分呈正相关(r=0.39,P<0.01),与补体C3呈负相关(r=-0.49,P<0.01),与白细胞计数、血小板计数、血清IgG、IgA、IgM、补体C4以及24h尿蛋白等指标无相关性。CXCL16的血清水平与SLEDAI、补体C3、补体C4、白细胞计数、血小板计数、血清IgG、IgA、IgM以及24h尿蛋白等指标无相关性。
表3 LN患者与正常对照者肾内CXCL16水平(±s)

表3 LN患者与正常对照者肾内CXCL16水平(±s)
?
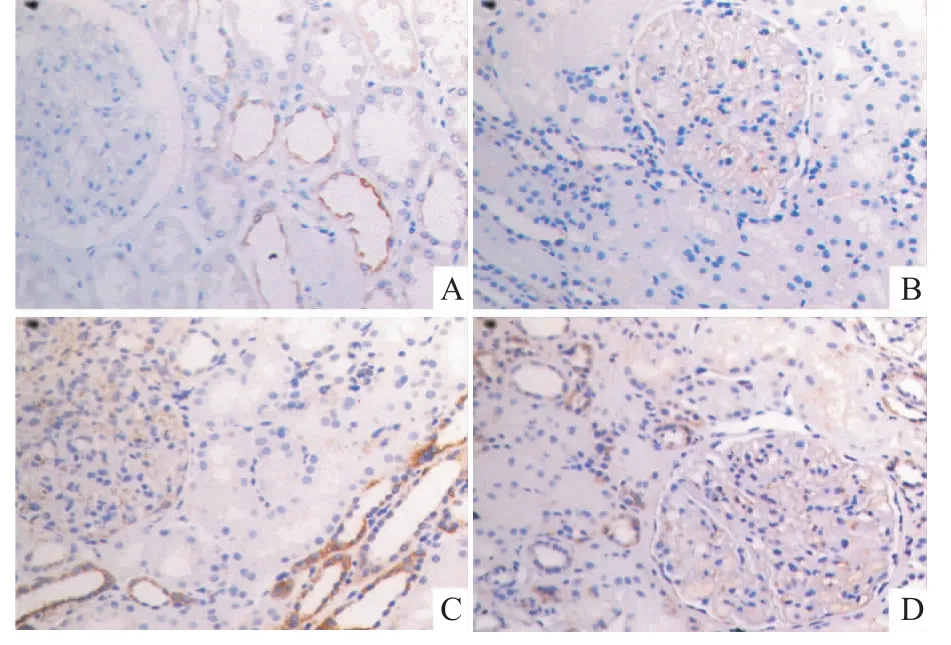
图2 正常肾脏组织以及LN患者肾内CXCL16的表达 SP×400
2.5 CXCL16、CXCL10在尿液中的表达与临床指标相关性分析尿液中CXCL10的水平与SLEDAI评分、白细胞计数、血小板计数、血清IgG、IgA、IgM、补体C3、补体C4以及24h尿蛋白等指标无相关性,CXCL16的尿液水平与SLEDAI评分呈正相关(r=0.34,P<0.05),与其他指标无明显相关性。
3 讨论
CXCL16一般以膜结合型、分泌型两种形式存在,具有主要功能的为分泌型。膜结合型的CXCL16在抗原递呈细胞如单核细胞、巨噬细胞、B细胞、树突状细胞中表达。可溶性CXCL16由细胞膜上的金属蛋白水解酶10裂解切割巨噬细胞和树突状细胞上的膜结合型CXCL16后分泌产生,在效应T细胞的迁移、细胞免疫应答和炎症反应、新生血管以及动脉硬化中发挥十分重要的作用[4-5]。与以往报道类似[3,6],本实验显示LN患者的血清以及尿液中的CXCL16水平均较正常对照者明显上升,并且尿液中CXCL16水平与SLEDAI呈正相关。在MRL-lpr小鼠中,CXCL16 mRNA水平明显增高[7]。这些均提示了CXCL16可能参与了SLE的免疫应答,且本研究显示无论在正常对照组还是LN组尿液中的CXCL16水平均高于血清中的水平,提示CXCL16除了来源于血清还可能来源于肾脏,但其在疾病中的作用有待进一步研究。
在实验性诱导抗肾小球基底膜抗体相关肾小球肾炎中[8],CXCL16在肾小球内皮细胞表达,在肾小球急进性炎症进展阶段,阻断CXCL16可以显著减弱单核巨噬细胞的浸润以及肾小球的损伤,蛋白尿也得到了缓解。在糖尿病肾病小鼠[9]中CXCL16更多地分布在肾小球中的足细胞。本实验通过免疫组化证实了在正常对照组CXCL16较多表达于肾小管上皮细胞,肾小球很少表达[10],但LN组患者中发现肾小管、小球的表达量较正常对照组均上升,尤其是肾小球的表达量明显增加,Ⅳ型LN的表达量较Ⅲ型、Ⅴ型尤为升高,Ⅳ型为LN患者中病理程度最为严重的一种,提示CXCL16可能参与了LN的病理发展过程。
CXCL10是较早发现的一种趋化因子,之前研究较多。与之前的研究结果相似[1,11],本实验同样验证了LN组CXCL10水平较正常对照者明显上升,并与SLEDAI呈正相关,与补体C3呈负相关。儿童LN患者[12]的血清中CXCL10同样明显上升,而且外周血中的CXCR3+CD4+T细胞则下降,可能与肾内组织高表达的CXCL10迁移了外周T细胞有关,但本实验未行肾脏组织CXCL10的免疫组化,在后续的实验中应涉及。
已有研究[13]表明在Ⅳ型LN患者的尿液沉渣细胞中CXCL10和受体CXCR3 mRNA水平较Ⅲ型、Ⅴ型有所上升,本研究中ELISA法同时检测了尿液中的CXCL10的水平,发现LN组也高于正常对照组,并且尿液中的表达水平与血清中CXCL10的表达呈正相关,虽然尿液CXCL10的水平与SLEDAI无明显相关性,但应考虑到在LN组患者中CXCL10的尿液水平小于血清,血清水平更能代表其体内的CXCL10水平,而CXCL16刚好相反,尿液水平表示其体内总体水平更为合适。联合二者之间对于临床判断SLE活动程度有一定的意义,但由于现有LN的研究中关于CXCL16的报道较少,是否与CXCL10之间存在相互关系仍有待进一步验证。
[1] Narumi S,Takeuchi T,Kobayashi Y,et al.Serum levels of IFN-inducible PROTEIN-10 relating to the activity of systemic lupus erythematosus[J].Cytokine,2000,12(10):1561-5.
[2] Matloubian M,David A,Engel S,et al.A transmembrane CXC chemokine is a ligand for HIV-coreceptor Bonzo[J].Nat immunol,2000,1(4):298-304.
[3] Wu T,Xie C,Wang H W,et al.Elevated urinary VCAM-1,P-selectin,soluble TNF receptor-1,and CXC chemokine ligand 16 in multiple murine lupus strains andhuman lupus nephritis[J].J Immunol,2007,179(10):7166-75.
[4] Martini G,Cabrelle A,Calabrese F,et al.CXCR6-CXCL16 interaction in the pathogenesis of Juvenile Idiopathic Arthritis[J].Clin Immunol,2008,129(2):268-76.
[5] Minami M,Kume N,Shimaoka T,et al.Expression of SRPSOX,a novel cell-surface scavenger receptor for phosphatidylserine and oxidized LDL inhuman atherosclerotic lesions[J].Arteri Thromb Vascular Biol,2001,21(11):1796-800.
[6] Singh S,Wu T,Xie C,et al.Urine VCAM-1 as a marker of renal pathology activity index in lupus nephritis[J].Arthritis Res Ther,2012,14(4):R164.
[7] Teramoto K,Negoro N,Kitamoto K,et al.Microarray analysis of glomerular gene expression in murine lupus nephritis[J].Pharmacol Sci,2008,106(1):56-67.
[8] Garcia G E,Truong L D,Li P,et al.Inhibition of CXCL16 attenuates inflammatory and progressive phases of anti-glomerular basement membrane antibody-associated glomerulonephritis[J].Am J Pathol,2007,170(5):1485-96.
[9] 郑敬民,朱小东,张明超,等.CXCL16在db/db糖尿病肾病小鼠肾组织中的表达[J].肾脏病与透析肾移植杂志,2010,19(3):236-40.
[10]Schramme A,Abdel-Bakky M S,Gutwein P,et al.Characterization of CXCL16 and ADAM10 in the normal and transplanted kidney[J].Kidney Int,2008,74(3):328-38.
[11]Lit L C,Wong C K,Tam L S,et al.Raised plasma concentration and ex vivo production of inflammatory chemokines in patients with systemic lupus erythematosus[J].Ann Rheum Dis,2006,65(2):209-15.
[12]Edelbauer M,Kshirsagar S,Riedl M,et al.Activity of childhood lupus nephritis is linked to altered T cell and cytokinehomeostasis[J].J Clin Immunol,2012,32(3):477-87.
[13]Avihingsanon Y,Phumesin P,Benjachat T,et al.Measurement of urinary chemokine and growth factor messenger RNAs:a noninvasive monitoring in lupus nephritis[J].Kidney Int,2006,69(4):747-53.
Expression of CXCL16 and CXCL10 correlates with disease activity in lupus nephritis patients
Xia Qiong,Xu Xingming
(Dept of Nephrology,The First Affiliated Hospital of Anhui Medical University,Hefei 230022)
ObjectiveTo discuss the expression of CXC Chemokine Ligand 16(CXCL16)and CXC Chemokine Ligand 10(CXCL10)in serum,urine and renal tissue in lupus nephritis(LN).MethodsThe serum and urine levels of CXCL10,CXCL16 were assessed by ELISA in LN patients and normal controls.Immunohistochemistry was used to detect the renal tissue expressions of CXCL16 in patients andhealthy controls.ResultsThe serum and urine concentrations of CXCL10 and CXCL16 were significantlyhigher in LN patients than those inhealthy controls(P<0.01).In addition,the level of serum CXCL10 showed positive correlation with SLEDAI and negative correlation with serum C3 level(P<0.01),the expression of urine CXCL16 showed positive correlation with SLEDAI(P<0.05).Inhealthy renal tissues CXCL16 was distributed mainly in renal tubules and rarely seen in glomerular cells while the expressions in renal tubules increased and glomeruli stainings were found in LN paitients.CXCL16 expressed significantly in LN patients than normal controls(P<0.05).Besides,different concentrations of CXCL16 were observed inⅢ,ⅣandⅤLN,the expressions of CXCL16 inⅣLN werehigher than those inⅢLN andⅤLN(P<0.01),while no difference between theⅢLN andⅤLN.ConclusionCXCL10 and CXCL16 may play key roles in the pathogenesis of LN and both of CXCL10 in serum and CXCL16 in urine may be useful as markers of disease activity.The change of CXCL16 may associate with the pathology category of LN.
lupus nephritis;CXCL16;CXCL10
R 593.242
A
1000-1492(2014)04-0491-04
2013-11-25接收
国家自然科学基金(编号:30572356)
安徽医科大学第一附属医院肾脏内科,合肥 230022
夏 琼,女,硕士研究生;徐星铭,女,副教授,副主任医师,硕士生导师,责任作者,E-mail:xxm2425@163.com
LN患者血清以及尿液中的CXCL16、CXCL10与正常对照者比较均升高(P<0.01),且血清中CXCL10水平与系统性红斑狼疮疾病活动指数(SLEDAI)评分呈正相关(r=0.39,P<0.01),与补体C3呈负相关(r=-0.49,P<0.01),尿液中CXCL16水平与SLEDAI评分呈正相关(r=0.34,P<0.05)。正常对照组肾脏的小管上皮细胞可见CXCL16较强的表达,肾小球很少表达,但在LN患者可见小管中表达有所增强,小球中明显增强,其肾内的CXCL16的表达水平较正常对照组上升(P<0.05),尤以Ⅳ型显著(P<0.05)。结论CXCL10、CXCL16可能参与LN的发病过程,血清CXCL10和尿液中CXCL16水平的检测对于判断疾病的临床活动具有一定的意义,其中CXCL16可能与LN的病理变化有关。
